- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Многоатомные предельные спирты: этиленгликоль и глицерин (10 класс)
Содержание
- 1. Презентация по химии Многоатомные предельные спирты: этиленгликоль и глицерин (10 класс)
- 2. CnH2n(OH)2CnH2n-1(OH)3C2H6O2, илиC2H4(OH)2C3H8O3, илиC3H5(OH)3 этандиол-1,2 (этиленгликоль)пропантриол-1,2,3
- 3. Во всех многоатомных спиртах гидроксильные группы находятся
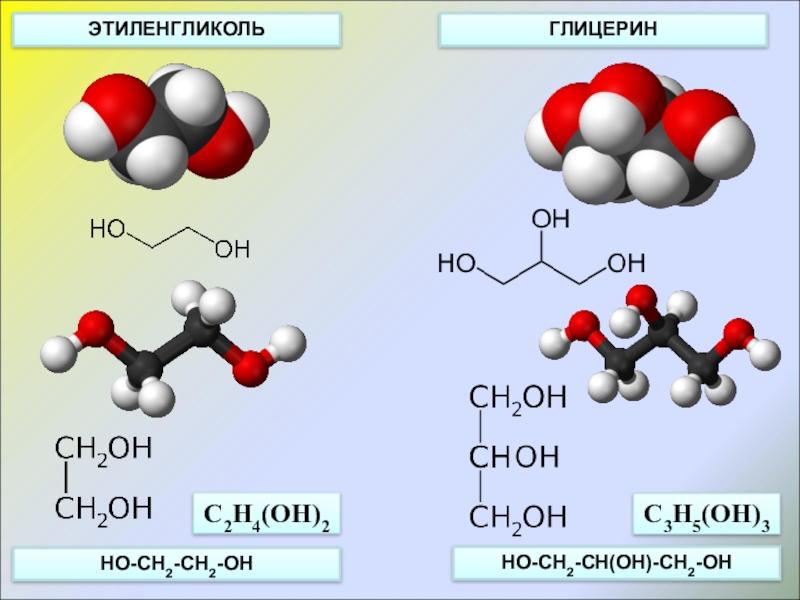
- 4. ЭТИЛЕНГЛИКОЛЬГЛИЦЕРИНHO-CH2-CH2-OHHO-CH2-CH(OH)-CH2-OHC2H4(OH)2C3H5(OH)3
- 5. ФИЗИЧЕСКИЕ СВОЙСТВАЭТИЛЕНГЛИКОЛЬГЛИЦЕРИНвязкая, сиропообразная жидкость, обладает сладким
- 6. И этиленгликоль, и глицерин хорошо растворяются в
- 7. СПОСОБЫ ПОЛУЧЕНИЯ ЭТИЛЕНГЛИКОЛЯ1) Гидролиз дигалогеналканов (реакция проводится в присутствии щелочей и при нагревании) (водный раствор)
- 8. 2) Окисление алкенов водным раствором перманганата калия
- 9. 1) Водные растворы этиленгликоля применяют в качестве
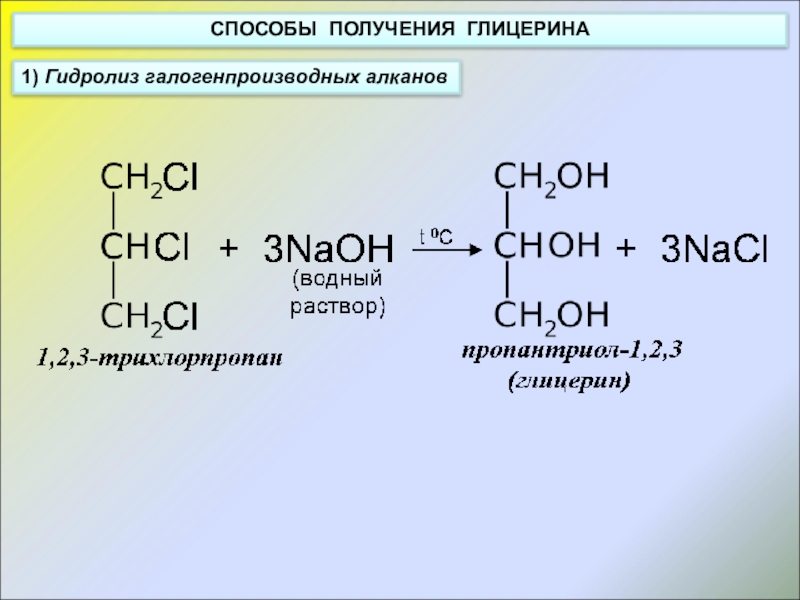
- 10. СПОСОБЫ ПОЛУЧЕНИЯ ГЛИЦЕРИНА1) Гидролиз галогенпроизводных алканов
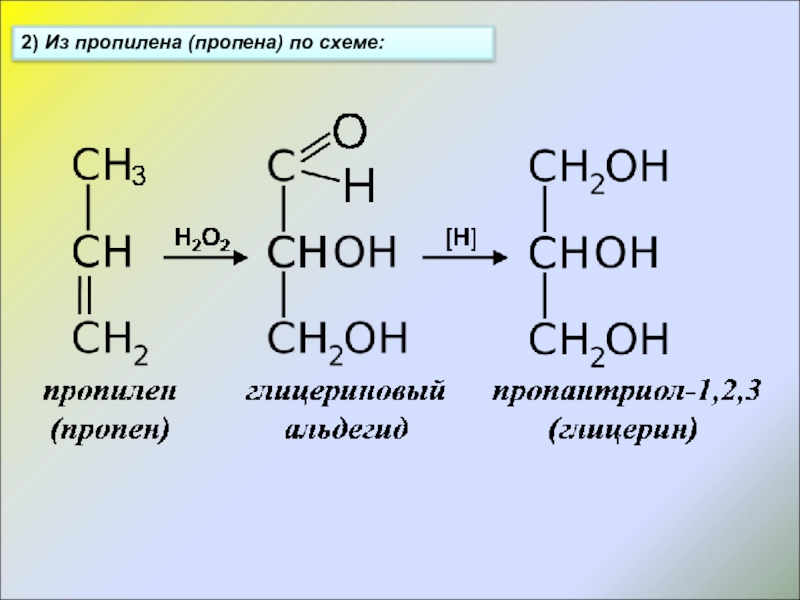
- 11. 2) Из пропилена (пропена) по схеме:
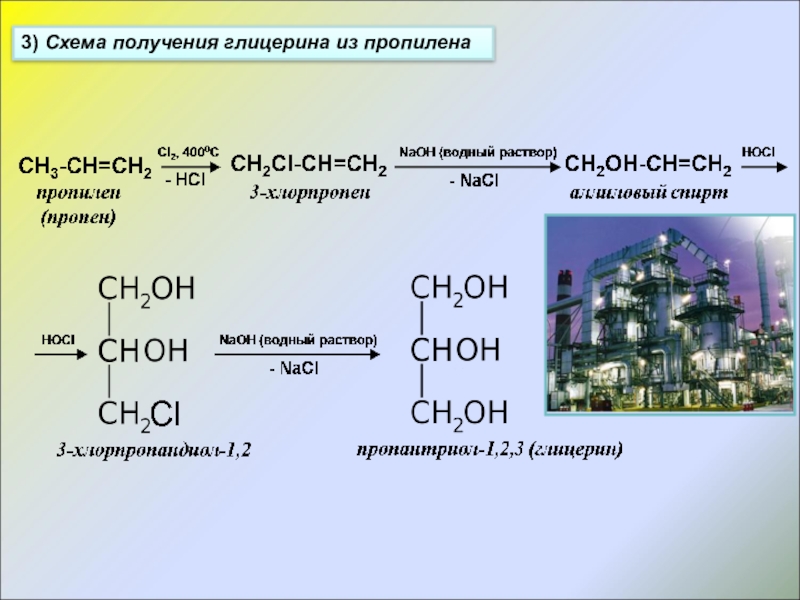
- 12. 3) Схема получения глицерина из пропилена
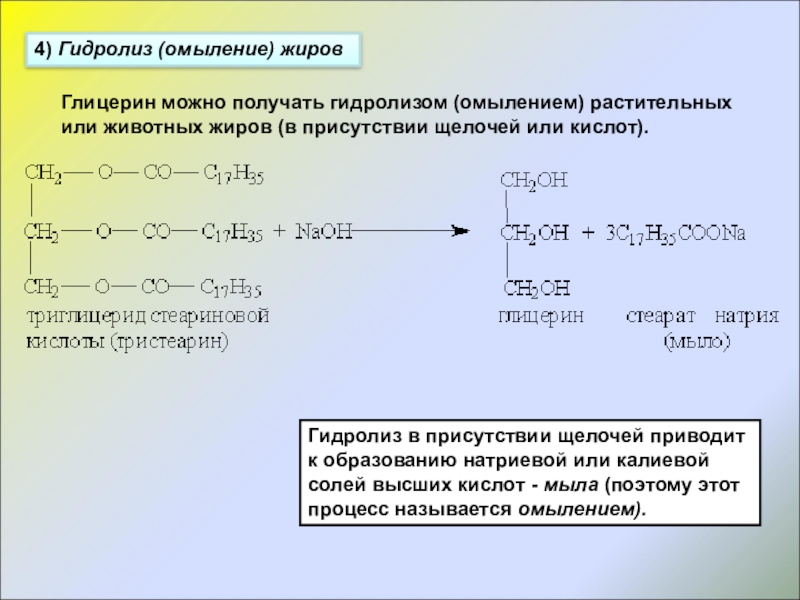
- 13. 4) Гидролиз (омыление) жировГлицерин можно получать гидролизом
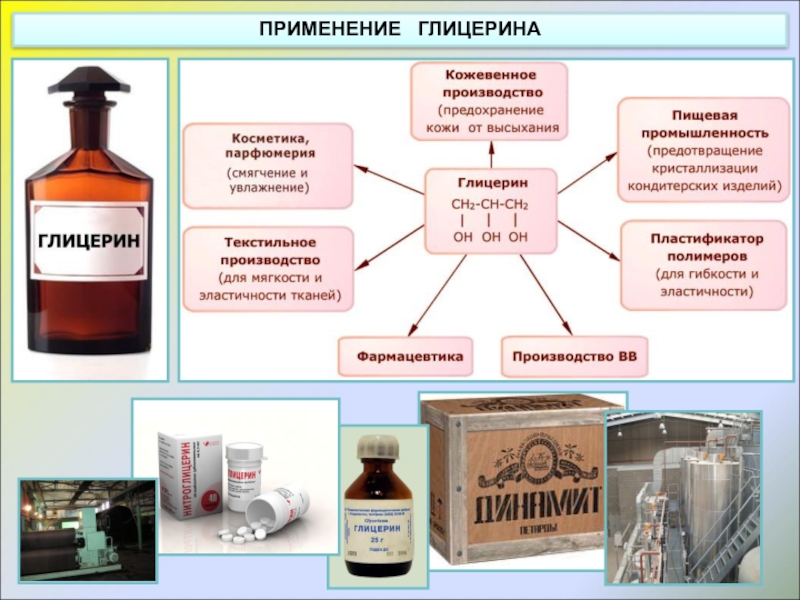
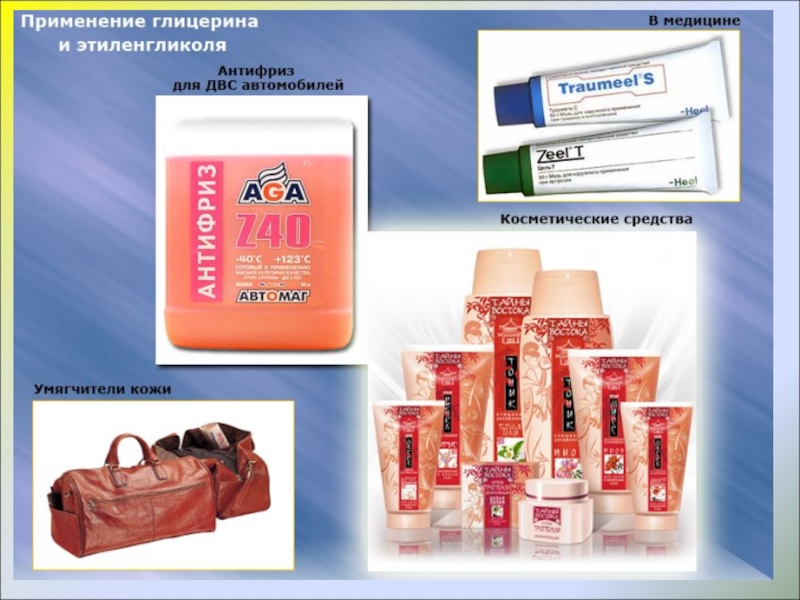
- 14. ПРИМЕНЕНИЕ ГЛИЦЕРИНА
- 15. ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ И ГЛИЦЕРИНА1) Взаимодействие со
- 16. Взаимодействие глицерина с металлическим натриемВ пробирку с
- 17. 2) Замещение гидроксогрупп на галоген (при действии
- 18. 3) Взаимодействие с азотной кислотой (HNO3 или
- 19. 4) Межмолекулярная дегидратация этиленгликоля (Реакция Фаворского)При изучении
- 20. 5) Качественная реакция на этиленгликоль и глицерин
- 21. 6) Окисление многоатомных спиртовВзаимодействие глицерина с кристаллическим
- 22. Слайд 22
- 23. Домашнее задание§17,стр.143-153стр.155 упр.13(письменно)
Слайд 1Многоатомные предельные спирты
Попов Владимир Викторович,
учитель химии и географии
МБОУ «Котельская СОШ»
Слайд 2CnH2n(OH)2
CnH2n-1(OH)3
C2H6O2, или
C2H4(OH)2
C3H8O3, или
C3H5(OH)3
этандиол-1,2
(этиленгликоль)
пропантриол-1,2,3
(глицерин)
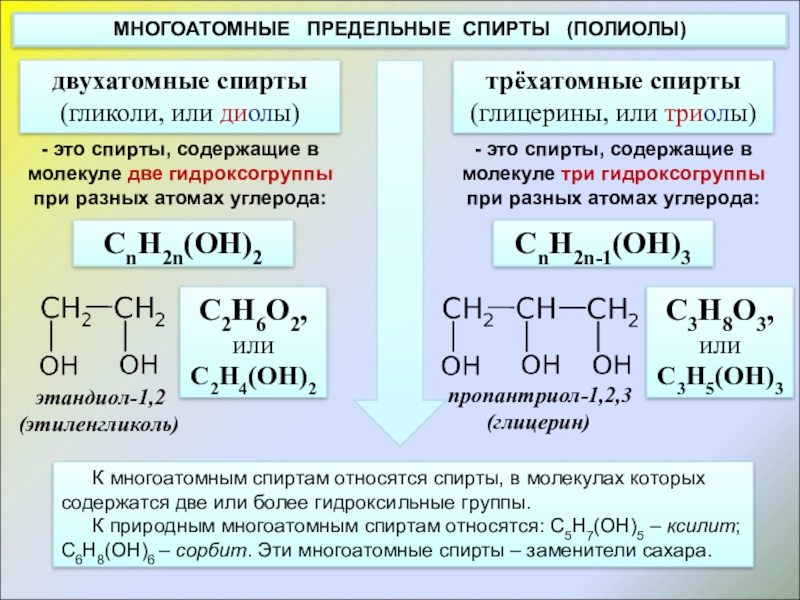
МНОГОАТОМНЫЕ
двухатомные спирты
(гликоли, или диолы)
трёхатомные спирты
(глицерины, или триолы)
- это спирты, содержащие в молекуле две гидроксогруппы при разных атомах углерода:
- это спирты, содержащие в молекуле три гидроксогруппы при разных атомах углерода:
К многоатомным спиртам относятся спирты, в молекулах которых содержатся две или более гидроксильные группы.
К природным многоатомным спиртам относятся: C5H7(OH)5 – ксилит; C6H8(OH)6 – сорбит. Эти многоатомные спирты – заменители сахара.
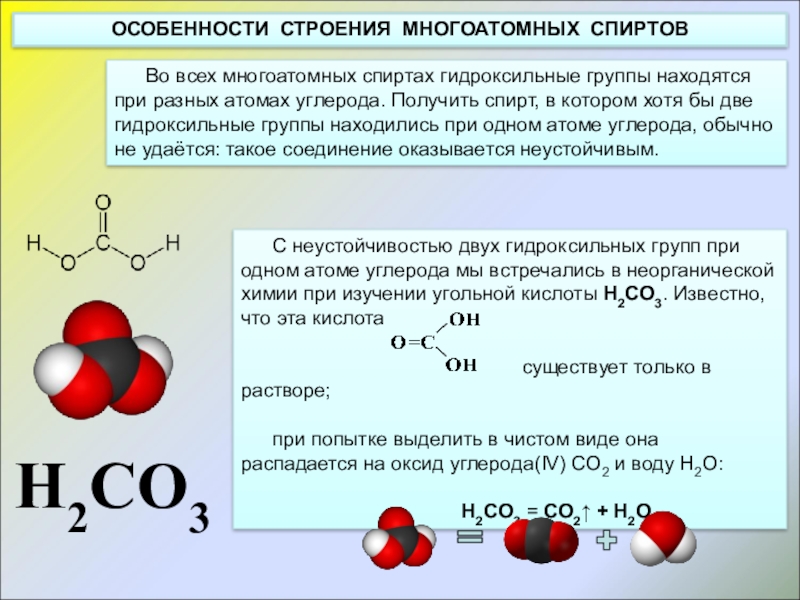
Слайд 3Во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода.
ОСОБЕННОСТИ СТРОЕНИЯ МНОГОАТОМНЫХ СПИРТОВ
C неустойчивостью двух гидроксильных групп при одном атоме углерода мы встречались в неорганической химии при изучении угольной кислоты H2CO3. Известно, что эта кислота
существует только в растворе;
при попытке выделить в чистом виде она распадается на оксид углерода(IV) CO2 и воду H2O:
H2CO3 = CO2↑ + H2O
H2CO3
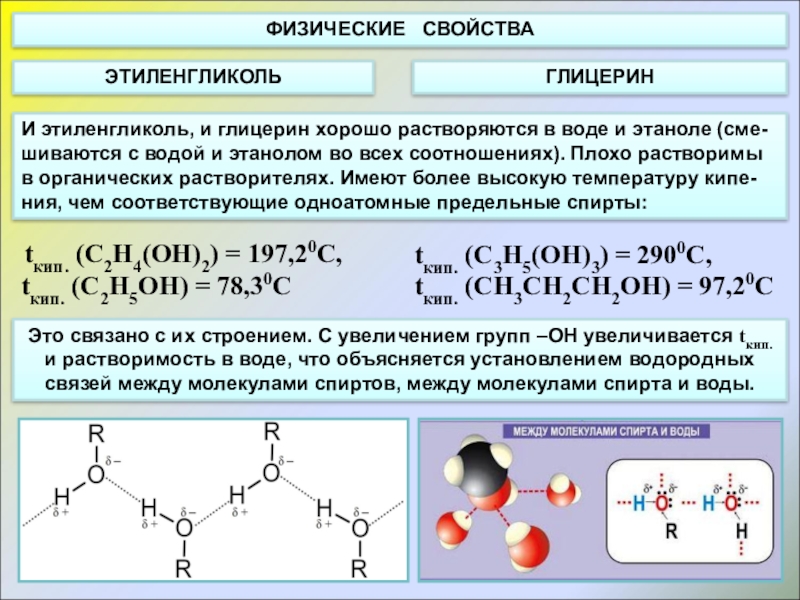
Слайд 5ФИЗИЧЕСКИЕ СВОЙСТВА
ЭТИЛЕНГЛИКОЛЬ
ГЛИЦЕРИН
вязкая, сиропообразная жидкость, обладает сладким вкусом (от
Обладает спиртовым запахом; очень ядовит, оказывает опьяняющее действие и может быть причиной тяжёлых отравлений (интоксикаций)
вязкая, сиропообразная, бесцветная жидкость сладкого вкуса. Нетоксичен. Нелетуч.
Обладает гигроскопичностью, т.е. жадно поглощает воду. Является составной частью большинства природных жиров и масел.
Слайд 6И этиленгликоль, и глицерин хорошо растворяются в воде и этаноле (сме-шиваются
tкип. (C2H4(OH)2) = 197,20С,
tкип. (C2H5OH) = 78,30С
tкип. (C3H5(OH)3) = 2900С,
tкип. (CН3СH2СH2OH) = 97,20С
Это связано с их строением. С увеличением групп –ОН увеличивается tкип. и растворимость в воде, что объясняется установлением водородных связей между молекулами спиртов, между молекулами спирта и воды.
ФИЗИЧЕСКИЕ СВОЙСТВА
ЭТИЛЕНГЛИКОЛЬ
ГЛИЦЕРИН
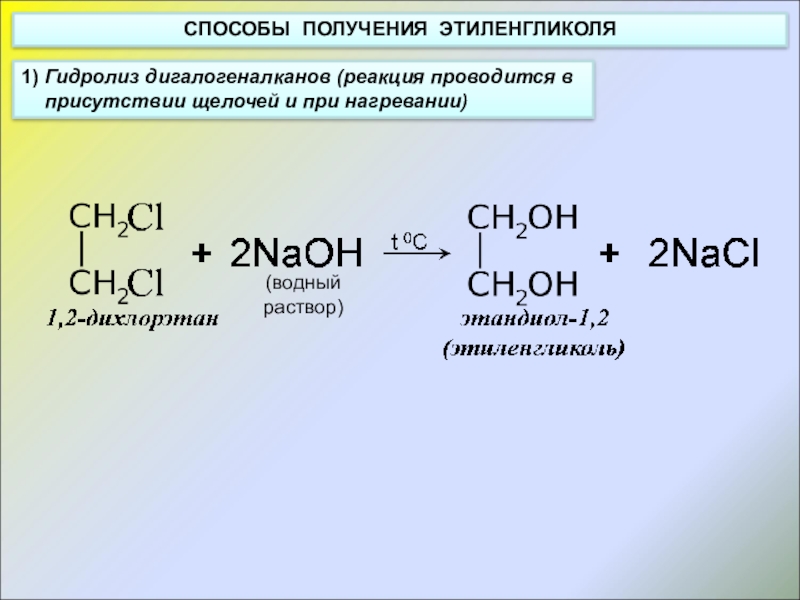
Слайд 7СПОСОБЫ ПОЛУЧЕНИЯ ЭТИЛЕНГЛИКОЛЯ
1) Гидролиз дигалогеналканов (реакция проводится в присутствии щелочей и
(водный
раствор)
Слайд 82) Окисление алкенов водным раствором перманганата калия KMnO4 (реакция Е.Е. Вагнера)
Или в упрощённом виде:
СН2=СН2 + [О] + Н-ОН → CH2ОН - CH2ОН
Егор Егорович Вагнер
(17.11.1849 - 14.11.1903)
- выдающийся русский химик-органик.
Его докторская диссертация "К реакции окисления непредельных углеродистых соединений" (1888 г.) посвящена разработке общего способа окисления этиленовых связей перманганатом, который получил в науке название "окисление по Вагнеру".
Слайд 91) Водные растворы этиленгликоля применяют в качестве антифризов – низкозамерзающих жидкостей
2) В гораздо больших количествах этиленгликоль используется в производстве полимеров, которые являются основой некоторых видов пластмасс и волокон. Так, этиленгликоль используется как один из исходных продуктов в производстве синтетического волокна лавсана.
ПРИМЕНЕНИЕ ЭТИЛЕНГЛИКОЛЯ
Слайд 134) Гидролиз (омыление) жиров
Глицерин можно получать гидролизом (омылением) растительных или животных
Гидролиз в присутствии щелочей приводит к образованию натриевой или калиевой солей высших кислот - мыла (поэтому этот процесс называется омылением).
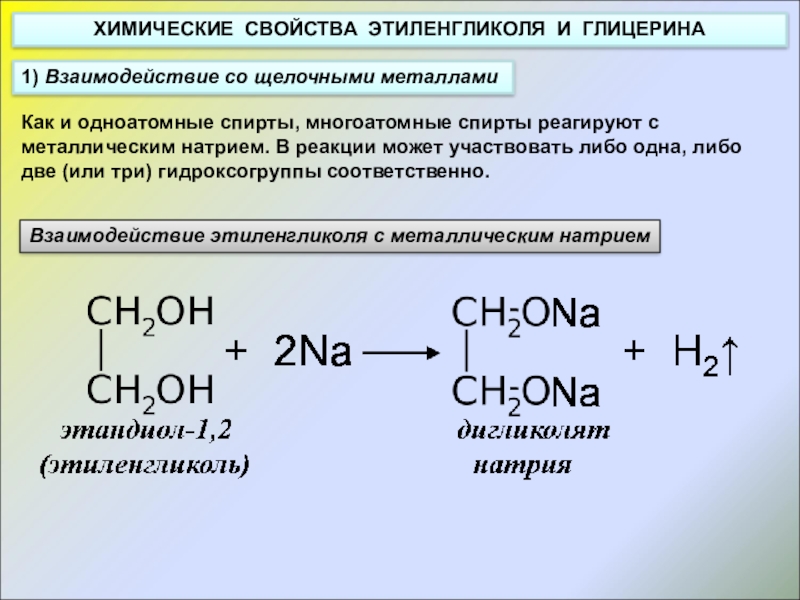
Слайд 15ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ И ГЛИЦЕРИНА
1) Взаимодействие со щелочными металлами
Взаимодействие этиленгликоля с
Как и одноатомные спирты, многоатомные спирты реагируют с металлическим натрием. В реакции может участвовать либо одна, либо две (или три) гидроксогруппы соответственно.
Слайд 16Взаимодействие глицерина с металлическим натрием
В пробирку с глицерином бросим кусочек натрия.
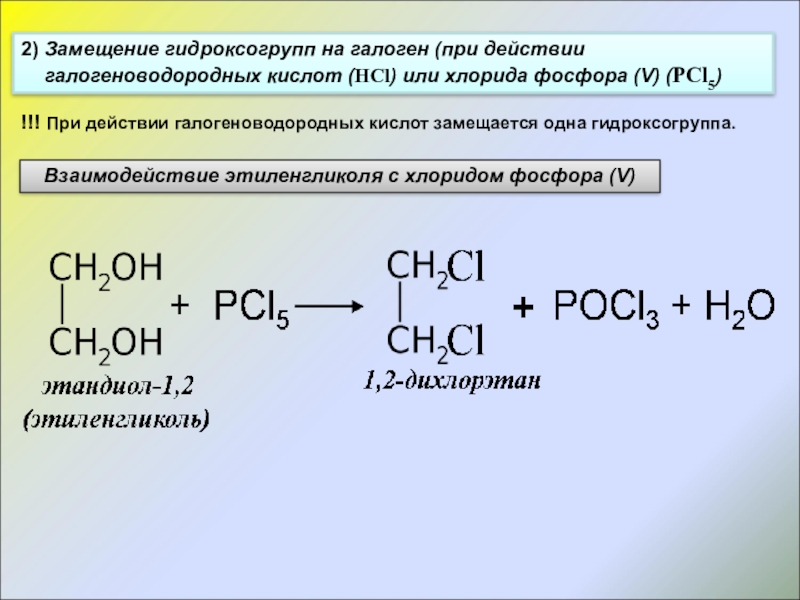
Слайд 172) Замещение гидроксогрупп на галоген (при действии галогеноводородных кислот (HCl) или
Взаимодействие этиленгликоля с хлоридом фосфора (V)
!!! При действии галогеноводородных кислот замещается одна гидроксогруппа.
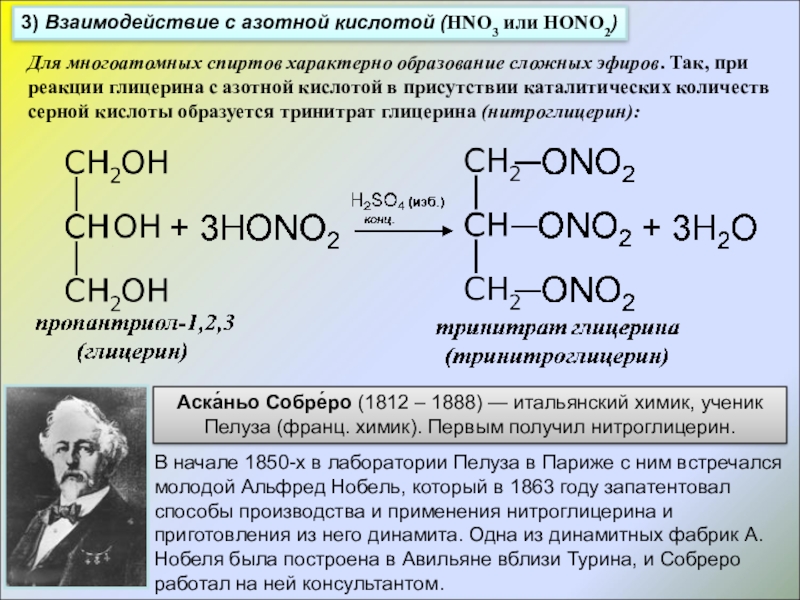
Слайд 183) Взаимодействие с азотной кислотой (HNO3 или HONO2)
Для многоатомных спиртов
Аска́ньо Собре́ро (1812 – 1888) — итальянский химик, ученик Пелуза (франц. химик). Первым получил нитроглицерин.
В начале 1850-х в лаборатории Пелуза в Париже с ним встречался молодой Альфред Нобель, который в 1863 году запатентовал способы производства и применения нитроглицерина и приготовления из него динамита. Одна из динамитных фабрик А.Нобеля была построена в Авильяне вблизи Турина, и Собреро работал на ней консультантом.
Слайд 194) Межмолекулярная дегидратация этиленгликоля (Реакция Фаворского)
При изучении взаимодействия этиленгликоля с серной
Алексей Евграфович Фаворский (1860-1945) химик, учёный энциклопедист, новатор в науке и её практических приложениях. Он является учителем нескольких поколений химиков-органиков и основателем крупнейшей научной школы органической химии в нашей стране.
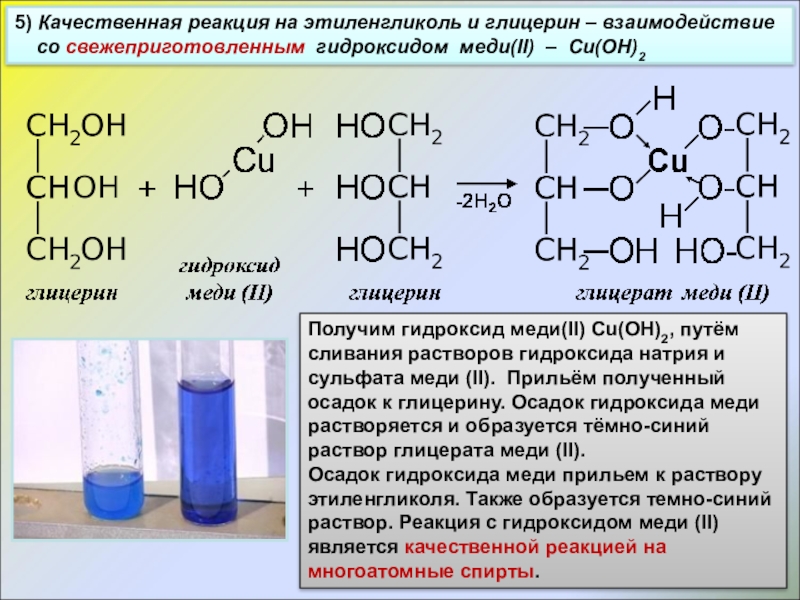
Слайд 205) Качественная реакция на этиленгликоль и глицерин – взаимодействие
со
Получим гидроксид меди(II) Cu(OH)2, путём сливания растворов гидроксида натрия и сульфата меди (II). Прильём полученный осадок к глицерину. Осадок гидроксида меди растворяется и образуется тёмно-синий раствор глицерата меди (II).
Осадок гидроксида меди прильем к раствору этиленгликоля. Также образуется темно-синий раствор. Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты.
Слайд 216) Окисление многоатомных спиртов
Взаимодействие глицерина с кристаллическим перманганатом калия KMnO4
К растёртому
2С3Н8О3 + 7О2 → 6СО2 + 8Н2О
2С2Н6О2 + 5О2 → 4СО2 + 6Н2О
этандиол-1,2
(этиленгликоль)
пропантриол-1,2,3
(глицерин)

![Презентация по химии Многоатомные предельные спирты: этиленгликоль и глицерин (10 класс) 2) Окисление алкенов водным раствором перманганата калия KMnO4 (реакция Е.Е. Вагнера) 2) Окисление алкенов водным раствором перманганата калия KMnO4 (реакция Е.Е. Вагнера) Или в упрощённом виде:СН2=СН2 + [О]](/img/thumbs/374114059f16a069c0e90e2f9166a018-800x.jpg)