- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Кремний (9 класс)
Содержание
- 1. Презентация по химии Кремний (9 класс)
- 2. Горный хрустальСтекло Кирпич Песок
- 3. Слайд 3
- 4. Кремний – Соединения: - кислотный оксид
- 5. Тема урока:Кремний. Оксиды кремния. Кремниевая кислота. Силикаты.
- 6. Цель :узнать…понять…научиться…
- 7. «Необычное мыло» В 50-е годы двадцатого века,
- 8. Алгоритм работы в группеРаспределить роли в группе.Выполнить
- 9. Кремний - SiФизические свойства
- 10. Получение кремния (Si)Лабораторный способ:SiO2 + 2Mg =
- 11. Химические свойства кремния (Si)С неметаллами:Si +
- 12. Применение кремния (Si) Кремниевые сталиСиликоновый каучукСиликоновый герметикСолнечные батареи
- 13. Оксид кремния (IV) – SiO2 кремнезём, песокФизические
- 14. Получение оксида кремния (IV) (SiO2)Промышленный способ:Si+
- 15. Химические свойства оксида кремния (IV) (SiO2)Со щелочами:SiO2
- 16. Применение оксида кремния (IV) (SiO2)
- 17. Применение оксида кремния (IV) (SiO2)Обработка полудрагоценных камней.Аметист лиловыйЯшма Агат Халцедон Сердолик
- 18. Кремниевая кислота – H2SiO3Физические свойства:Практически нерастворимое в воде вещество, гель – студенистый осадок, неустойчивое химическое соединение.
- 19. Получение кремниевой кислоты (H2SiO3)Лабораторный способ получения:Na2 SiO3 + 2HCl = 2NaCl + H2 SiO3↓
- 20. Химические свойства кремниевой кислоты (H2SiO3)1. Термическое
- 21. Применение кремниевой кислоты (H2SiO3)Адсорбент;Получение силикагеля, который
- 22. Силикаты – SiO32-Физические свойства (на примере силикатного клея)
- 23. Получение силикатов:Вытеснение более летучего кислотного оксида из
- 24. Химические свойства силикатов:С кислотами:Na2SiO3+ H2CO3= Na2CO3 +
- 25. Применение силикатовПропитка древесины, для придания огнеупорности.2. Силикатный клей.4. Жидкое стекло.Агат Сердолик
- 26. «Необычное мыло» В 50-е годы двадцатого века,
- 27. Силикатный клей – это раствор соли силиката
- 28. Слайд 28
- 29. Т е с т Как называется вещество
- 30. Т е с т 2. Назовите вещество,
- 31. Т е с т 3. Какое вещество
- 32. Т е с т 4. Вставьте пропущенное
- 33. Т е с т 5. Взаимодействие Na2SiO3
- 34. Проверь себя!1 – 3 2 – 1 3 – 34 – 2 5 – 3
- 35. Цель :узнать…понять…научиться…
- 36. Домашнее задание:Выучить таблицу Для изготовления
- 37. Спасибо за работу!!!
Слайд 4Кремний –
Соединения:
- кислотный оксид –
- кислота –
- соль
Si неметалл
SiO2 оксид
Кремния (IV)
H2SiO3 кремниевая
кислота
SiO32- - силикаты
Слайд 7«Необычное мыло» В 50-е годы двадцатого века, еще до появления стиральных порошков
Слайд 8Алгоритм работы в группе
Распределить роли в группе.
Выполнить задание в соответствии с
Соблюдать правила техники безопасности.
Ответы занести в маршрутный лист.
Подвести итоги работы в группе.
Работу выполняем в течение 10 минут.
Слайд 10Получение кремния (Si)
Лабораторный способ:
SiO2 + 2Mg = Si + 2MgO
2. Промышленный
2С + SiO2 = Si + 2CO
Слайд 11Химические свойства
кремния (Si)
С неметаллами:
Si + 2F2 = SiF4 (фторид кремния)
2.
2Mg + Si = Mg2Si (силицид магния)
3. Со щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
4. С кислотами
Si + 4HF = SiF4 + 2H2
(силан)
5. С основными оксидами:
2FeO + Si = SiO2 + 2Fe
Слайд 12Применение кремния (Si)
Кремниевые стали
Силиконовый каучук
Силиконовый герметик
Солнечные батареи
Слайд 13Оксид кремния (IV) – SiO2 кремнезём, песок
Физические свойства:
Твердое, тугоплавкое вещество, нерастворимое
Слайд 14Получение
оксида кремния (IV) (SiO2)
Промышленный способ:
Si+ O2 = SiO2
2.
H2 SiO3 = SiO2 + H2O
Слайд 15Химические свойства оксида кремния (IV) (SiO2)
Со щелочами:
SiO2 + 2NaOH = Na2
2. С основными оксидами:
СaO + SiO2 = CaSiO3
3. Отношение к воде:
Не взаимодействует!
4. Вытеснение более летучий кислотный оксид из солей:
Na2CO3 + SiO2 = Na2SiO3 + CO2
Слайд 17Применение
оксида кремния (IV) (SiO2)
Обработка полудрагоценных камней.
Аметист
лиловый
Яшма
Агат
Халцедон
Сердолик
Слайд 18Кремниевая кислота – H2SiO3
Физические свойства:
Практически нерастворимое
в воде вещество,
гель –
Слайд 19Получение
кремниевой кислоты (H2SiO3)
Лабораторный способ получения:
Na2 SiO3 + 2HCl = 2NaCl
Слайд 20Химические свойства
кремниевой кислоты (H2SiO3)
1. Термическое разложение:
H2SiO3 = SiO2 + H2O
2.
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O
3. Отношение к индикаторам:
H2SiO3 +метилоранж = не окрашивает,
т.к. слабая кислота
Слайд 21Применение
кремниевой кислоты (H2SiO3)
Адсорбент;
Получение силикагеля, который применяют в промышленности и медицине;
Получают
Слайд 23Получение силикатов:
Вытеснение более летучего кислотного оксида из солей:
SiO2 + Na2CO3 =
2. Обработка кремнезема концентрированным раствором щелочи:
SiO2 + 2NaOH = Na2SiO3 + H2O
Слайд 24Химические свойства силикатов:
С кислотами:
Na2SiO3+ H2CO3= Na2CO3 + H2SiO3
2. С растворами
Na2 SiO3 + MgCl2 = 2NaCl + MgSiO3
3. Гидролиз
Na2SiO3 + H2O = NaHSiO3 + NaOH
Слайд 25Применение силикатов
Пропитка древесины, для придания огнеупорности.
2. Силикатный клей.
4. Жидкое стекло.
Агат
Сердолик
Слайд 26«Необычное мыло» В 50-е годы двадцатого века, еще до появления стиральных порошков
Слайд 27Силикатный клей – это раствор соли силиката натрия Na2SiO3 в воде.
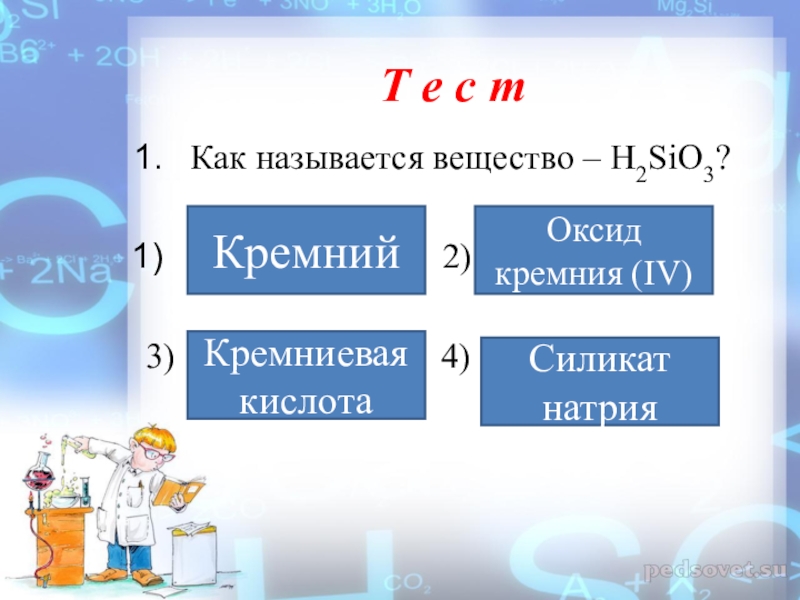
Слайд 29Т е с т
Как называется вещество – H2SiO3?
2)
3) 4)
Кремний
Оксид кремния (IV)
Кремниевая кислота
Силикат натрия
Слайд 30Т е с т
2. Назовите вещество, которое существует в двух
1) 2)
3) 4)
Кремний
Оксид кремния (IV)
Кремниевая кислота
Силикат натрия
Слайд 31Т е с т
3. Какое вещество можно получить по уравнению
(Na2SiO3 + 2HCl = 2NaCl + …)
1) 2)
3) 4)
Кремний
Оксид кремния (IV)
Кремниевая кислота
Силикат натрия
Слайд 32Т е с т
4. Вставьте пропущенное слово:
Оксид кремния является …
1) 2)
Амфотерным
Кислотным
Основным
3)
Слайд 33Т е с т
5. Взаимодействие Na2SiO3 c H2O называется реакцией
1) 2)0
3) 4)
Разложения
Замещения
Гидролиза
Соединения
Слайд 36Домашнее задание:
Выучить таблицу
Для изготовления пудры применяют в различных