- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Коррозия металлов
Содержание
- 1. Презентация по химии Коррозия металлов
- 2. Цели урока- выяснить, что такое коррозия, её
- 3. Химический диктант: -
- 4. В настоящее время мы являемся свидетелями разрушения
- 5. КоррозияСлово коррозия происходит от латинского corrodere, что
- 6. Причины коррозии А) газы (O2,SO2, H2S, Cl2,
- 7. Коррозийные процессыКОРРОЗИЯ - РЖАВАЯ КРЫСА,ГРЫЗЕТ МЕТАЛЛИЧЕСКИЙ ЛОМ,В ШЕФНЕР4Fe + 6H2O + 3O2 = 4Fe(OH)3
- 8. Виды коррозииКоррозияХимическаяЭлектрохимическая
- 9. КлассификацияКоррозия металловПо виду коррозийной средыПо характеру разрушенийПо процессамГазоваяЖидкостнаяАтмосфернаяРавномернаяПочвеннаяНеравномернаяХимическаяЭлектрохимическая
- 10. Химическая коррозияХимическая коррозия обусловлена взаимодействием металлов с
- 11. Электрохимическая коррозия осуществляется за счет электрохимических реакций,
- 12. Электрохимический ряд напряжений металловLi, K, Ba, Ca,
- 13. Коррозия металловСПЛОШНАЯне представляет особой опасности для конструкций
- 14. Опыт №1. Цинковую гранулу опускаем в раствор
- 15. Опыт №2. К цинку прикасаемся медной проволокой
- 16. Опыт №3. Медную и цинковую пластинки в
- 17. Способы защиты металлов от коррозии. 1. Легирование
- 18. Опыт №4. Цинковая пластинка опускается в
- 19. Закрепление знанийКонтрольные вопросы:1. Дайте определение коррозии металлов.2.
- 20. Итоги урокаРазрушить проще, чем построить. Потерять гораздо
- 21. Творческие задания. 1. Для хозяйственных нужд вам
- 22. Домашнее заданиеУчебник «Химия» для профессий НПО и
Слайд 1Коррозия металлов
Автор: Лепешенко Татьяна Ивановна
преподаватель химии и биологии ГБОУ НПО
Слайд 2Цели урока
- выяснить, что такое коррозия, её виды, механизм (на примере
- отработать умение выполнять эксперимент, делать выводы из увиденного, составлять полуреакции окисления и восстановления исходя из положения металлов в электрохимическом ряду напряжений.
Слайд 3Химический диктант
:
- реакции, протекающие с изменением
элемент, повышающий степень окисления в результате реакции, называется …
процесс присоединения электронов называется ….
окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока, называется …
катод заряжен …
на аноде идёт процесс …
при электролизе расплава бромида калия на катоде восстанавливается …
при электролизе расплава гидроксида калия на аноде выделяется газообразный …
определить окислитель и восстановитель в схеме реакции:
Zn + AgNO3 – Zn(NO3)2 + Ag
Слайд 4В настоящее время мы являемся свидетелями разрушения архитектурных сооружений и конструкций. От
Слайд 5Коррозия
Слово коррозия происходит от латинского corrodere, что означает разъедать.
Коррозией
Слайд 6Причины коррозии
А) газы (O2,SO2, H2S, Cl2, NH3, NO, NO2, H2O-пар и
Б) электролиты: щёлочи, кислоты, соли;
В) ионы Сl-, влажность воздуха;
Г) макро- и микроорганизмы;
Е) блуждаюший электрический ток;
Ж ) разнородность металлов.
Слайд 7Коррозийные процессы
КОРРОЗИЯ - РЖАВАЯ КРЫСА,
ГРЫЗЕТ МЕТАЛЛИЧЕСКИЙ ЛОМ,
В ШЕФНЕР
4Fe + 6H2O +
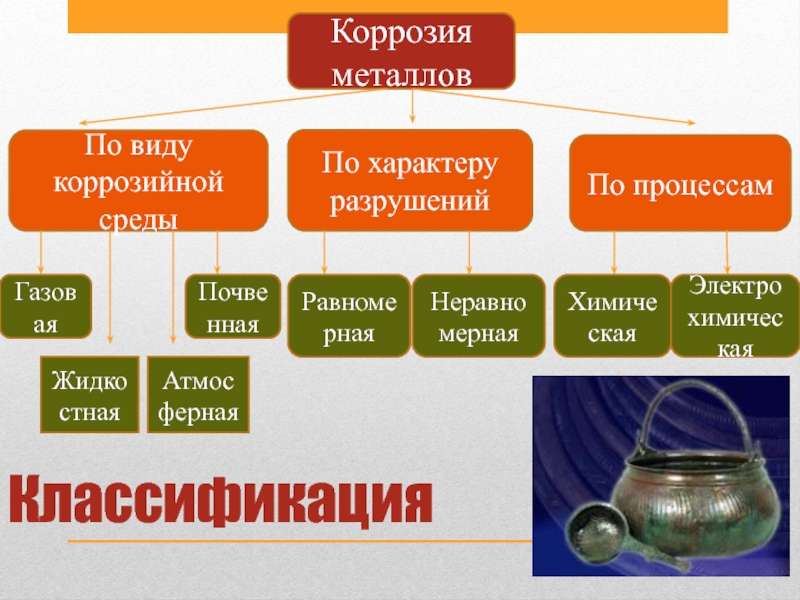
Слайд 9Классификация
Коррозия металлов
По виду коррозийной среды
По характеру разрушений
По процессам
Газовая
Жидкостная
Атмосферная
Равномерная
Почвенная
Неравномерная
Химическая
Электрохимическая
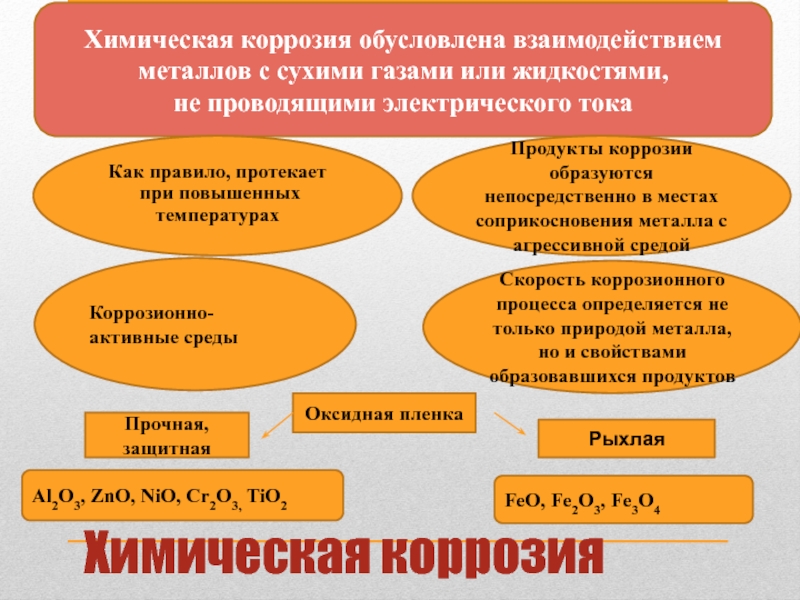
Слайд 10Химическая коррозия
Химическая коррозия обусловлена взаимодействием
металлов с сухими газами или жидкостями,
не
Как правило, протекает
при повышенных
температурах
Продукты коррозии образуются непосредственно в местах соприкосновения металла с агрессивной средой
Коррозионно-активные среды
Скорость коррозионного процесса определяется не только природой металла, но и свойствами образовавшихся продуктов
Оксидная пленка
Прочная, защитная
Рыхлая
Al2O3, ZnO, NiO, Cr2O3, TiO2
FeO, Fe2O3, Fe3O4
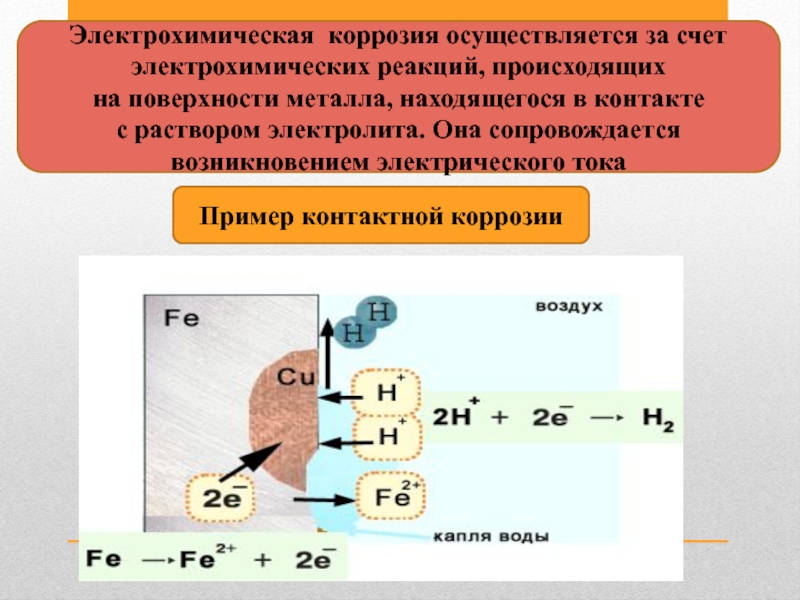
Слайд 11Электрохимическая коррозия осуществляется за счет
электрохимических реакций, происходящих
на поверхности металла,
с раствором электролита. Она сопровождается
возникновением электрического тока
Пример контактной коррозии
Слайд 12Электрохимический ряд напряжений металлов
Li, K, Ba, Ca, Na, Mg, Al, Mn,
Ослабление восстановительных свойств, активности
Слайд 13Коррозия металлов
СПЛОШНАЯ
не представляет особой опасности для конструкций и аппаратов особенно в
МЕСТНАЯ
потери металла небольшие. Наиболее опасна – точечная коррозия(образование сквозных поражений, точечных полостей – так называемых питтингов. Местной коррозии благоприятствуют морская вода, растворы солей, в частности галогенидных (хлорид натрия, магния и др.). Опасность местной коррозии состоит в том, что, снижая прочность отдельных участков, она резко уменьшает надежность конструкций, сооружений, аппаратов.
Слайд 14Опыт №1.
Цинковую гранулу опускаем в раствор соляной кислоты. Наблюдаем выделение водорода.
Сначала реакция протекает быстро, а затем постепенно замедляется. Это обусловлено тем, что ионы цинка переходят в раствор и образуют у поверхности металла слой положительно заряженных ионов. Этот слой является барьером, препятствующим проникновению одноимённо заряженных ионов водорода к поверхности металла. Кроме того, при растворении цинка в его кристаллической решётке накапливаются электроны, которые затрудняют дальнейший переход поверхностных ионов цинка в раствор. Это и приводит к замедлению взаимодействия цинка с кислотой.
Слайд 15Опыт №2.
К цинку прикасаемся медной проволокой – растворение цинка усиливается.
Это объясняется
2Н+ + 2е = Н20
В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические ( перенос электронов от одного металла к другому).
Освободившись от избыточных электронов цинк снова окисляется:
Zn0 – 2e = Zn2+
Кроме этого, поверхностные ионы цинка теперь не удерживаются электростатическим притяжением электронов и распределяются по раствору, поэтому цинк в контакте с медью растворяется быстрее. Таким образом, усиление коррозии цинка в контакте с медью объясняется возникновением короткозамкнутого гальванического элемента. В котором цинк выполняет роль анода, а медь – катода.
Слайд 16Опыт №3.
Медную и цинковую пластинки в растворе НСl соединяем проводником, наблюдаем
Анод (Zn): Zn0 – 2e – Zn2+
Катод (Сu): 2H+ + 2e – H20
Аналогично происходит коррозия металлов, которые неоднородны и содержат примеси. В присутствии электролита одни участки поверхности металла играют роль анода, другие – катода.
На катоде происходит окисление атомов металла: Ме0 – ne = Men+
При этом на металле остаются избыточные электроны. Роль анода выполняет более активный металл.
На катоде происходит принятие электронов, которые поступают с анода, каким-либо окислителем. В кислотах в качестве окислителя выступают ионы водорода. В нейтральной среде в качестве окислителя преимущественно выступает растворённый кислород, тогда на катоде протекает процесс: О2 + 4е + 2Н2О = 4ОН-
Слайд 17Способы защиты металлов от коррозии.
1. Легирование металлов, т.е. получение сплавов, которые
2. Изоляция металла от окружающей среды достигается применением защитных покрытий. Различают три вида покрытий: (лаки, краски, эмали); химические покрытия (фосфатные, оксидные, нитридные); металлические (никелирование, хромирование, лужение – покрытие оловом). Различают катодные и анодные покрытия. Если защищаемый металл покрыт менее активным металлом, то это – катодное покрытие, например железо покрытое оловом. При нарушении целостности катодного покрытия возникает гальванический элемент, в котором анод – железо разрушается, а катод – олово – остаётся защищённым. Если защищаемый металл покрыт более активным металлом, то это анодное покрытие, например железо покрыто цинком. При нарушении целостности анодного покрытия возникает гальванический элемент, где анод – цинк – разрушается, а катод – железо – остаётся защищённым.
Протекторная защита. К защищаемой металлической конструкции
присоединяют листы (протекторы) из более активного металла. Протектор разрушается, предохраняя защищаемый металл. Данным способом защищают трубопроводы и ёмкости под землёй, корпуса судов и корабельных винтов в морской воде.
4. Изменение свойств агрессивной среды. Достигается двумя способами: 1) удаление из агрессивно сред веществ, которые усиливают коррозию металлов, например кислород кипячением; 2) добавлением в агрессивную среду веществ, которые замедляют коррозию (ингибиторы).
Слайд 18Опыт №4.
Цинковая пластинка опускается в сосуд с ингибированной соляной кислотой.
Слайд 19Закрепление знаний
Контрольные вопросы:
1. Дайте определение коррозии металлов.
2. Какие виды коррозии металлов
3. Что способствует процессу коррозии?
4. Рассмотрите процесс коррозии при контакте железа с более активным металлом . Напишите уравнения реакций окисления и восстановления.
4. Зная, что такое коррозия и что ей способствует, предложите способы борьбы с коррозией железных изделий как наиболее распространённых.
5. Какие способы борьбы с коррозией вам известны?
6. Особый интерес представляет протекторная защита. На чём основано её действие? Каков её недостаток?
7. На чём основана катодная защита?
Слайд 20Итоги урока
Разрушить проще, чем построить. Потерять гораздо легче, чем найти. Бороться
Слайд 21Творческие задания.
1. Для хозяйственных нужд вам необходимо приобрести два железных ведра.
2. Вы – слесарь. На стальную деталь (сталь в основном содержит железо и углерод до 2%) поставили медную заклёпку. Знаете ли вы, что раньше разрушится: деталь или заклёпка? Дайте обоснованный ответ.
3. К стенкам парового котла, корпуса судна приваривают листы более активного металла (цинка, магния). Какой металл будет разрушатся в первую очередь? Дайте обоснованный ответ.
4.Одна железная пластина покрыта магнием, а другая медью. На какой пластинке образуется ржавчина при нарушении целостности покрытия? Дайте обоснованный ответ.
Слайд 22Домашнее задание
Учебник «Химия» для профессий НПО и СПО технического цикла О.Г.
Рабочая тетрадь «Металлы и неметаллы»: кроссворд № 1 стр. 27;