- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Количество вещества. Моль. Молярная масса
Содержание
- 1. Презентация по химии Количество вещества. Моль. Молярная масса
- 2. Количество яиц можно измерять дюжинами. Дюжина –
- 3. Например, 1 моль Н2О содержит 6•1023 молекул
- 4. Атомы разных элементов имеют разную массу.Различие в
- 5. Масса 1 моля вещества называется молярной массой.Молекулы
- 6. Молярная масса М, количество вещества n и
- 7. n(моль) = m(г) / M(г/моль) m(г) =
- 8. Решим задачу Определите массу серной кислоты
- 9. 1.Используя периодическую систему, находим молярную массу(т.е. массу
- 10. Решим задачу Вычислите количество вещества Н2О,
- 11. 1.Используя периодическую систему, находим молярную массу(т.е. массу
- 12. Решим задачу Известно, что в кусочке
- 13. Каждый металл имеет индивидуальную атомную
- 14. Домашнее задание: Задачник Кузнецовой, Левкина; cтр.17,
Слайд 2Количество яиц можно измерять дюжинами. Дюжина – количество, содержащее 12 яиц
Одно
1
Дюжина
Полдюжины
6,02•1023 атомов
Один атом
Дюжина атомов
Одна молекула
Дюжина молекул
Моль молекул
1
12
12
6,02•1023
12
1
6
Моль атомов
Количество частиц микромира (атомов, ионов, молекул) измеряют молями. МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02•1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Слайд 3Например, 1 моль Н2О содержит 6•1023 молекул Н2О; 2
1 моль Fe (железа) содержит 6•1023 атомов Fe. 3 моль Fe (железа) содержит 18•1023 (1,8•1024) атомов Fe.
6,02•1023 – число Авогадро (округлим до 6•1023).
За число Авогадро изначально было принято количество атомов в одном грамме водорода. Точно число Авогадро определено как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается NA.
NA= 6,02•1023 число Авогадро.
N- количество молекул или атомов в порции вещества.
n - количество вещества (количество молей).
N= n•NA n=N/NA
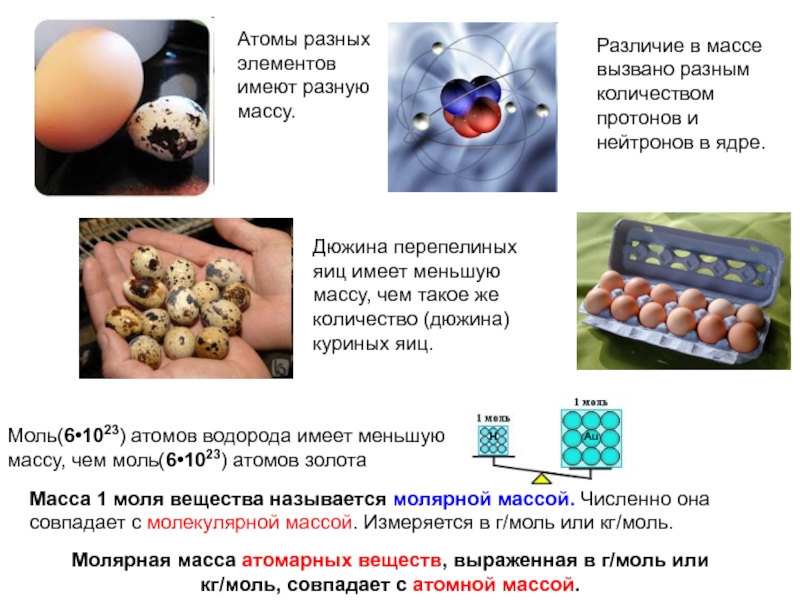
Слайд 4Атомы разных элементов имеют разную массу.
Различие в массе вызвано разным количеством
Дюжина перепелиных яиц имеет меньшую массу, чем такое же количество (дюжина) куриных яиц.
Моль(6•1023) атомов водорода имеет меньшую массу, чем моль(6•1023) атомов золота
Масса 1 моля вещества называется молярной массой. Численно она совпадает с молекулярной массой. Измеряется в г/моль или кг/моль.
Молярная масса атомарных веществ, выраженная в г/моль или кг/моль, совпадает с атомной массой.
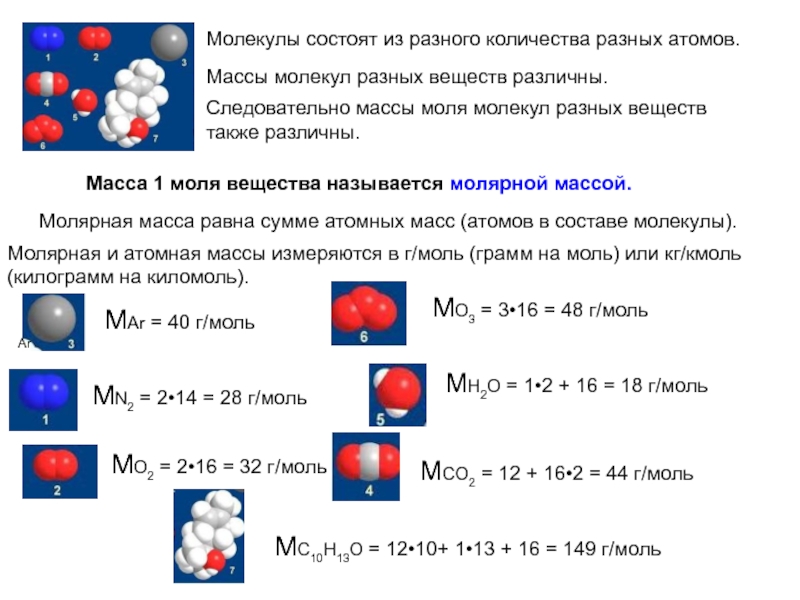
Слайд 5Масса 1 моля вещества называется молярной массой.
Молекулы состоят из разного количества
Массы молекул разных веществ различны.
Следовательно массы моля молекул разных веществ также различны.
Молярная и атомная массы измеряются в г/моль (грамм на моль) или кг/кмоль (килограмм на киломоль).
Молярная масса равна сумме атомных масс (атомов в составе молекулы).
МО2 = 2•16 = 32 г/моль
МС10H13O = 12•10+ 1•13 + 16 = 149 г/моль
МО3 = 3•16 = 48 г/моль
МN2 = 2•14 = 28 г/моль
МAr = 40 г/моль
МH2О = 1•2 + 16 = 18 г/моль
МCО2 = 12 + 16•2 = 44 г/моль
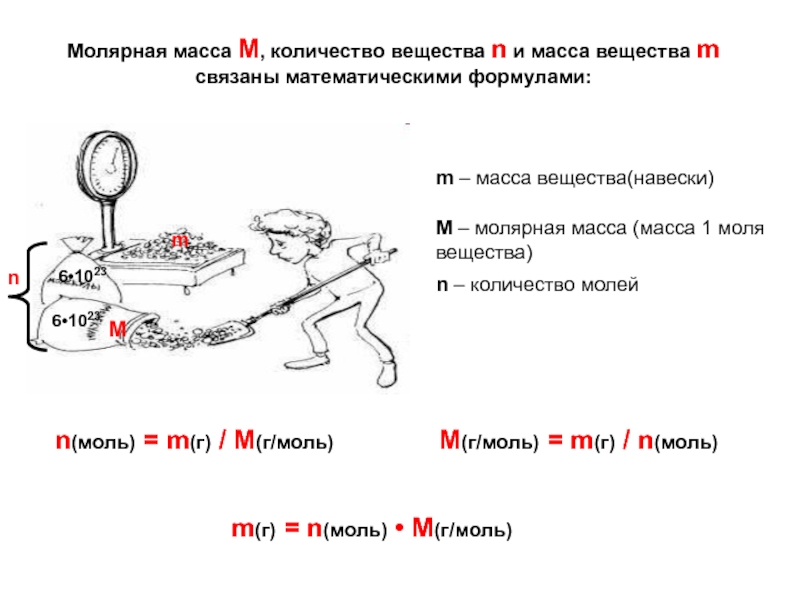
Слайд 6Молярная масса М, количество вещества n и масса вещества m связаны
n(моль) = m(г) / M(г/моль)
m(г) = n(моль) • M(г/моль)
M(г/моль) = m(г) / n(моль)
Слайд 7n(моль) = m(г) / M(г/моль)
m(г) = n(моль) • M(г/моль)
Например,
Например, число молей в 180 г H2O составляет
n = 180г / 18г/моль = 10моль
Молярная масса всегда совпадает с молекулярным весом (или атомным весом - если вещество состоит не из молекул, а из атомов).
Слайд 8Решим задачу
Определите массу серной кислоты количеством вещества 5 моль
Дано: n(H2SO4)=5моль Решение
Найти: m-?, N-? см. следующий слайд
Слайд 91.Используя периодическую систему, находим молярную массу(т.е. массу одного моля) серной кислоты:
М(H2SO4)=1•2+32+16•4=98г/моль
2.Находим массу 5 молей:
m = n•M =5моль • 98г/моль=490г
3.Находим количество молекул в 5 молях, зная, что в 1 моле любого вещества содержится 6,02 •1023 частиц.
N = n • NA=5 • 6,02 •1023 = 30,1 •1023 = =3,01•1024 молекул
Ответ:
m(H2SO4)=490г, N(H2SO4)= 3,01•1024 молекул
Слайд 10Решим задачу
Вычислите количество вещества Н2О, содержащееся в воде массой
Дано: m=0,18г Решение
Найти: n=?, N-? см. следующий слайд
Слайд 111.Используя периодическую систему, находим молярную массу(т.е. массу одного моля) воды:
М(H2O)=1•2+16=18г/моль
2.Находим количество
n = m / M =0,18г/18г/моль=0,01 моль
3.Находим количество молекул в 0,01 молях:
N = n • NA=0,01моль • 6,02 •1023 = 6,02 •1021 молекул
Ответ:
n(H2O)=0,01моль, N(H2O)= 6,02•1021 молекул
Слайд 12Решим задачу
Известно, что в кусочке металла массой 1,08г содержится
Дано: m=1,08г N=2,41•1022 атомов
Найти: Mметалла-?
Решение
см. следующий слайд
Слайд 13 Каждый металл имеет индивидуальную атомную массу. Атомная масса металла
1. Рассчитаем в каком количестве вещества данного металла содержится 2,41•1022 атомов:
n = N / NA =2,41•1022 / 6,02• 1023=0,04 моль
2.Найдем атомную массу металла:
М = m / n =1,08г / 0,04 моль= 27 г/моль
В периодической системе находим: такую атомную массу имеет алюминий.
Ответ: Аl.
Слайд 14Домашнее задание:
Задачник Кузнецовой, Левкина; cтр.17, №1-75(б,в),1-76(а,ж), cтр.18, №1-81.
1-75. Какую массу
1-76. Какое количество вещества содержится: а)в 2,3 г натрия, ж) в 1170 г хлорида натрия NaCl?
1-81. Известно, что 5 моль двухатомных молекул некоторого неметалла имеют массу 140 г. О каком неметалле идет речь?