- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Кислородсодержащие соединения азота. Азотная кислота (9 класс)
Содержание
- 1. Презентация по химии Кислородсодержащие соединения азота. Азотная кислота (9 класс)
- 2. Оксиды азотаБезразличные, несолеобразующие:N2Oоксид азота(I)(«веселящий газ»)Бесцветный газ со
- 3. Кислотные оксидыN2O3(III) Оксид азота(III)
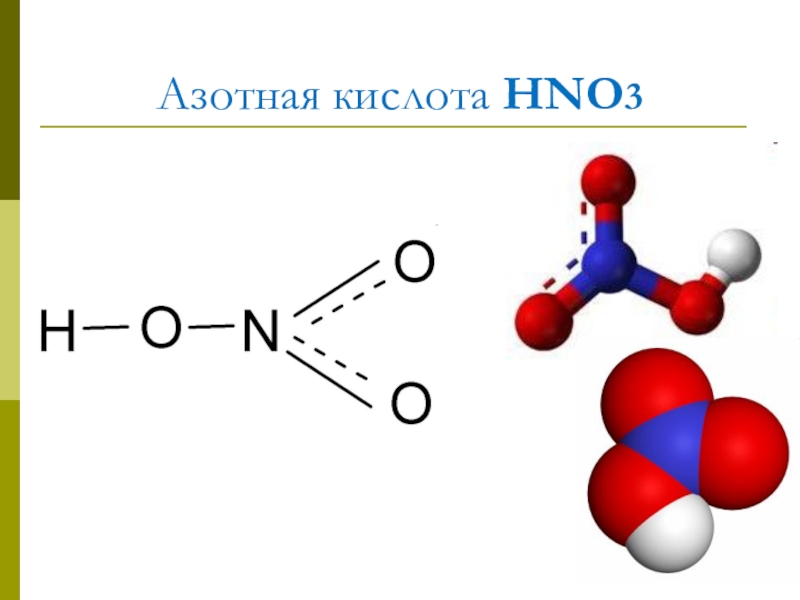
- 4. Азотная кислота HNO3
- 5. Физические свойствабесцветная, дымящая на воздухе жидкость, неограниченно
- 6. Кислотные свойстваСильный электролитВзаимодействует с основными и амфотерными
- 7. Слайд 7
- 8. Азотная кислота окисляет неметаллы, при этом азот
- 9. Смесь трех объёмов соляной кислоты и одного
- 10. Применение азотной кислотыАзотные удобренияПластмассы Искусственные волокнаОрганические красителиЛекарства Взрывчатые вещества
- 11. Соли азотной кислоты – нитраты(селитры)получают действием HNO3
- 12. Д/з§ 27№№ 2, 4, 6, 7
Слайд 2Оксиды азота
Безразличные, несолеобразующие:
N2O
оксид азота(I)
(«веселящий газ»)
Бесцветный газ со слабым запахом, растворим в
Не взаимодействует с водой, растворами кислот и щелочей.
При нагревании разлагается на азот и кислород.
При высоких концентрациях возбуждает нервную систему, применяют как слабое средство для наркоза.
NO
оксид азота(II)
Бесцветный газ, незначительно растворим в воде.
Не взаимодействует с водой, растворами кислот и щелочей.
При обычной температуре соединяется с кислородом с образованием NO2.
Получают каталитическим окислением при производстве азотной кислоты.
Слайд 3Кислотные оксиды
N2O3(III)
Оксид азота(III) — темно-синяя жидкость, неустойчивая
NO2
Оксид азота(IV)— бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
2NO2 + Н2О = HNO3 + HNO2 или: 4NO2 + 2Н2О + О2 = 4HNO3
и растворами щелочей:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2О
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NO2, окисляет SO2 до SO3
Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид азота(V) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2.
Сильный окислитель.
В воде легко растворяется с образованием азотной кислоты HNO3.
Слайд 5Физические свойства
бесцветная, дымящая на воздухе жидкость, неограниченно растворяющаяся в воде;
Водные
При хранении на свету желтеет в результате разложения:
Слайд 6Кислотные свойства
Сильный электролит
Взаимодействует с основными и амфотерными оксидами:
HNO3 +
HNO3 + Al2O3 →
Взаимодействует с основаниями и амфотерными гидроксидами:
HNO3 + NaOH →
HNO3 + Zn(OH)2 →
Взаимодействует с солями (более слабых кислот, если ↓или ↑):
HNO3 + K2CO3 →
Слайд 8
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO
и сложные вещества, например:
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Слайд 9Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской
Слайд 10Применение азотной кислоты
Азотные удобрения
Пластмассы
Искусственные волокна
Органические красители
Лекарства
Взрывчатые вещества
Слайд 11Соли азотной кислоты – нитраты(селитры)
получают действием HNO3 на металлы, оксиды, гидроксиды
хорошо растворимы в воде
при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния: 2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью: 4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути: 2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония: NH4NO3 = N2O + 2H2O
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители, например:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O — при сплавлении твердых веществ.