- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии к уроку по теме Фосфор 9 класс
Содержание
- 1. Презентация по химии к уроку по теме Фосфор 9 класс
- 2. ФОСФОР И ЕГО СВОЙСТВА
- 3. Цель урока. Получить знания о химическом
- 4. Девиз урока«Фосфор-элемент жизни и мысли». Академик А.Е.Ферсман
- 5. «Верите ли вы»? 1) что химический знак
- 6. Открытие фосфора приписывается гамбургскому
- 7. Однако вскоре он понял, что никакими другими
- 8. Слайд 8
- 9. Строение атома фосфора
- 10. Строение атома фосфораЭлемент VA группы имеет электронную
- 11. Нахождение в природеФосфор- весьма распространенный элемент на
- 12. Биологическое значение фосфора Фосфор является
- 13. Содержание фосфора Содержание фосфора в организме человека
- 14. Биологическое значение фосфора Фосфор входит
- 15. Биологическое значение фосфора Фосфор входит
- 16. Фосфор поступает в организм с пищей: рыбой,
- 17. Реакция организмаРеакция организма на недостаток фосфора Развивается
- 18. Многоликий элементАллотропные модификации фосфора: 1. Белый (желтый) 2. Красный 3. Черный Розовый, фиолетовый, алый и другие.
- 19. Наиболее распространённые модификации: красный и белый (жёлтый)Наиболее распространенные модификации фосфора: красный и белый(желтый)
- 20. Белый фосфорФормула белого фосфора- Р4
- 21. Слайд 21
- 22. Красный фосфор Красный фосфор представляет собой
- 23. Черный фосфорЧерный фосфор.Химически малоактивен. По внешнему виду
- 24. Аллотропные модификации фосфора
- 25. Противоядием при отравлении фосфором
- 26. ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
- 27. Химические свойства фосфора В химическом отношении
- 28. Фосфор соединяется со многими простыми веществами –
- 29. Слайд 29
- 30. 2. С галогенами. С элементами, обладающими большей, чем
- 31. 3. С серой при нагревании. 4P + 6S
- 32. 5. Красный фосфор окисляется водой при температуре
- 33. Применение фосфора
- 34. Домашнее задание.П. 21Творческое задание: составить рекламный плакат по теме.
ФОСФОР И ЕГО СВОЙСТВА
Слайд 3Цель урока.
Получить знания о химическом элементе, простом веществе фосфоре
и его аллотропных модификациях, химических свойствах, применении и значении фосфора в природе и жизни человека.
Слайд 5«Верите ли вы»?
1) что химический знак фосфора- Р
2) что фосфор
самый распространённый неметалл в земной коре
3) что фосфор имеет 5 валентных электронов
4) что название «фосфор» переводится как «светоносный»
5) что фосфор – необходимый элемент в питании растений
Слайд 6
Открытие фосфора приписывается гамбургскому алхимику Х. Брандту.
В поисках «филосовского камня», якобы способного превратить неблагородные металлы в золото, Брандт занимался перегонкой сухого остатка от выпаривания мочи. В приёмнике оказалось вещество, испускавшее голубоватый свет. Так, совершенно случайно, в 1669 году был открыт белый фосфор – вещество, вызывавшее свечение. Поначалу у Брандта не было сомнения, что свечение без огня мог дать лишь искомый «филосовский камень»
История открытия фосфора
Слайд 7
Однако вскоре он понял, что никакими другими чудесными свойствами его находка
не обладает, и продал секрет другому алхимику. Тот, в свою очередь, перепродал его третьему и т. д. Конец «филосовскому бизнесу» положил английский химик Р.Бойль , который в 1680 году опубликовал в научном журнале более простую и доступную методику получения фосфора.
В 1771 году шведский химик К.Шееле дал способ получения фосфора из костяной золы, применявшейся в промышленности вплоть до начала 20 века. Наименование элемента происходит от греческих слов «фос» - свет и «форос»,- несущий. Название «фосфоры» приписывают всем веществам, светящимся в темноте после предварительного облучения, а само явление холодного свечения называют фосфоресценция.
В 1771 году шведский химик К.Шееле дал способ получения фосфора из костяной золы, применявшейся в промышленности вплоть до начала 20 века. Наименование элемента происходит от греческих слов «фос» - свет и «форос»,- несущий. Название «фосфоры» приписывают всем веществам, светящимся в темноте после предварительного облучения, а само явление холодного свечения называют фосфоресценция.
Слайд 10Строение атома фосфора
Элемент VA группы имеет электронную формулу 1s22s22p63s23p3.
Фосфор –
неметалл.
Наиболее характерные степени окисления: +5, +3, 0, -3.
Оксиды Р2О5 и Р2О3 имеют кислотные свойства.
Летучее водородное соединение – фосфин PH3.
Наиболее характерные степени окисления: +5, +3, 0, -3.
Оксиды Р2О5 и Р2О3 имеют кислотные свойства.
Летучее водородное соединение – фосфин PH3.
Слайд 11Нахождение в природе
Фосфор- весьма распространенный элемент на земле. Он занимает 13
место по распространенности. Вследствие высокой химической активности фосфор в свободном состоянии в природе не встречается. Он находится не менее чем в 190 минералах, из которых главнейшими являются апатиты и фосфориты.
Наиболее важные минералы фосфора
апатит Са5(РО4)3 фосфорит Са3(РО4)2
На Кольском полуострове имеются самые большие в мире запасы апатитов.
Наиболее важные минералы фосфора
апатит Са5(РО4)3 фосфорит Са3(РО4)2
На Кольском полуострове имеются самые большие в мире запасы апатитов.
Слайд 12Биологическое значение фосфора
Фосфор является постоянной составной частью тканей
организма человека, животных и растений. В организме человека фосфор присутствует в костях, в мышцах, в тканях мозга и нервах. Зубная эмаль- это тоже соединение фосфора.
Входит в состав скелета в виде ортофосфата Са3(Р04)2 и гидроксиапатита ЗСа3(Р04)2 • Са(ОН)2 • Входит в состав зубов в виде гидроксиапатита и фторапатита 3Са3(Р04)2 • CaF2. • Соединения фосфора принимают участие в обмене энергии.
Входит в состав скелета в виде ортофосфата Са3(Р04)2 и гидроксиапатита ЗСа3(Р04)2 • Са(ОН)2 • Входит в состав зубов в виде гидроксиапатита и фторапатита 3Са3(Р04)2 • CaF2. • Соединения фосфора принимают участие в обмене энергии.
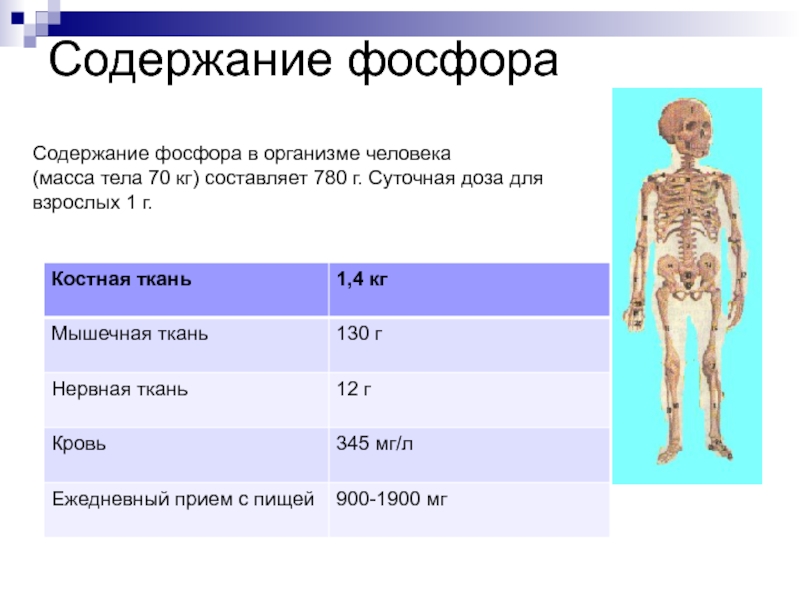
Слайд 13Содержание фосфора
Содержание фосфора в организме человека
(масса тела 70 кг) составляет
780 г. Суточная доза для взрослых 1 г.
Слайд 14Биологическое значение фосфора
Фосфор входит в состав белков, где
он участвует в функционировании клеточных мембран и помогает поддерживать рН среды.
Из фосфора строится
АТФ, которая является
Универсальным источником
энергии для всех реакций,
протекающих в клетке. Наиболее
интенсивно АТФ расходуется
в активно работающих органах
тела: печени, мышцах, мозгу.
• Необходим для нормальной мышечной и умственной деятельности. Академик А.Е.Ферсман назвал его «элементом мысли».
Из фосфора строится
АТФ, которая является
Универсальным источником
энергии для всех реакций,
протекающих в клетке. Наиболее
интенсивно АТФ расходуется
в активно работающих органах
тела: печени, мышцах, мозгу.
• Необходим для нормальной мышечной и умственной деятельности. Академик А.Е.Ферсман назвал его «элементом мысли».
Слайд 15Биологическое значение фосфора
Фосфор входит в состав нуклеиновых кислот-
ДНК и РНК. Нуклеиновые кислоты осуществляют передачу наследственной информации организма.
Слайд 16
Фосфор поступает в организм с пищей: рыбой, хлебом, молоком, сырами, мясом,
бобовыми (горох, фасоль), овсяной, перловой, ячневой крупой.
Обычно всасывается 50—90% фосфора, меньше — при употреблении растительных продуктов, т. к. в них он содержится в виде трудноусвояемой фитиновой кислоты.
Для правильного питания очень важно его соотношение с кальцием.
Оптимальным считается соотношение кальция и фосфора, равное 1:1,5.
Обычно всасывается 50—90% фосфора, меньше — при употреблении растительных продуктов, т. к. в них он содержится в виде трудноусвояемой фитиновой кислоты.
Для правильного питания очень важно его соотношение с кальцием.
Оптимальным считается соотношение кальция и фосфора, равное 1:1,5.
Слайд 17Реакция организма
Реакция организма на недостаток фосфора
Развивается рахит, снижается умственная и мышечная
деятельность.
Реакция организма на избыток фосфора
Развивается мочекаменная болезнь. Р4 и многие соединения фосфора высокотоксичны. Летальная доза Р4 равна 60 мг. Большую опасность представляют ожоги, возникающие при горении фосфора, из-за выделения большого количества тепла при взаимодействии образующегося при горении P2Os с влагой кожи. Получившаяся фосфорная кислота Н3Р04 проникает в глубь соединительной ткани, что приводит к отеку из-за прилива внеклеточной жидкости.
Слайд 18Многоликий элемент
Аллотропные модификации фосфора:
1. Белый (желтый)
2. Красный
3. Черный
Розовый, фиолетовый, алый
и другие.
Слайд 19
Наиболее распространённые модификации: красный и белый (жёлтый)
Наиболее распространенные модификации фосфора: красный
и белый(желтый)
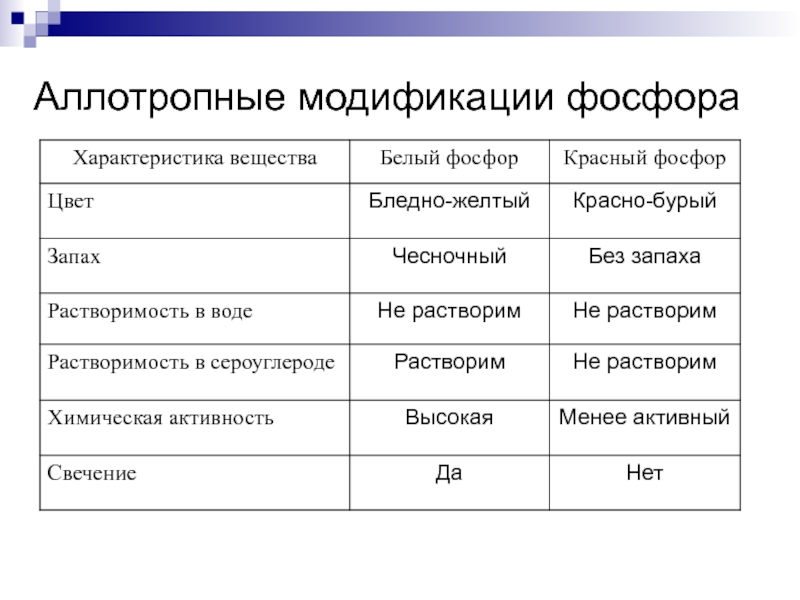
Слайд 20Белый фосфор
Формула белого фосфора- Р4
Белый фосфор – имеет
молекулярную кристалличскую решетку. Его молекула состоит из 4 атомов, располагающихся по вершинам правильной пирамиды, такая молекула имеет вид тетраэдра. Мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом.
Обладает высокой реакционной
способностью, поэтому его обычно
хранят под водой – он не растворяется
в воде но растворяется в сероуглероде
На воздухе самопроизвольно
воспламеняется. Медленное
окисление его паров сопровождается
свечением. Чрезвычайно ядовит. Без
доступа воздуха при 280-300º С
переходит в красный фосфор. это
было открыто в 1947 году.
Обладает высокой реакционной
способностью, поэтому его обычно
хранят под водой – он не растворяется
в воде но растворяется в сероуглероде
На воздухе самопроизвольно
воспламеняется. Медленное
окисление его паров сопровождается
свечением. Чрезвычайно ядовит. Без
доступа воздуха при 280-300º С
переходит в красный фосфор. это
было открыто в 1947 году.
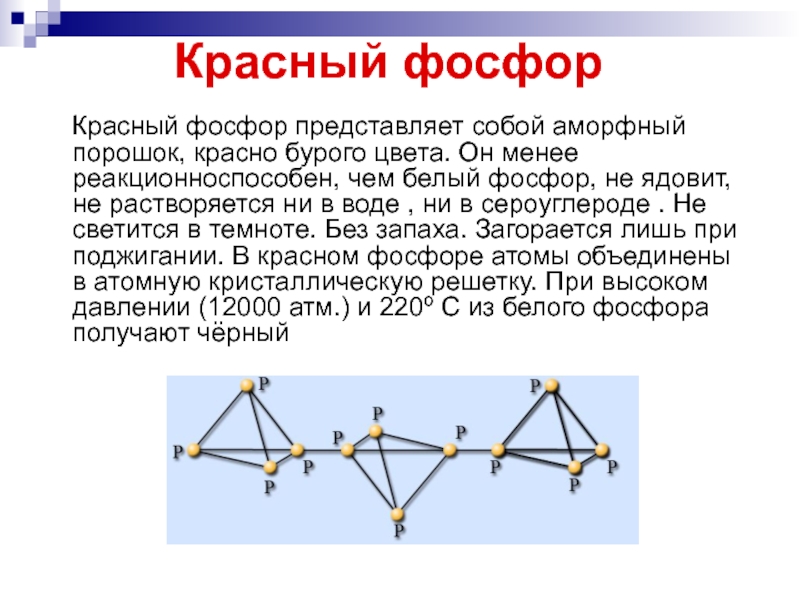
Слайд 22Красный фосфор
Красный фосфор представляет собой аморфный порошок, красно бурого
цвета. Он менее реакционноспособен, чем белый фосфор, не ядовит, не растворяется ни в воде , ни в сероуглероде . Не светится в темноте. Без запаха. Загорается лишь при поджигании. В красном фосфоре атомы объединены в атомную кристаллическую решетку. При высоком давлении (12000 атм.) и 220º С из белого фосфора получают чёрный
Слайд 23Черный фосфор
Черный фосфор.
Химически малоактивен. По внешнему виду и по внутреннему строению
он похож на графит: кристалл построен из бесконечных слоёв атомов, его слои «гофрированы».
При нормальных условиях чёрный фосфор ведёт себя как полупроводник, а при
повышенном давлении проводит ток как металл (белый и красный фосфор –изоляторы ).
При нормальных условиях чёрный фосфор ведёт себя как полупроводник, а при
повышенном давлении проводит ток как металл (белый и красный фосфор –изоляторы ).
Слайд 25 Противоядием при отравлении фосфором
служит 2% раствор медного
купороса,
который следует давать больному через 5
минут по чайной ложке до появления рвоты.
Горящий фосфор не только причиняет
очень сильные ожоги, но и вызывает
отравление тканей, прилежащих к месту ожога,
вследствие чего заживление идет крайне
медленно. При ожогах фосфором
противоядием служит мокрая повязка,
пропитанная 5% раствором медного купороса.
В связи с тем, что белый фосфор легко
окисляется и воспламеняется, его хранят под водой.
который следует давать больному через 5
минут по чайной ложке до появления рвоты.
Горящий фосфор не только причиняет
очень сильные ожоги, но и вызывает
отравление тканей, прилежащих к месту ожога,
вследствие чего заживление идет крайне
медленно. При ожогах фосфором
противоядием служит мокрая повязка,
пропитанная 5% раствором медного купороса.
В связи с тем, что белый фосфор легко
окисляется и воспламеняется, его хранят под водой.
Слайд 27Химические свойства фосфора
В химическом отношении белый фосфор сильно отличается
от красного.
Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой.
Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240ºС.
При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую.
Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой.
Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240ºС.
При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую.
Слайд 28 Фосфор соединяется со многими простыми
веществами – кислородом, галогенами, серой и
некоторыми металлами, проявляя
окислительные и восстановительные свойства.
1. С кислородом.
При горении фосфора образуется белый
густой дым. Белый фосфор самовоспламеняется
на воздухе, а красный горит при поджигании.
Фосфор сгорает в кислороде ослепительно
ярким пламенем.
4P + 3O2(недостат) → 2P2O3 (P4O6)
4P + 5O2(избыток) → 2P2O5 (P4O10)
Р- восстановитель
Слайд 302. С галогенами.
С элементами, обладающими большей, чем у фосфора, электроотрицательностью, фосфор
реагирует очень энергично.
Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получается хлорид фосфора (III).
4P + 6Cl2(недостат) → 4PCl3
4P + 10Cl2(избыток) → 4PCl5
Р- восстановитель
Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получается хлорид фосфора (III).
4P + 6Cl2(недостат) → 4PCl3
4P + 10Cl2(избыток) → 4PCl5
Р- восстановитель
Слайд 31 3. С серой при нагревании.
4P + 6S → 2P2S3
Р- восстановитель
4P + 10S → 2P2S5
4. Фосфор окисляет при нагревании почти все металлы, образуя фосфиды:
2P + 3Ca → Ca3P2 Р- окислитель
5. С водородом, при этом образуется фосфин:
2P + 3H2 → 2PH3 Р- окислитель
4P + 10S → 2P2S5
4. Фосфор окисляет при нагревании почти все металлы, образуя фосфиды:
2P + 3Ca → Ca3P2 Р- окислитель
5. С водородом, при этом образуется фосфин:
2P + 3H2 → 2PH3 Р- окислитель
Слайд 325. Красный фосфор окисляется водой при температуре около 800ºС
в
присутствии катализатора – порошка меди:
2P + 8H2O → 2H3PO4 + 5H2↑
6. Взаимодействие фосфора с бертолетовой солью KClO3.
Данная смесь воспламеняется со взрывом даже при слабом трении или нажими.Эту химическую реакцию мы воспроизводим всякий раз, когда зажигаем спички. KClO3 в смеси с серой, в качестве горючего находится в головке спички, а красный фосфор- на боковой стенке коробка. О которую спичку чиркают.
6P + 5 KClO3 → 3P2O5 + 5KCl
P- восстановитель.
2P + 8H2O → 2H3PO4 + 5H2↑
6. Взаимодействие фосфора с бертолетовой солью KClO3.
Данная смесь воспламеняется со взрывом даже при слабом трении или нажими.Эту химическую реакцию мы воспроизводим всякий раз, когда зажигаем спички. KClO3 в смеси с серой, в качестве горючего находится в головке спички, а красный фосфор- на боковой стенке коробка. О которую спичку чиркают.
6P + 5 KClO3 → 3P2O5 + 5KCl
P- восстановитель.
Слайд 33Применение фосфора
Красный фосфор.
Используют на спичечных фабриках. Он входит в состав
смеси, которую наносят на головку спички и боковые
поверхности спичечного коробка. При трении фосфор
воспламеняется, поджигая состав головки.
Впервые спички стали выпускать в 1833 году , но в
состав спичечной головки входил белый фосфор,это
было не безопасно. В 1867 году в Швеции в головках
спичек белый фосфор заменили на красный и спички
стали называться безопасными или шведскими.
Белый фосфор.
Используют на заводах по производству пироматериалов, в производстве дымовых завес, зажигательных и дымовых снарядов, бомб, на заводах по производству фосфорной кислоты, которая в свою очередь используется на производство фосфорных удобрений.
Используют на спичечных фабриках. Он входит в состав
смеси, которую наносят на головку спички и боковые
поверхности спичечного коробка. При трении фосфор
воспламеняется, поджигая состав головки.
Впервые спички стали выпускать в 1833 году , но в
состав спичечной головки входил белый фосфор,это
было не безопасно. В 1867 году в Швеции в головках
спичек белый фосфор заменили на красный и спички
стали называться безопасными или шведскими.
Белый фосфор.
Используют на заводах по производству пироматериалов, в производстве дымовых завес, зажигательных и дымовых снарядов, бомб, на заводах по производству фосфорной кислоты, которая в свою очередь используется на производство фосфорных удобрений.