- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии к уроку Окислительно восстановительные реакции 8 класс
Содержание
- 1. Презентация по химии к уроку Окислительно восстановительные реакции 8 класс
- 2. Окислительно-восстановительными называют
- 3. Историческая справка В XVII в. считали, что
- 4. Историческая справкаС введением в химию электронных представлений
- 5. Восстановление Под восстановлением понимают
- 6. ВосстановлениеНапример:- атомы неметаллов могут присоединять электроны, превращаясь
- 7. Восстановление- принимать электроны могут и положительные ионы,
- 8. Окисление В некоторых случаях при окислении
- 9. ОкислениеНапример:- атомы металлов, теряя электроны, превращаются в
- 10. Окисление- терять электроны могут и некоторые положительные
- 11. CuCl2 +
- 12. Электронный баланс В окислительно-восстановительных реакциях
- 13. Электронный балансА электронные уравнения будут иметь вид:
- 14. Электронный баланс Для правильного уравнивания
- 15. Электронный балансДана реакция Li + N2 =
- 16. Электронный баланс3. Уравниваем число отданных и принятых
- 17. Электронный баланс4. Просуммируем порознь левые и правые
- 18. Биологическое значение окислительно-восстановительных процессовЖизнь – непрерывная цепьокислительно-восстановительныхпроцессов
- 19. Использованные источникиhttp://www.med.az/2013/02/01/О.С.Габриелян. Химия. 8 класс. М.Дрофа.2013.О.С.Габриелян, И.П.Воскобойникова,
Слайд 1Окислительно-восстановительные
реакции
Учитель химии МОУ Красновосходская СОШ Мельникова Лариса Николаевна
Слайд 2 Окислительно-восстановительными называют химические реакции, в результате
+1 -1 0 +2 -1 0
2HCl + Zn = ZnCl2 + H2
Слайд 3Историческая справка
В XVII в. считали, что окисление – потеря флогистона
Fe + 2HCI = FeCI2 + H2↑
Здесь нет кислорода, но железо окисляется. В этой реакции окислитель – ион водорода протон Н+, а железо является восстановителем.
Слайд 4Историческая справка
С введением в химию электронных представлений точно установлено, что окислитель
Слайд 5Восстановление
Под восстановлением понимают процесс присоединения электронов атомами,
При этом:
- происходит понижение степени окисления какого-либо атома в данной частице;
- частица (атом, ион или молекула) принимает один или несколько электронов;
- органическое вещество теряет атомы кислорода и (или) приобретает атомы водорода.
Слайд 6Восстановление
Например:
- атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные
0 -1
Cl + 1ē → Cl
атом хлора хлорид-ион
- электроны могут присоединяться к положительным ионам, которые при этом превращаются в атомы:
+2 0
Cu + 2ē → Cu
ион меди(II) атом меди
Слайд 7Восстановление
- принимать электроны могут и положительные ионы, у которых при этом
+3 +2
Fe + 1ē → Fe
ион железа (III) ион железа (II)
Слайд 8Окисление
В некоторых случаях при окислении молекула исходного вещества может
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами.
Слайд 9Окисление
Например:
- атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются:
Na - 1ē → Na
атом натрия ион натрия
- отдавать электроны могут отрицательные ионы :
-1 0
Cl - 1ē → Cl
хлорид-ион атом хлора
Слайд 10Окисление
- терять электроны могут и некоторые положительные ионы с низшими степенями
+1 +2
Cu - 1ē → Cu
ион меди(I) ион меди (II)
Слайд 11
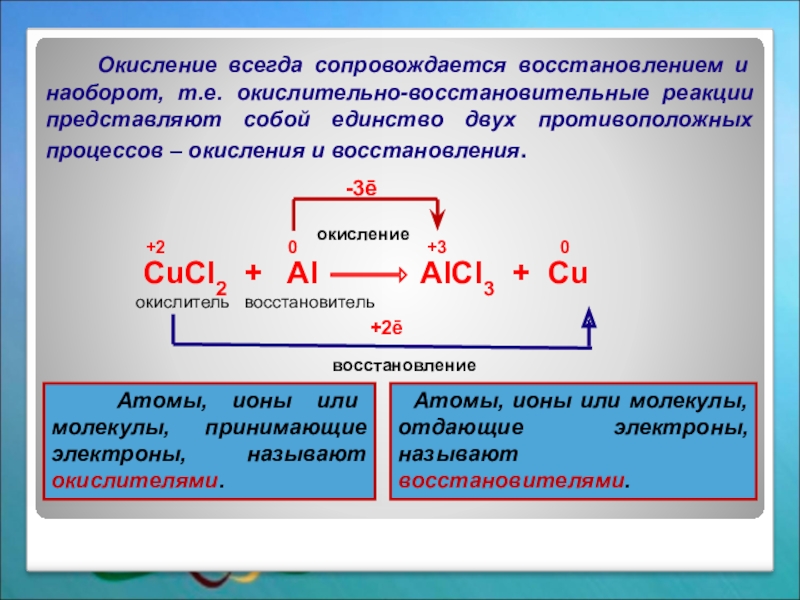
CuCl2 + Al
окислитель восстановитель
+2 0 +3 0
окисление
восстановление
-3ē
+2ē
Окисление всегда сопровождается восстановлением и наоборот, т.е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления.
Атомы, ионы или молекулы, принимающие электроны, называют окислителями.
Атомы, ионы или молекулы, отдающие электроны, называют восстановителями.
Слайд 12Электронный баланс
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем,
электронный баланс.
Например, реакция алюминия с хлоридом меди (II):
+2 -1 0 +3 -1 0
CuCl2 + Al → AlCl3 + Cu
Слайд 13Электронный баланс
А электронные уравнения будут иметь вид:
+2
Cu + 2ē → Cu 3
0 окисление +3
Al - 3ē → Al 2
Молекулярное уравнение:
3CuCl2 + 2Al = 2AlCl2 + 3Cu
Слайд 14Электронный баланс
Для правильного уравнивания следует придерживаться определенной последовательности
1. Найти окислитель и восстановитель.
2. Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу.
3. Уравнять число отданных и принятых электронов в полуреакциях.
4. Просуммировать порознь левые и правые части полуреакций.
5. Расставить коэффициенты в уравнении окислительно-восстановительной реакции.
Например:
Слайд 15Электронный баланс
Дана реакция Li + N2 = Li3N
1. Находим окислитель и
Li0 + N20 = Li3+1N−3
N присоединяет электроны – окислитель.
Li отдает электроны – восстановитель.
2. Составляем полуреакции:
Li0 — 1ē = Li+1
N20 + 6ē = 2N−3
Слайд 16Электронный баланс
3. Уравниваем число отданных и принятых электронов в полуреакции:
6* |
1* | N20 + 6ē = 2N−3
Получаем:
6Li0 — 6ē = 6Li+1
N20 + 6ē = 2N−3
Слайд 17Электронный баланс
4. Просуммируем порознь левые и правые части полуреакций:
6Li + N2 =
5. Расставим коэффициенты в окислительно-восстановительной реакции:
6Li + N2 = 2Li3N
Слайд 18Биологическое значение окислительно-
восстановительных процессов
Жизнь – непрерывная цепь
окислительно-восстановительных
процессов
Слайд 19Использованные источники
http://www.med.az/2013/02/01/
О.С.Габриелян. Химия. 8 класс. М.Дрофа.2013.
О.С.Габриелян, И.П.Воскобойникова, А.В.Яшукова. Настольная книга учителя.
Иллюстрация «обмен веществ» (слайд 18):
Иллюстрация «дыхание» (слайд 18):
http://studiofminus.com/cv/breathing-meditation