- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии к уроку
Содержание
- 1. Презентация по химии к уроку
- 2. Слайд 2
- 3. Слайд 3
- 4. Закон сохранения массы вещества
- 5. В течение тысячелетий люди верили в то,
- 6. Бойль проделал множество опытов по прокаливанию металлов
- 7. Слайд 7
- 8. Вот что записал учёный после одного из
- 9. Русский учёный М.В. Ломоносов предположил, что чувственный
- 10. «Все перемены в натуре случающиеся такого суть
- 11. Лишь в 1756 году Ломоносову удалось проверить
- 12. Слайд 12
- 13. «Оными опытами нашлось, что славного Роберта Бойля
- 14. Спустя 41 год после опытов Ломоносова французский
- 15. Как с точки зрения атомно-молекулярного учения объяснить
- 16. Значение закона сохранения массы веществОткрытие закона сохранения
- 17. 3. На основе закона сохранения массы веществ составляют уравнения химических реакций.
- 18. АЛГОРИТМ1. В левой части уравнения запиши формулы
- 19. 2. В правой части уравнения запиши формулы веществ образующихся в результате реакции.(ПРОДУКТЫ РЕАКЦИИ)
- 20. 3.Подсчитать количество атомов каждого элемента в правой
- 21. 5.Разделить НОК на индексы – получить коэффициенты.ПОСТАВИТЬ
- 22. ВОЗЬМИ НА ЗАМЕТКУ:Начинать уравнивать лучше с атомов
- 23. Повторение - мать учения! Решите
- 24. а) Fe + S = FeS,Исходные вещества
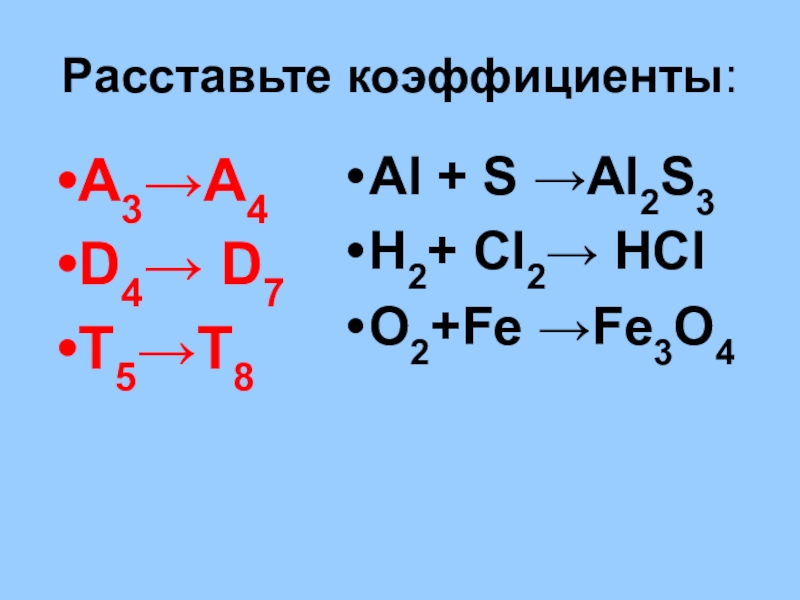
- 25. Расставьте коэффициенты:А3→А4D4→ D7T5→T8 Al + S →Al2S3H2+ Cl2→ HClO2+Fe →Fe3O4
- 26. Рефлексия: Я познакомился с ...
Закон сохранения массы вещества
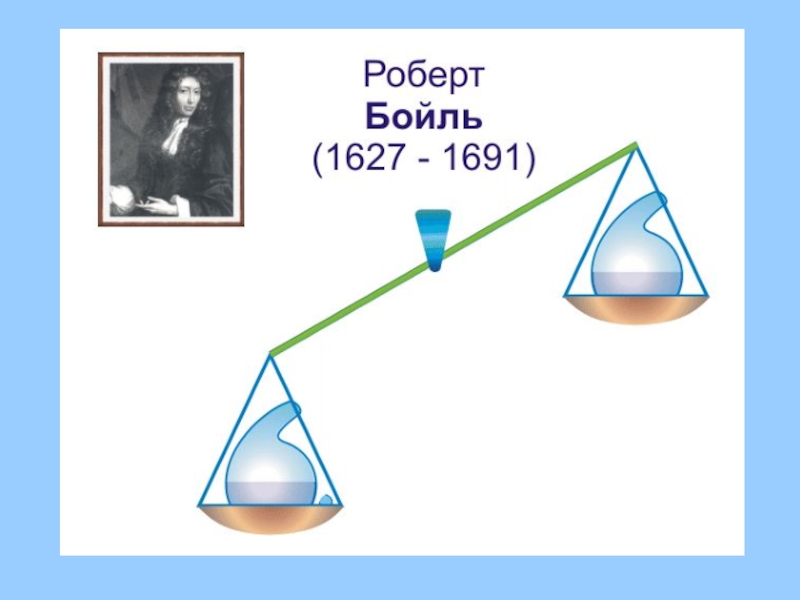
Слайд 5В течение тысячелетий люди верили в то, что вещество может бесследно
исчезать, а также возникать из ничего. Это чисто житейское утверждение подтвердил и такой известный учёный, как Роберт Бойль
Слайд 6Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и
всякий раз масса окалины оказывалась больше массы прокаливаемого металла.
Слайд 8Вот что записал учёный после одного из своих опытов в 1673
году.
«После двух часов нагревания был открыт запаянный кончик реторты, причём в неё ворвался с шумом наружный воздух.
По нашему наблюдению при этой операции была прибыль в весе на 8 гранов…»
«После двух часов нагревания был открыт запаянный кончик реторты, причём в неё ворвался с шумом наружный воздух.
По нашему наблюдению при этой операции была прибыль в весе на 8 гранов…»
Слайд 9Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5
июля 1748 года он написал в письме Леонарду Эйлеру
Слайд 10
«Все перемены в натуре случающиеся такого суть состояния, что сколько чего
у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет...»
Слайд 11Лишь в 1756 году Ломоносову удалось проверить опытным путём теоретически открытый
закон сохранения массы вещества при химических реакциях. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.
Слайд 13
«Оными опытами нашлось, что славного Роберта Бойля мнение ложно, ибо без
пропущения внешнего воздуха вес сожжённого металла остаётся в одной мере...»
Слайд 14Спустя 41 год после опытов Ломоносова французский учёный Антуан Лоран Лавуазье
практически повторил формулировку закона в своём учебнике.
Слайд 15Как с точки зрения атомно-молекулярного учения объяснить закон сохранения массы?
в результате
химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Так как число атомов до реакции и после остается неизменным, то их общая масса также не изменяется.
Так как число атомов до реакции и после остается неизменным, то их общая масса также не изменяется.
Слайд 16Значение закона сохранения массы веществ
Открытие закона сохранения массы веществ способствовало дальнейшему
развитию химии как науки.
На оснований закона сохранения массы веществ производят практические важные расчеты.
На оснований закона сохранения массы веществ производят практические важные расчеты.
Слайд 18АЛГОРИТМ
1. В левой части уравнения запиши формулы веществ, которые вступают в
реакцию. (Формулы простых газообразных веществ состоят из двух атомов:
Н2, О2, N2, Cl2 и.т.д.)
(ИСХОДНЫЕ ВЕЩЕСТВА)
Н2, О2, N2, Cl2 и.т.д.)
(ИСХОДНЫЕ ВЕЩЕСТВА)
Слайд 19
2. В правой части уравнения запиши формулы веществ образующихся в результате
реакции.
(ПРОДУКТЫ РЕАКЦИИ)
(ПРОДУКТЫ РЕАКЦИИ)
Слайд 20
3.Подсчитать количество атомов каждого элемента в правой и левой части.
4. Определить,
у какого элемента количество атомов меняется,
найти НОК.
найти НОК.
Слайд 21
5.Разделить НОК на индексы – получить коэффициенты.
ПОСТАВИТЬ КОЭФФИЦИЕНТЫ ПЕРЕД ФОРМУЛАМИ.
6. Пересчитать
количество атомов, при необходимости действия повторить.
Слайд 22ВОЗЬМИ НА ЗАМЕТКУ:
Начинать уравнивать лучше с атомов КИСЛОРОДА или любого другого
неметалла ( если только О не находится в составе нескольких веществ).
Слайд 23Повторение - мать учения!
Решите задачу: В реакцию вступило
4 г водорода и 2 г кислорода, сколько грамм воды получиться?
Запишите формулы исходных веществ и продуктов реакции для следующих уравнений химических реакций:
Запишите формулы исходных веществ и продуктов реакции для следующих уравнений химических реакций:
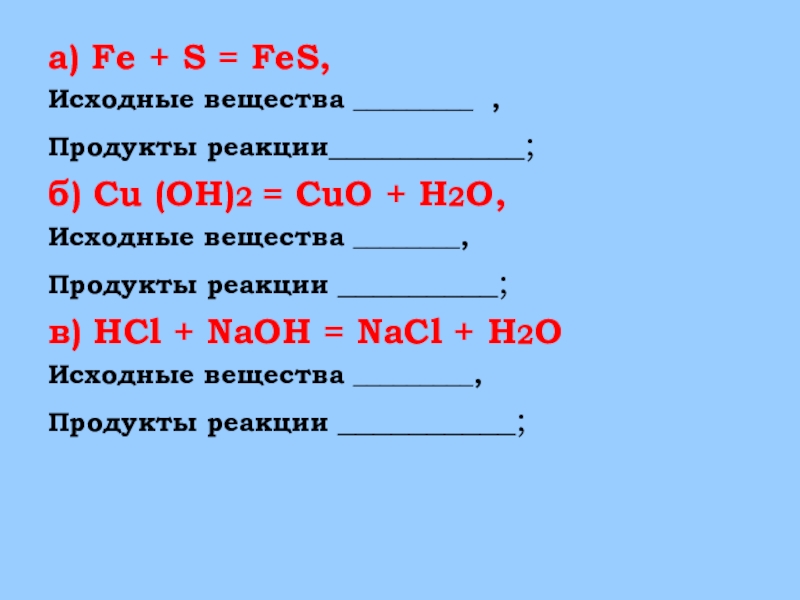
Слайд 24а) Fe + S = FeS,
Исходные вещества _________ ,
Продукты реакции___________;
б) Cu
(OH)2 = CuO + H2O,
Исходные вещества ________,
Продукты реакции _________;
в) HCl + NaOH = NaCl + H2O
Исходные вещества _________,
Продукты реакции __________;
Исходные вещества ________,
Продукты реакции _________;
в) HCl + NaOH = NaCl + H2O
Исходные вещества _________,
Продукты реакции __________;
Слайд 26Рефлексия:
Я познакомился с ...
Было непросто ...
Я
добился ...
У меня получилось ...
Хотелось бы ...
Мне запомнилось ...
Я попробую ...