- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии к проекту Решение 21 задания
Содержание
- 1. Презентация по химии к проекту Решение 21 задания
- 2. Задачи:1.Решить несколько задач по химии на растворы
- 3. План работы:1)Для создания своего проекта ,я работала
- 4. План работы:1.Сбор материалов и данных2.Проведение исследовательской работы 3.Подготовка теоретического доклада
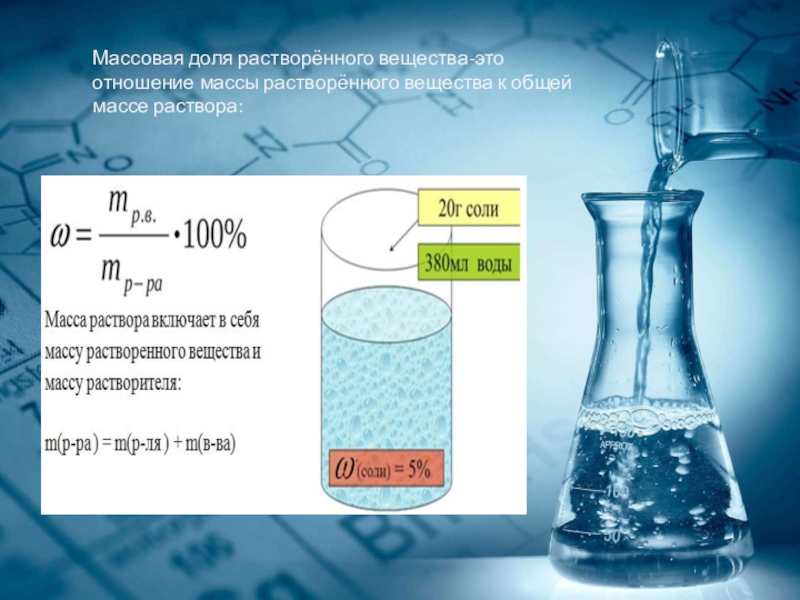
- 5. Массовая доля растворённого вещества-это отношение массы растворённого вещества к общей массе раствора:
- 6. Раствор состоит из растворённого вещества и растворителя
- 7. Задача: Поваренную соль массой 5 гр растворили
- 8. Задача1 В сосуд, содержащий 7 литров 14-процентного водного
- 9. 2способ Решим задачу методом «стаканчиков» Ответ: 7
- 10. Задача 1. Даны два куска с
- 11. 2способ Решим задачу методом «стаканчиков»
- 12. Затем из курса 8 класса я повторила
- 13. Задача.В реакцию с соляной кислотой вступило 13г
- 14. Решение задачи с участием растворов веществ.1.Если в
- 15. Вывод:Повторив материал по теме «Растворы.Массовая доля растворённого
- 16. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 1Проект на тему : Решение №21 ОГЭ по химии
Выполнила : ученица
МОУ «СОШ с.Демьяс»
Башаева Анастасия
Руководитель : Тюлебергинова В.А
Слайд 2Задачи:
1.Решить несколько задач по химии на растворы и нахождение массы продукта
2.Выявить сущность заданий.
3.Создать ключ решения и буклет с алгоритмом выполнения заданий.
Слайд 3План работы:
1)Для создания своего проекта ,я работала с заданиями ОГЭ ,со
« Алгоритмы решения задач»
2)Определила многообразие типовых задач , повторяемых в ходе ОГЭ по данной теме.
3)Решение задач на растворы и нахождение массы продукта реакции по известной массе исходного вещества
4)Выявление сущности выполнения данных задач.
5)Определение алгоритма и ключа решения задания №21 ОГЭ по химии.
6)Создание проектного продукта-буклета
Слайд 4План работы:
1.Сбор материалов и данных
2.Проведение исследовательской работы
3.Подготовка теоретического доклада
Слайд 5Массовая доля растворённого вещества-это отношение массы растворённого вещества к общей массе
Слайд 6Раствор состоит из растворённого вещества и растворителя ,поэтому массу раствора определяют
m (раствора) = m( вещества) +m(растворителя)
Массу раствора можно выразить и через объем раствора и его плотность :
m(раствора)=V*p
Где V-объем раствора ;p(плотность раствора)
Тогда:
W(вещества)=m(в-ва)/v*p
Слайд 7Задача: Поваренную соль массой 5 гр растворили в 45 г воды.
Дано:
m(NaCl)=5г
m (H2O)=45г
Найти:
W (NaCl)-?
Решение :
1.Определим общую массу полученного вещества :
m (раствора)= m (NaCl) +m(H2O)=5г+45г=50г.
2.Вычислим массовую долю соли в растворе:
W(NaCl)=m(NaCl)\m(р-ра)*100%
W(NaCl)=5г*100%\50г=10%
Ответ :w(NaCl)=10%
Слайд 8Задача1 В сосуд, содержащий 7 литров 14-процентного водного раствора некоторого вещества, добавили
Решение 1способ
Пусть в сосуде изначально было х л некоторого вещества.
Составляем пропорцию:7л-100%, х л-14%,то х=7*14/100
Откуда х=0,98л.
После того, как в сосуд долили 7 литров воды, воды стало 14 л, а некоторого вещества по-прежнему 0,98л.
Составим очередную пропорцию:14л-100%, 0,98л-?,то 0,98*100/14=7%
Откуда процент некоторого вещества в сосуде есть
7%.
Ответ: 7.
Слайд 10Задача 1. Даны два куска с различным содержанием олова. Первый, массой
Решение.
300 •20 : 100 = 60 (г) - олова в первом сплаве, 200 • 40 : 100 = 80 (г) - олова во втором сплаве ;
60 + 80 = 140 (г) - олова в двух сплавах вместе;
200 + 300 = 500 (г) – масса куска после сплавления;
140 : 500 • 100 = 28% -содержится олова после сплавления.
Слайд 12Затем из курса 8 класса я повторила алгоритм решения задач на
1.Сначала записываем числовые данные из условия задачи –массу вещества ,или объем газа .Затем выясняем ,что нужно определить в той задаче ,и записываем вопрос под условием задачи.
2.Определяем кол-во веществ,массы или объемы которых даны в условии задачи.
3.Записываем уравнение реакции,о которой сказано в условии задачи и расставляем в нём коэффициенты.
4.Вычисленное кол-во вещества записываем над формулой этого вещества в уравнении реакции.
5 Учитывая коэффициенты ,определяем количества тех веществ,массы или объемы которых нужно определить в задаче.
6.По найденным кол-вам веществ рассчитываем массы или объемы этих веществ .
7.Проверяем,на все ли поставленные вопросы условия задачи найдены ответы.
8.Записываем ответы задачи.
Слайд 13Задача.
В реакцию с соляной кислотой вступило 13г цинка .Определите массы израсходованной
Решение
1.Находим кол-во вещества цинка ,разделив его массу на молярную массу:
V(Zn)=m :М=13г:65г\моль=0,2 моль
2.Вносим эту величину в уравнение реакции и с её помощью определяем кол-ва всех указанных в задаче веществ (с учётом коэффициентов)
0,2моль 0,4 моль 0,2 моль 0,2 моль
Zn+Cl=ZnCl2+H2
Далее расчеты по формулам:
m(HCl)=M*V=36,5г\моль*0,4 моль =14,6г
m(ZnCl2)=M*V=136г\моль *0,2 моль=27,2г
Объем водорода находим аналогично:
V(H2)=Vm*v=22,4 л\моль*0,2 моль=4,48л
Слайд 14Решение задачи с участием растворов веществ.
1.Если в условии задачи указаны объём
2.По массе раствора находится масса растворённого вещества (масса раствора умножается на массовую долю растворённого вещества и переводится в проценты).
3.По найденной массе растворённого вещества определяется его количество (масса растворённого вещества делится на его молярную массу)
4.Записывается уравнение реакции ,о которой сказано в условии задачи ,и в нем расставляются все коэффициенты.
5.Найденное в п.3 количество вещества записывается над формулой этого вещества в уравнении реакции.
6.Учитывая коэффициенты ,определяется количество вещества ,массу или объем которого нужно найти.
7.По найденному количеству вещества определяются его масса или объем.