- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии к обобщающему уроку по теме Неметаллы
Содержание
- 1. Презентация по химии к обобщающему уроку по теме Неметаллы
- 2. Химический элементарийОкислительно-восстановительные реакции
- 3. Модель атома какого химического элемента изображена на рисунке?
- 4. Каким образом атомы, модели которых изображены на
- 5. В каком ряду химических элементов усиливаются окислительные
- 6. Расположите химические элементы в порядке усиления неметаллических
- 7. Формула вещества:1) Н2SO42) N2O53) CaCO34 ) NaOH5)
- 8. Слайд 8
- 9. Помоги лаборанту оформить этикетки.KHSO4?HСl?Na2CO3?
- 10. Помоги лаборанту оформить этикетки.?хлорид железа (III)?нитрат алюминия?дигидрофосфат натрия
- 11. В чем преимущество использования водорода в качестве топлива для автомобилей?Ответ подтвердите уравнением реакции.
- 12. Не реагируют друг с другом1) хлор и
- 13. Какие ионы реагируют при сливании растворов
- 14. Запишите уравнения реакций, лежащих в основе технологического процесса получения серной кислоты.FeS2––> SO2 ––> SO3 ––> H2SO4
- 15. Na2S, CaSO4SН2SO3Рассчитайте степени окисления серы в химических соединениях
- 16. По схемам электронных переходов определите, какие свойства
- 17. УРАВНЕНИЯ РЕАКЦИЙ:А) НNO3+ NaOH = NaNO3 +H2OБ)
- 18. Для изготовления первых спичек использовали белый фосфор.
- 19. Какое количество вещества серной кислоты необходимо для
- 20. Какой объем углекислого газа (н.у.)выделится при сгорании2 моль углерода?
- 21. Вычислите объем кислорода, необходимого для полногосжигания 6,72 л сероводорода (н.у.) .
- 22. 170 г
Слайд 4Каким образом атомы,
модели которых изображены на рисунках, будут завершать энергетический
Какие свойства при этом проявлять?
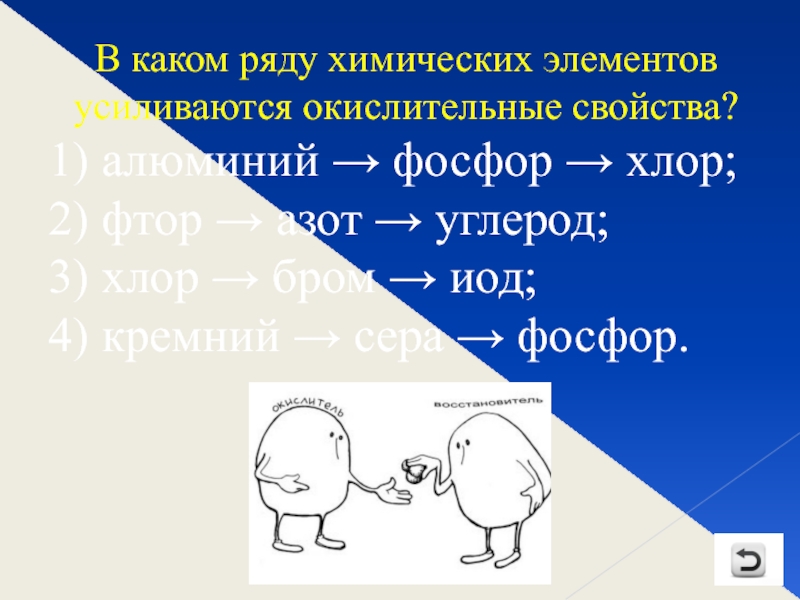
Слайд 5В каком ряду химических элементов усиливаются окислительные свойства?
1) алюминий → фосфор
2) фтор → азот → углерод;
3) хлор → бром → иод;
4) кремний → сера → фосфор.
Слайд 6Расположите химические элементы
в порядке усиления
неметаллических свойств
соответствующих им простых веществ.
Кислород
Фосфор
Слайд 7Формула вещества:
1) Н2SO4
2) N2O5
3) CaCO3
4 ) NaOH
5) K2HPO4
Класс неорганических соединений:
А) кислотный
Б) средняя соль;
В) кислота;
Г) основание;
Д) кислая соль.
Установите соответствие между формулой вещества и классом неорганических соединений, к которому оно относится:
Слайд 8
какие из свойств принадлежат азоту,
а какие – аммиаку.
1. Не имеет запаха.
2. Имеет запах.
3. В молекуле ковалентная неполярная связь.
4. В молекуле ковалентная полярная связь.
5. Степень окисления азота 0.
6. Степень окисления азота -3.
7. Мало растворим в воде.
8. Хорошо растворяется в воде.
9. Взаимодействует с кислотами с образованием солей.
10. Взаимодействует с кислородом во время грозы.
Слайд 10Помоги лаборанту оформить этикетки.
?
хлорид железа (III)
?
нитрат алюминия
?
дигидрофосфат натрия
Слайд 11 В чем преимущество
использования водорода
в качестве топлива для
Ответ подтвердите уравнением реакции.
Слайд 12Не реагируют друг с другом
1) хлор и водород
2) кислород и кальций
3)
4) железо и сера
Составьте уравнения реакций,
протекание которых возможно.
Слайд 13 Какие ионы реагируют
при сливании растворов CaCl2 и K2CO3?
А)
Б) Са2+ и Cl-
В) K+и Cl-
Г) ионы не реагируют
Составьте молекулярное, полное и сокращенное ионные уравнения.
Слайд 14
Запишите уравнения реакций, лежащих в основе технологического процесса получения серной кислоты.
FeS2––>
Слайд 16По схемам электронных переходов определите,
какие свойства проявляет атом серы.
S+6
S0 → S+4
S+4→ S-2
S-2 → S+6
Восстановитель (отдает электроны)
Окислитель (принимает электроны)
Слайд 17УРАВНЕНИЯ РЕАКЦИЙ:
А) НNO3+ NaOH = NaNO3 +H2O
Б) 3СuO + 2NH3 =
В) 4NH3 + 5O2 = 4NО + 6H2O
Г ) 6Li + N2 = 2Li3N
СВОЙСТВА:
1) является окислителем
2) является восстановителем
3) является и окислителем,
и восстановителем
4) не проявляет окислительно-
восстановительных свойств
Установите соответствие между уравнением реакции и свойством элемента азота,
которое он проявляет в этой реакции.
Слайд 18Для изготовления первых спичек использовали белый фосфор. Такие спички самовоспламенялись на
P + KClO3 → KCl +P2O5
Расставьте коэффициенты в уравнении методом электронного баланса.
Слайд 19Какое количество вещества
серной кислоты необходимо
для полной нейтрализации
10 моль
H2SO4 + 2NaOH = Na2SO4 + 2H2O