- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Химическое равновесие
Содержание
- 1. Презентация по химии Химическое равновесие
- 2. Слайд 2
- 3. Тема занятия: Обратимые и необратимые реакции. Химическое равновесие и условие его смещения
- 4. Цель: выясним, что такое обратимость химических реакций;
- 5. ВспомнимЧто такое химическая реакция?Что происходит с молекулами
- 6. Химическая реакцияЭто активное столкновение молекул, при котором
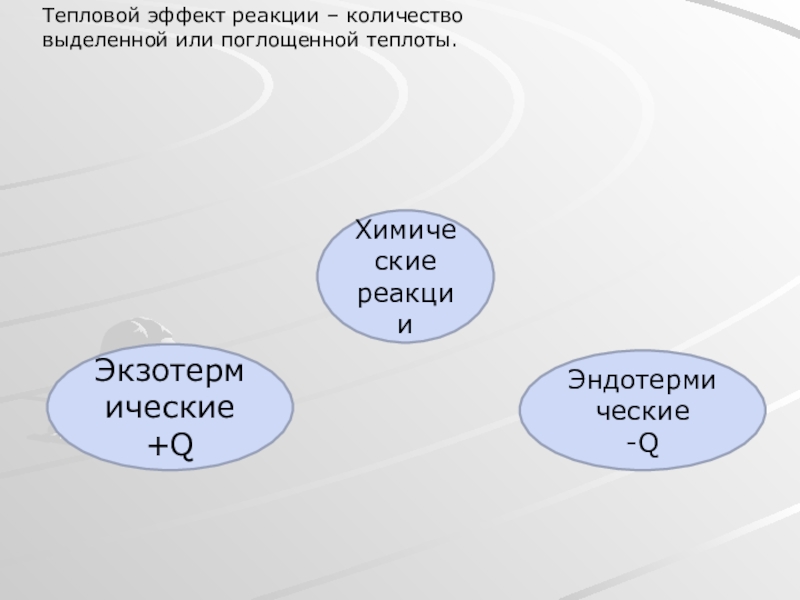
- 7. Тепловой эффект реакции – количество выделенной или поглощенной теплоты.Химические реакцииЭкзотермические +QЭндотермические-Q
- 8. Факторы, влияющие на скорость реакцииПрирода реагирующих веществПлощадь поверхности твердого веществаКонцентрация реагирующих веществТемператураКатализатор
- 9. Природа реагирующих веществ Под природой реагирующих веществ
- 10. Поверхность соприкосновения реагирующих веществ В две пробирки
- 11. Концентрация реагирующих веществВ две пробирки прилили 2-3
- 12. Теория активации Выводы: 1. Повышение
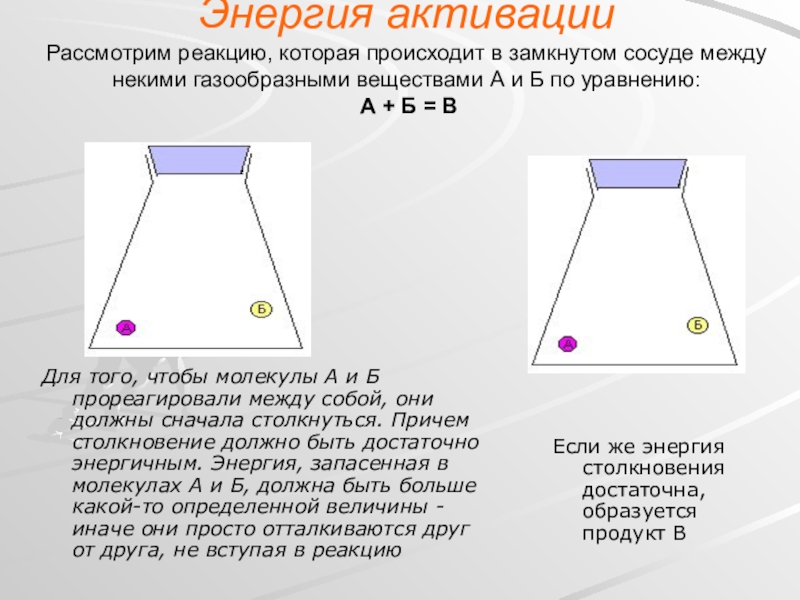
- 13. Энергия активации Рассмотрим реакцию, которая происходит
- 14. КатализаторКатализаторами называются вещества, которые влияют на
- 15. Слайд 15
- 16. Примеры химических реакцийНеобратимые х.р. Na2SO4 +BaCl2 ?
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Химическое равновесиеОбратимая химическая реакцияH2 + I2 ↔
- 22. Переход системы из одного состояния равновесия в
- 23. Слайд 23
- 24. 1. Концентрация N2 + 3 H2
- 25. 2. Температураэндотермическая реакция ( - ( -
- 26. 3. ДавлениеДавление применяется только для газов!P -
- 27. При увеличения давления равновесие смещается в
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Закрепим понятиеПри увеличении давления химическое равновесие а)
- 34. Обобщение и выводы по занятиюХимические реакции протекают
- 35. Домашнее задание:1. Подготовится к тестированию по теме: «Химическая кинетика».2. Выполнить С.Р. Диктант
Слайд 4Цель:
выясним, что такое обратимость химических реакций;
что такое химическое равновесие;
В ходе урока познакомимся с теорией вопроса по вышеназванной теме.
На практике подтвердим некоторые наши теоретические предположения.
Слайд 5Вспомним
Что такое химическая реакция?
Что происходит с молекулами при протекании химических реакций?
Какими
Какие реакции называются необратимыми и обратимыми?
Слайд 6Химическая реакция
Это активное столкновение молекул, при котором происходит разрыв «старых»
связей и
Скорость химической реакции - это число элементарных актов
в единицу времени в единице объёма
Слайд 7Тепловой эффект реакции – количество выделенной или поглощенной теплоты.
Химические
реакции
Экзотермические +Q
Эндотермические
-Q
Слайд 8Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Площадь поверхности твердого вещества
Концентрация реагирующих
Температура
Катализатор
Слайд 9Природа реагирующих веществ
Под природой реагирующих веществ понимают их состав, строение,
В две пробирки поместили по грануле цинка. В одну прилили соляную кислоту, а во вторую уксусную.
Дайте объяснение: Что наблюдали в результате реакции? Почему реакции имеют разные скорости?
Слайд 10Поверхность соприкосновения реагирующих веществ
В две пробирки прилейте уксусную кислоту. В
Дайте пояснения: Что наблюдали в результате реакции? Почему реакции имеют разные скорости?
.
Слайд 11Концентрация реагирующих веществ
В две пробирки прилили 2-3 мл соляной кислоты. В
Дайте пояснения: Что наблюдали в результате реакции? Почему реакции имеют разные скорости?
Слайд 12Теория активации
Выводы:
1. Повышение температуры усиливает скорость движения молекул,
2. Реакция протекает только тогда когда сталкивающиеся молекулы имеют избыток энергии ( по сравнению с величиной энергии всех молекул при данной температуре) Такие молекулы называются активными.
3. Один из способов активации молекул - повышение температуры, благодаря чему резко увеличивается скорость реакции.
Энергия, которую надо сообщить молекулам, чтобы превратить их в активные, называется энергией активации( Еа).
Слайд 13Энергия активации Рассмотрим реакцию, которая происходит в замкнутом сосуде между некими
Для того, чтобы молекулы А и Б прореагировали между собой, они должны сначала столкнуться. Причем столкновение должно быть достаточно энергичным. Энергия, запасенная в молекулах А и Б, должна быть больше какой-то определенной величины - иначе они просто отталкиваются друг от друга, не вступая в реакцию
Если же энергия столкновения достаточна, образуется продукт В
Слайд 14 Катализатор
Катализаторами называются вещества, которые влияют на скорость реакции, но сохраняют
Изменение скорости реакции под действием катализатора называется катализом.
Катализаторы снижают энергию активации, что приводит к возрастанию активных молекул, скорость реакции увеличивается.
Слайд 15 Обсудим следующие вопросы:
Что такое
Чем эти реакции отличаются?
Что такое химическое равновесие?
Когда оно наступает в химических реакциях?
Кокой процесс называется смещением химического равновесия?
Какие факторы влияют на химическое равновесие?
Слайд 16Примеры химических реакций
Необратимые х.р.
Na2SO4 +BaCl2 ? BaSO4 ↓+ 2NaCl
CuSO4 +2NaOH
Na3PO4+AgNO3 ?Ag3PO4↓+3NaNO3
Mg +H2SO4 ? MgSO4 + H2↑
Na2 CO3+HCl ?2NaCl+CO2 ↑+H2O
Обратимые х.р.
H2 + I2 ↔ 2HI
N2 + 3H2 ↔ 2NH3
CaCO3+ CO2+ H2O ↔ Ca(HCO3)2
– карстовый процесс - образование сталактитов
в пещерах
Слайд 21Химическое равновесие
Обратимая химическая реакция
H2 + I2 ↔ 2HI
Когда [H2]∙[I2] = [HI]²
Состояние обратимого процесса, при котором скорости прямой и обратной реакций равны, называют химическим равновесием.
Слайд 22Переход системы из одного состояния равновесия в другое называется смещением химического
Правило смещения химического равновесия
(принцип Ле-Шателье 1884 год)
Если на систему находящуюся в равновесие произвести внешнее воздействие, то равновесие сместится в ту сторону, где это воздействие ослабевает.
Факторы, влияющие на смещение
равновесия:
1. Концентрация – С
2. Температура – t
3. Давление – p ( для газов)
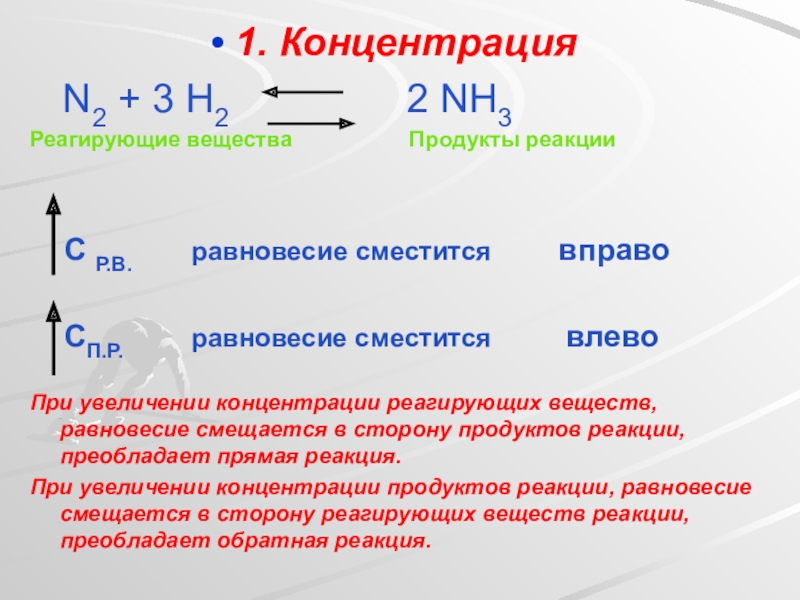
Слайд 241. Концентрация
N2 + 3 H2
Реагирующие вещества Продукты реакции
С Р.В. равновесие сместится вправо
СП.Р. равновесие сместится влево
При увеличении концентрации реагирующих веществ, равновесие смещается в сторону продуктов реакции, преобладает прямая реакция.
При увеличении концентрации продуктов реакции, равновесие смещается в сторону реагирующих веществ реакции, преобладает обратная реакция.
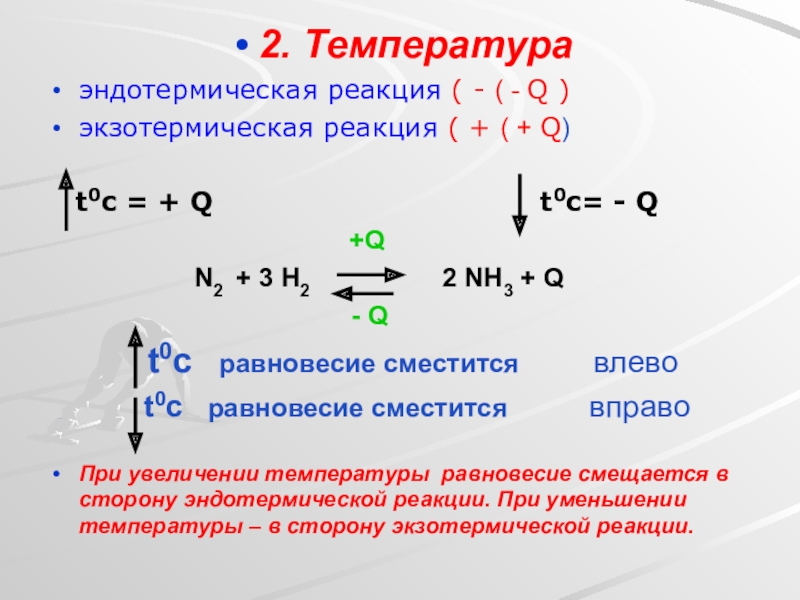
Слайд 252. Температура
эндотермическая реакция ( - ( - Q )
экзотермическая реакция (
t0c = + Q t0c= - Q
+Q
N2 + 3 H2 2 NH3 + Q
- Q
t0c равновесие сместится влево
t0c равновесие сместится вправо
При увеличении температуры равновесие смещается в сторону эндотермической реакции. При уменьшении температуры – в сторону экзотермической реакции.
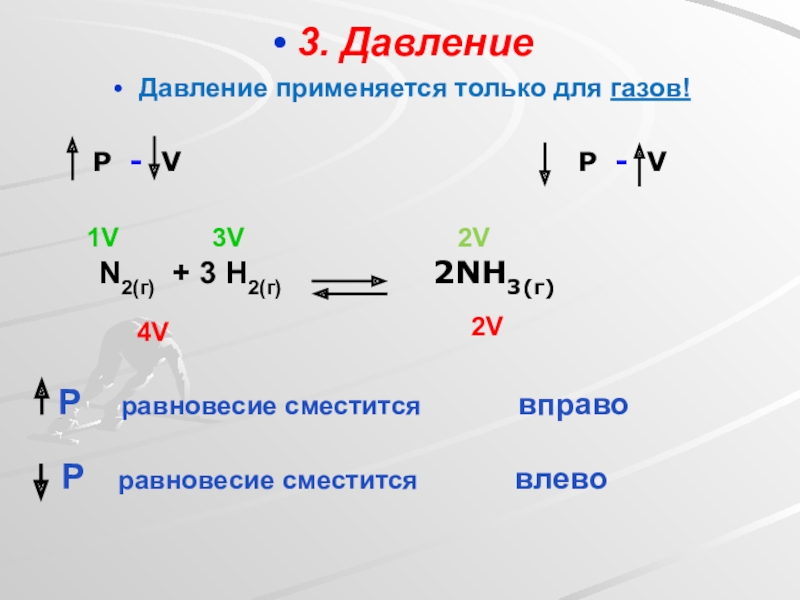
Слайд 263. Давление
Давление применяется только для газов!
P - V
P - V
4V
2V
N2(г)
2NH3(г)
1V
3V
2V
Р равновесие сместится вправо
Р равновесие сместится влево
Слайд 27
При увеличения давления равновесие смещается в сторону той реакции, при
При уменьшении давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов увеличивается.
Если объемы газообразных продуктов одинаковы как в прямой, так и в обратной реакции - изменение давления не оказывает смещения равновесия.
Слайд 33Закрепим понятие
При увеличении давления химическое равновесие а) не смещается в системе
а) 2H₂S(г) + 3O₂ (г) = 2H₂O(г) + 2SO₂ (г)
б) 2H₂ (г) + O₂ (г) = 2H₂O (г)
в) H₂ (г) + I₂ (г) = 2HI (г)
Верны ли следующие суждения о смещении химического равновесия в системе:
2CO(г) + O₂ (г) ↔ 2CO₂ (г) + Q ?
а) при понижении температуры химическое равновесие в данной системе сместится в сторону продукта реакции.
б) при увеличении концентрации углекислого газа химическое равновесие системы сместится в сторону продукта реакции.
Слайд 34Обобщение и выводы по занятию
Химические реакции протекают с различными скоростями. Скорость
Чтобы началась химическая реакция нужно активировать молекулы. Энергия, которую надо сообщить молекулам, для их активизации, называется энергией активации.
Скорость химической реакции зависит от температуры, концентрации, поверхности соприкосновения реагирующих веществ, природы реагирующих веществ, катализатора.
В обратимых химических реакциях наступает динамическое химическое равновесие, когда скорости прямой и обратной реакции равны.
Факторы влияющие на смещение химического равновесия – давление, температура, концентрация.
Смещение химического равновесия происходит согласно принципа Ле-Шателье.

















![Презентация по химии Химическое равновесие Химическое равновесиеОбратимая химическая реакцияH2 + I2 ↔ 2HIКогда [H2]∙[I2] = [HI]² Химическое равновесиеОбратимая химическая реакцияH2 + I2 ↔ 2HIКогда [H2]∙[I2] = [HI]² или Vпр.= Vобр. Наступает химическое равновесиеСостояние](/img/thumbs/f3ae8ee53f80ae70318a22f4c3a7de24-800x.jpg)