- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Химические свойства предельных одноатомных спиртов (10 класс)
Содержание
- 1. Презентация по химии Химические свойства предельных одноатомных спиртов (10 класс)
- 2. Свойства органических веществ определяются их составом и
- 3. химические свойствапредельныходноатомныхспиртовкислотные свойствареакциизамещениядегидратацияокислениевзаимодействие с щелочными и щелочноземельными
- 4. 1. Амфотерные свойства спиртов=а) образование алкоголятов
- 5. щелочная средаЭтанолят (этилат) натрия гидролизуется:Спирт – настолько
- 6. б) взаимодействие с галогеноводородными кислотами:
- 7. 1) Для проведения реакции в колбу добавляют
- 8. 2. Дегидратация спиртов (отщепление воды)а) внутримолекулярная
- 9. б) межмолекулярная дегидратация(получение простых эфиров):
- 10. 3. Образование сложных эфиров (взаимодействие с
- 11. 4. Реакция дегидрирования (отщепление водорода) - а)
- 12. б) вторичные спирты превращаются в кетоны:в) третичные
- 13. 5. Окисление спиртов а) в жёстких условиях
- 14. б) в мягких условиях (под действием раствора
- 15. в) каталитическое окисление этанола(в присутствии оксида хрома
- 16. г) окислительное дегидрирование спиртов:Это качественная реакция на
- 17. Тест на алкогольное опьянениеРеакцию окисления спиртов сильными
- 18. Качественная реакция на этанолЧувствительной реакцией на этиловый
- 19. Домашнеезадание:§ 17,стр.143-148
Слайд 1ХИМИЧЕСКИЕ СВОЙСТВА ПРЕДЕЛЬНЫХ ОДНОАТОМНЫХ СПИРТОВ
Химические
свойства спиртов
Попов Владимир Викторович,
учитель химии
МБОУ «Котельская СОШ» Кингисеппский район
Слайд 2Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы
R-OH
Слайд 3химические свойства
предельных
одноатомных
спиртов
кислотные
свойства
реакции
замещения
дегидратация
окисление
взаимодействие с щелочными и щелочноземельными металлами
/образование алкоголятов/
взаимодействие с галогеноводородами
этерификация
/взаимодействие
внутримолекулярная
/образование алкенов/
межмолекулярная
/образование простых эфиров/
горение
окислительное
дегидрирование
Слайд 41. Амфотерные свойства спиртов
=
а) образование алкоголятов (замещение атома водорода щелочным
этанол
(этиловый спирт)
этанолят
(этилат) натрия
Продукты замещения атома водорода гидроксильной группы на атом металла называются алкоголятами. В данной реакции это этилат натрия. Обнаружить его можно, если выпарить небольшое количество раствора, взятого из пробирки, где происходила реакция. При этом на стеклянной пластинке останутся кристаллики этилата натрия.
! проявляет слабые “кислотные” свойства
Слайд 5щелочная среда
Этанолят (этилат) натрия гидролизуется:
Спирт – настолько слабая кислота, что не
Слайд 6б) взаимодействие с галогеноводородными кислотами:
этанол
(этиловый
хлорэтан
(этилхлорид)
Для этанола, как и других предельных одноатомных спиртов, характерна реакция с галогеноводородами в присутствии кислот. В этой реакции в молекуле спирта замещается на атом галогена гидроксильная группа:
! проявляет слабые “оснóвные” свойства
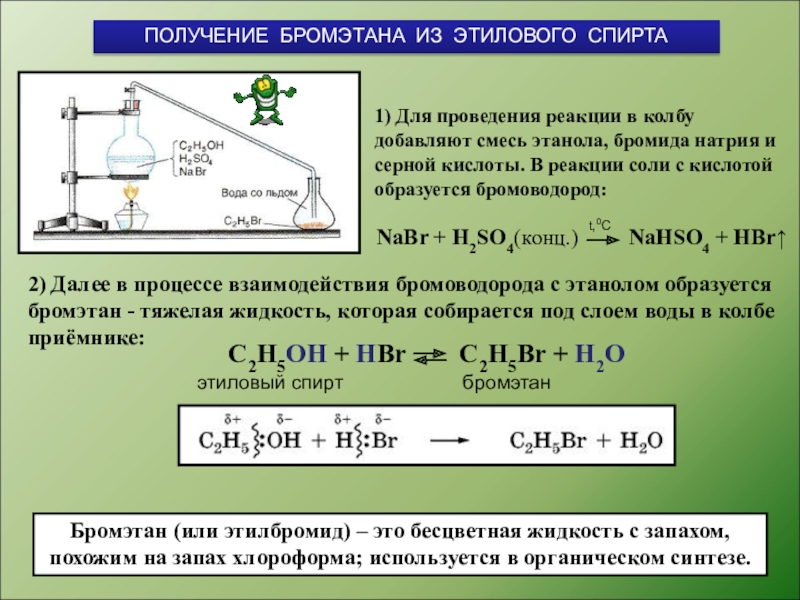
Слайд 71) Для проведения реакции в колбу добавляют смесь этанола, бромида натрия
2) Далее в процессе взаимодействия бромоводорода с этанолом образуется бромэтан - тяжелая жидкость, которая собирается под слоем воды в колбе приёмнике:
ПОЛУЧЕНИЕ БРОМЭТАНА ИЗ ЭТИЛОВОГО СПИРТА
NaBr + Н2SO4(конц.) NaHSO4 + HBr↑
t,0С
С2H5OH + НBr С2H5Br + H2O
бромэтан
этиловый спирт
Бромэтан (или этилбромид) – это бесцветная жидкость с запахом, похожим на запах хлороформа; используется в органическом синтезе.
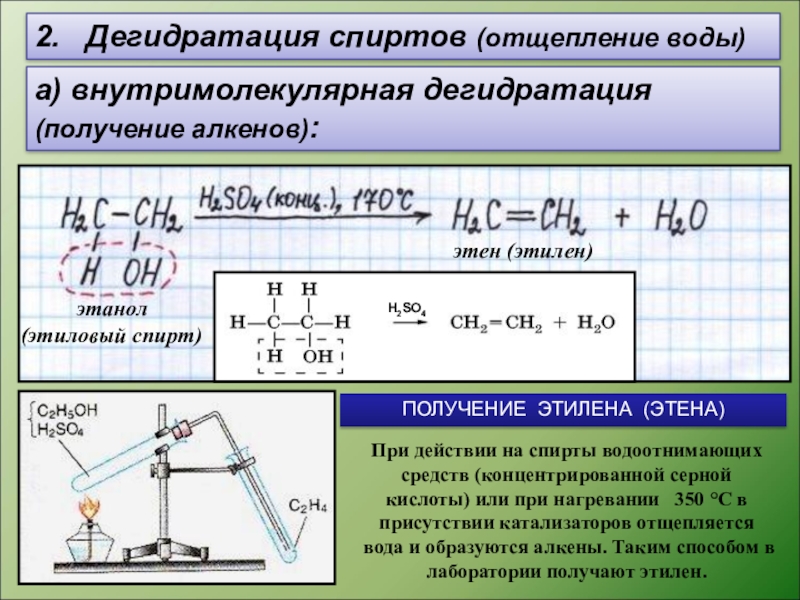
Слайд 82. Дегидратация спиртов (отщепление воды)
а) внутримолекулярная дегидратация
(получение алкенов):
этен (этилен)
(этиловый спирт)
H2SO4
ПОЛУЧЕНИЕ ЭТИЛЕНА (ЭТЕНА)
При действии на спирты водоотнимающих средств (концентрированной серной кислоты) или при нагревании 350 °С в присутствии катализаторов отщепляется вода и образуются алкены. Таким способом в лаборатории получают этилен.
Слайд 9б) межмолекулярная дегидратация
(получение простых эфиров):
этанол
(этиловый спирт)
диэтиловый
Это реакция отщепления атома водорода и гидроксогруппы от двух разных молекул спирта при умеренном нагревании в присутствии водоотнимающих агентов. Продукт реакции – простой эфир:
разные молекулы спирта
простой эфир
Слайд 103. Образование сложных эфиров
(взаимодействие с карбоновыми кислотами) –
реакция
этанол
(этиловый спирт)
этановая
(уксусная)
кислота
этиловый эфир
уксусной кислоты
(этилацетат, или
уксусноэтиловый эфир)
Химиками абсолютно точно доказано, что при образовании сложного эфира от молекулы спирта отщепляется атом водорода, а от кислоты – гидроксогруппа.
Слайд 114. Реакция дегидрирования (отщепление водорода) -
а) первичные спирты превращаются в
этанол
(этиловый спирт)
ацетальдегид
(уксусный альдегид)
Дегидрирование спиртов служит промышленным способом получения альдегидов и кетонов. В качестве катализаторов применяют металличес-кую медь или смесь оксидов меди и хрома. Процесс ведут при высоких температурах (300—350 °С).
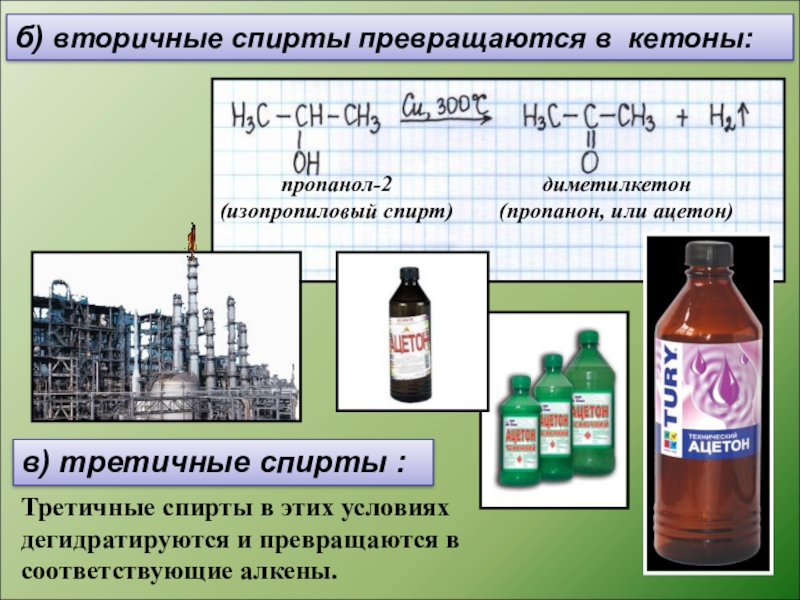
Слайд 12б) вторичные спирты превращаются в кетоны:
в) третичные спирты :
Третичные спирты в
пропанол-2
(изопропиловый спирт)
диметилкетон
(пропанон, или ацетон)
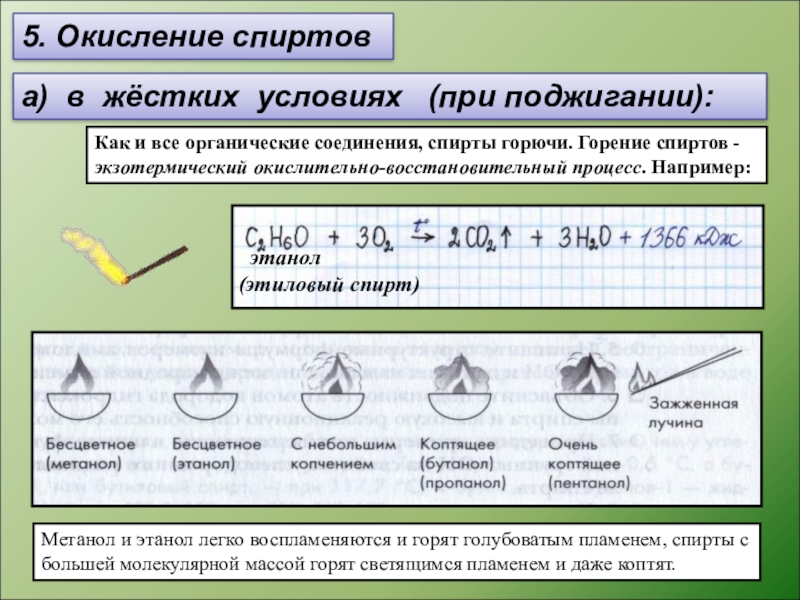
Слайд 135. Окисление спиртов
а) в жёстких условиях (при поджигании):
Как и
Метанол и этанол легко воспламеняются и горят голубоватым пламенем, спирты с большей молекулярной массой горят светящимся пламенем и даже коптят.
этанол
(этиловый спирт)
Слайд 14б) в мягких условиях (под действием раствора KMnO4 ):
3С2Н5ОН + 2KMnO4 → CH3─CH=O + 2MnO2↓ + 2 KOH + 2 H2O
3CH3─CH=O + 2KMnO4 → CH3─COOH + 2CH3─COOК + 2MnO2↓ + 2 H2O
этанол
этаналь
этаналь
уксусная
кислота
ацетат калия
Слайд 15в) каталитическое окисление этанола
(в присутствии оксида хрома (III) Cr2O3 ):
Окисление этилового
2СН3-СН2-ОН + О2 → 2CH3 –CH=O + 2H2O
этанол
(этиловый спирт)
этаналь
(уксусный альдегид)
Cr2O3
Слайд 16г) окислительное дегидрирование спиртов:
Это качественная реакция на спирты: цвет осадка изменяется
Слайд 17Тест на алкогольное опьянение
Реакцию окисления спиртов сильными окислителями используют для установления
K2Cr2O7 + 3 C2H5OH + 4 H2SO4 = 3 CH3COH + Cr2(SO4)3 + K2SO4 + 7H2O
Приготовим трубку для определения алкоголя. Для этого разотрем в ступке хромовый ангидрид (оксид хрома (VI)) с небольшим количеством серной кислоты. Получается паста красного цвета. Нанесем пастой полосу на стенках трубки. Трубку соединим с прибором, подающим смесь воздуха с парами этилового спирта. Через некоторое время красная полоса в трубке зеленеет. Спирт окисляется в уксусный альдегид, а окислитель оксид хрома превращается в сульфат хрома (III), имеющий зеленую окраску.
Слайд 18Качественная реакция на этанол
Чувствительной реакцией на этиловый спирт является так называемая
С2Н5ОН + 6 NaОН + 4 I2 = CHI3 +HCOONa + 5 NaI + H2O