- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Химические и физические свойства алканов (10 класс)
Содержание
- 1. Презентация по химии Химические и физические свойства алканов (10 класс)
- 2. Алканы — химически наименее активные органические соединения.
- 3. Алканам присущи реакциизамещения.
- 4. В реакции присоединения они не вступают, по той причине,что им не куда присоединять радикалы.
- 5. При комнатной температуре алканы не вступают в реакции даже с активными веществами.Бром (Br2)CalveroПерманганат калия (KMnO4)FischX
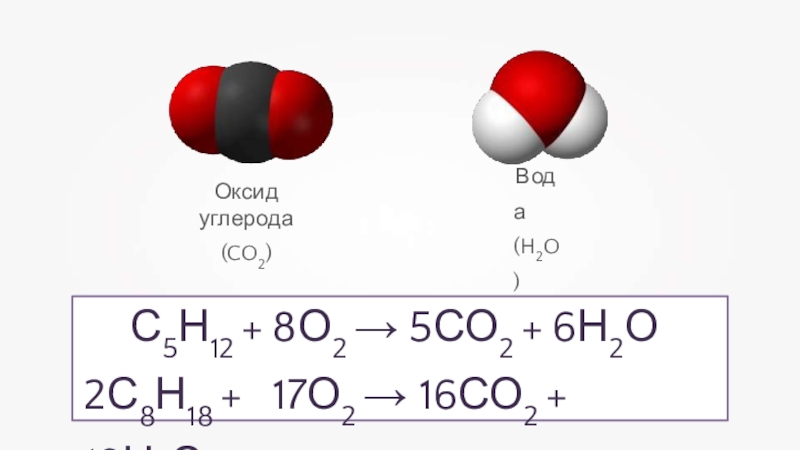
- 6. Оксид углерода(CO2)Вода (H2O)С5Н12 + 8О2 → 5СО2 + 6Н2О 2С8Н18 + 17О2 → 16СО2 + 18Н2О
- 7. Гексан (C6H14)Пентан (C5H12)Углеводороды, которые входят в состав бензина
- 8. Когда недостаточно кислорода,может происходить неполное сгорание, в результате чего образуется угарный газ.
- 9. При неполном сгоранииметана образуется сажа.
- 10. Катализаторы — это вещества, которые ускоряют химическийпроцесс, но при этом не испытываютпревращений в ходе реакции.
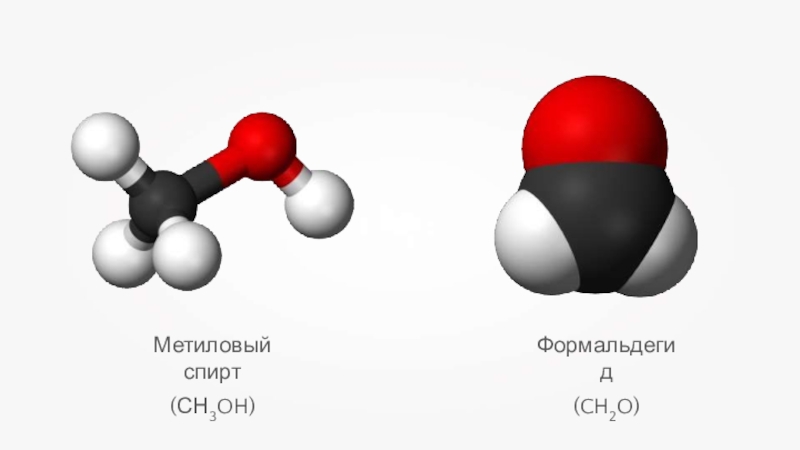
- 11. Метиловый спирт(СН3OH)Формальдегид(CH2O)
- 12. СН4 → С + 2H2 (1000°) 2СН4 → C2H2 + 3Н2 (1500°)
- 13. АцетиленC2H2
- 14. Смесь углеводородас воздухом при воспламенениинебезопасна.5%опасный уровеньбытового газа в воздухе
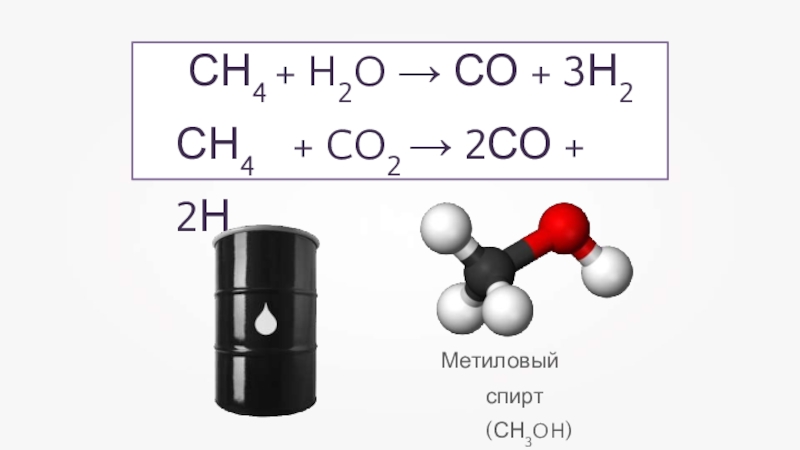
- 15. Метиловый спирт (СН3OH)СН4 + H2O → СО + 3Н2 СН4 + CO2 → 2СО + 2Н2
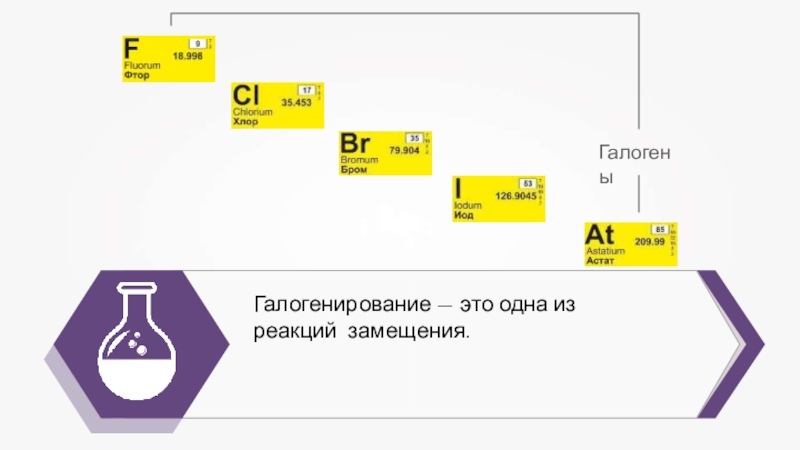
- 16. Галогенирование — это одна из реакций замещения.Галогены
- 17. ИнициированиецепиОбрыв цепиПродолжениецепиСтадии реакции замещения
- 18. Инициирование цепи — зарождениецепи, образование свободных радикалов
- 19. Продолжение цепи (развитие цепи) — это цепь
- 20. Обрыв цепи — объединение активныхрадикалов в неактивные
- 21. Реакции хлорирования метанаСН4 + Cl2 → CH3Cl
- 22. При хлорировании алканов, начиная с пропана, 1-й же атом хлора может заместить разные атомы водорода.Хлорметан (CH3Cl)
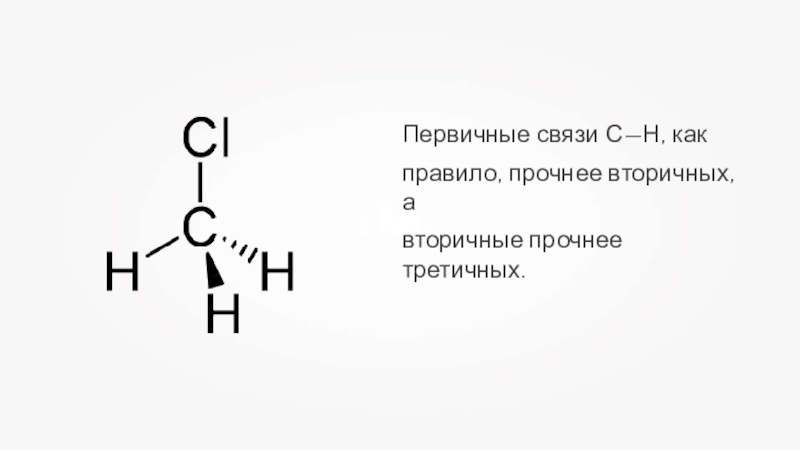
- 23. Первичные связи С—Н, какправило, прочнее вторичных, авторичные прочнее третичных.
- 24. Н.Н. Семёнов 1896–1986 гг.В разработке этих цепных
- 25. СН3—СН2—СН3 + Br2 → CH2Br—CH2—CH3 + HBrСН3—СН2—СН3 + Br2 → CH3—CHBr—CH3 + HBr
- 26. RН + I2 → RI + HI (эндотермическая) RI + HI → RН + I2 (экзотермическая)
- 27. При йодировании алканов образуются и непредельные соединения.72%этилена10%ацетилена
- 28. Реакция фторирования алканов идётс очень высокой, часто взрывной скоростью с образованием всех возможных полифторпроизводных исходного алкана.
- 29. М.И. Коновалов 1858–1906 гг.Нитрование алканов (реакция Коновалова)
- 30. Реакцию проводят в растворепри температуре выше 150°С
- 31. К химическим свойствам алканов следует отнести также ихтермическое разложение.
- 32. Крекинг — процессы термического разложения, протекающие при
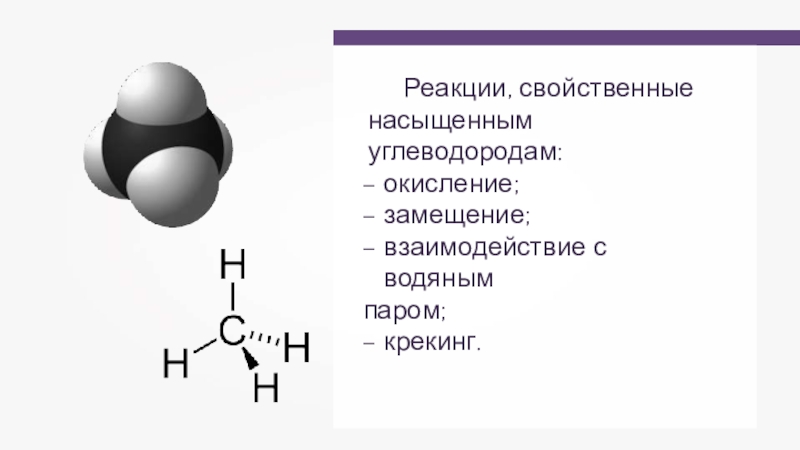
- 33. Реакции, свойственные насыщенным углеводородам:окисление;замещение;взаимодействие с водянымпаром;крекинг.
- 34. Физические свойства предельных углеводородовС1–С4С5–С15С16 и далее
- 35. Бензол (C₆H₆)Все алканы легче воды, в ней
Алканы — химически наименее активные органические соединения.
Слайд 1Алканы — это предельные
углеводороды, в молекулах которых все атомы связаны одинарными
связями.
Слайд 4В реакции присоединения они не вступают, по той причине,
что им не куда
присоединять радикалы.
Слайд 5При комнатной температуре алканы не вступают в реакции даже с активными
веществами.
Бром (Br2)
Calvero
Перманганат калия (KMnO4)
FischX
Слайд 8Когда недостаточно кислорода,
может происходить неполное сгорание, в результате чего образуется угарный
газ.
Слайд 10Катализаторы — это вещества, которые ускоряют химический
процесс, но при этом не
испытывают
превращений в ходе реакции.
превращений в ходе реакции.
Слайд 14Смесь углеводорода
с воздухом при воспламенении
небезопасна.
5%
опасный уровень
бытового газа в воздухе
Слайд 18Инициирование цепи — зарождение
цепи, образование свободных радикалов под воздействием каких-либо условий.
Сl꞉Сl
→ Сl∙ + Сl∙
CH4 + Сl∙ → CH3∙ + HСl
CH4 + Сl∙ → CH3∙ + HСl
Слайд 19Продолжение цепи (развитие цепи) — это цепь последовательных взаимодействий свободных радикалов
и неактивных молекул,
в результате которых образуются новые радикалы и новые молекулы.
в результате которых образуются новые радикалы и новые молекулы.
Сl꞉Сl → Сl∙ + Сl∙
CH4 + Сl∙ → CH3∙ + HСl
CH3∙ + Сl2 → CH3Cl + Сl∙
Слайд 20Обрыв цепи — объединение активных
радикалов в неактивные молекулы.
Сl꞉Сl → Сl∙ +
Сl∙
CH4 + Сl∙ → CH3∙ + HСl
CH3∙ + Сl2 → CH3Cl + Сl∙ CH3∙ + Сl∙ → CH3Cl
Сl∙ + Сl∙ → Cl2
CH3∙ + CH3∙ → CH3—CH3
CH4 + Сl∙ → CH3∙ + HСl
CH3∙ + Сl2 → CH3Cl + Сl∙ CH3∙ + Сl∙ → CH3Cl
Сl∙ + Сl∙ → Cl2
CH3∙ + CH3∙ → CH3—CH3
Слайд 21Реакции хлорирования метана
СН4 + Cl2 → CH3Cl + НCl
Метилхлорид
СН3Cl + Cl2
→ CH2Cl2 + НCl
Метиленхлорид
СН2Cl2 + Cl2 → CHCl3 + НCl
Трихлорметан
СНCl3 + Cl2 → CCl4 + НCl
Тетрахлорид
Слайд 22При хлорировании алканов, начиная с пропана, 1-й же атом хлора может
заместить разные атомы водорода.
Хлорметан (CH3Cl)
Слайд 24Н.Н. Семёнов 1896–1986 гг.
В разработке этих цепных реакций огромную роль сыграли
работы русского
учёного, лауреата Нобелевской премии Николая Николаевича Семёнова.
учёного, лауреата Нобелевской премии Николая Николаевича Семёнова.
Слайд 28Реакция фторирования алканов идёт
с очень высокой, часто взрывной скоростью с образованием
всех возможных полифторпроизводных исходного алкана.
Слайд 29М.И. Коновалов 1858–1906 гг.
Нитрование алканов (реакция Коновалова) также идет
по радикальному механизму.
RH
+ NO2 → R· + HNO2 R∙ + NO2 → RNO2
Слайд 30Реакцию проводят в растворе
при температуре выше 150°С или в парах под
давлением до 10 атм и температуре 400–500°С.
Слайд 32Крекинг — процессы термического разложения, протекающие при нагревании органических веществ без
доступа воздуха и приводящие
к образованию соединений с меньшей относительной молекулярной массой.
к образованию соединений с меньшей относительной молекулярной массой.
Слайд 33Реакции, свойственные насыщенным углеводородам:
окисление;
замещение;
взаимодействие с водяным
паром;
крекинг.
Слайд 35Бензол (C₆H₆)
Все алканы легче воды, в ней не растворимы, однако
растворимы в
неполярных растворителях и сами
являются очень хорошими растворителями.
являются очень хорошими растворителями.