- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Горизонтальный способ решения задач по химии
Содержание
- 1. Презентация по химии Горизонтальный способ решения задач по химии
- 2. «Предмет нашей законной гордости – большой объём
- 3. Слайд 3
- 4. Научиться решать задачи, значит научиться - думать
- 5. В процессе решения задач: формируется научное мировоззрениереализуется
- 6. В придании старым мыслям новой формы состоит всё искусство и всё творчество. А.Франс
- 7. «Как решать задачи?» - однозначного ответа дать
- 8. Хорошее решение – результат опыта.
- 9. Порядок больше всего помогает ясному усвоению
- 10. Чтение условия задачиСоставление формул, уравнений реакцийЗапись
- 11. Решение любой задачи сводится к верной расстановке
- 12. В основе системного подхода к решению
- 13. Основной источник ошибок при решении задач
- 14. ВЫВОД ФОРМУЛ ВЕЩЕСТВ Задача №15 §4 А.И.
- 15. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Задача №412 с.52 В.Н.Хвалюк,
- 16. Слайд 16
- 17. ЗАДАЧИ НА ВЫВОД ФОРМУЛ Задача №43
- 18. ВЫВОД ФОРМУЛ ПО ПРОДУКТАМ СГОРАНИЯ Задача №8
- 19. Слайд 19
- 20. ЗАДАЧИ НА СМЕСИ ЦТ-2010,
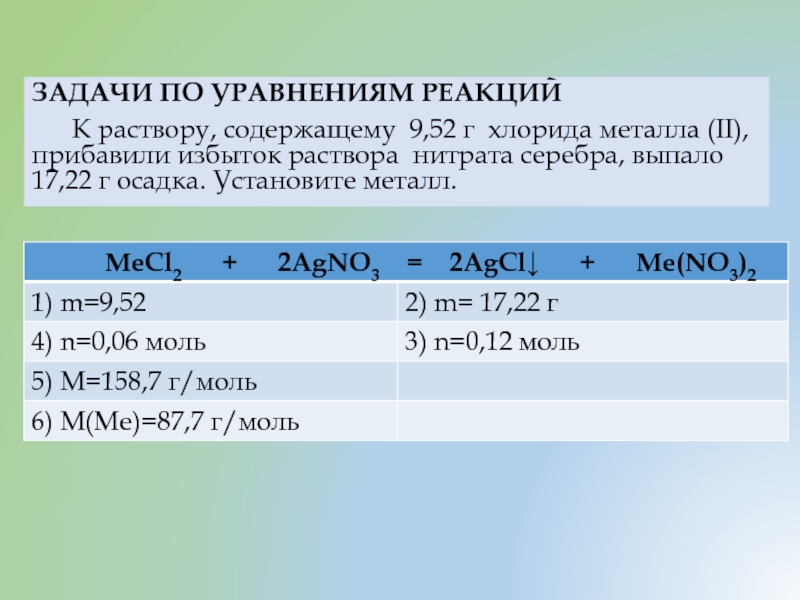
- 21. ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ К раствору,
- 22. ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ Какой объём
- 23. ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ Сульфат меди
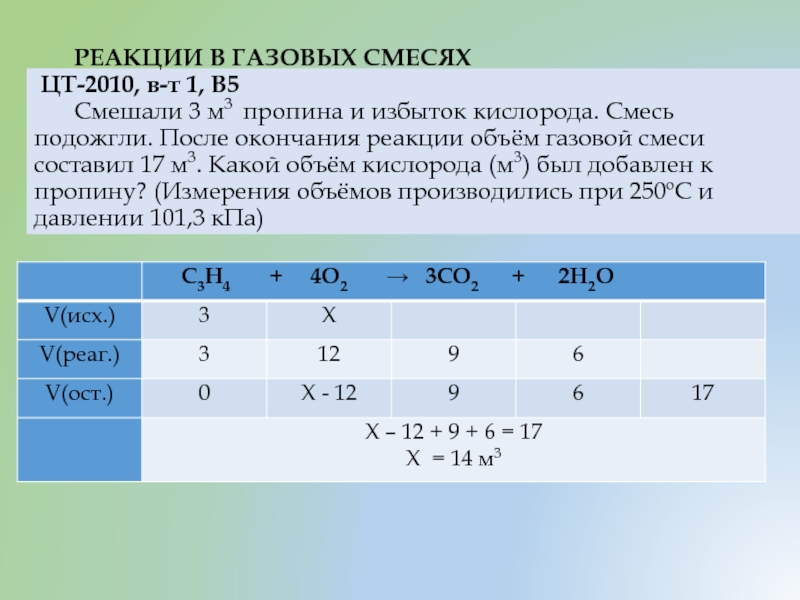
- 24. РЕАКЦИИ В ГАЗОВЫХ СМЕСЯХ ЦТ-2010,
- 25. СМЕСИ Найдите массовую долю формальдегида в формалине, в котором на 11 протонов приходится 9 нейтронов
- 26. ЗАДАЧИ НА СМЕСИ Смесь
- 27. Слайд 27
- 28. ЗАДАЧИ
- 29. Слайд 29
- 30. РЕАКЦИИ В РАСТВОРАХ (КРИСТАЛЛОГИДРАТЫ) Кристаллогидрат карбоната натрия
- 31. СМЕШИВАНИЕ РАСТВОРОВ Смешали 142 см3 20%
- 32. ГАЗОВЫЕ СМЕСИ О
- 33. Задачи на «пластинку» Железную пластинку массой 8
- 34. РЕАКЦИИ В ГАЗОВЫХ СМЕСЯХ ЦТ 2009, В-т
- 35. РЕАКЦИИ В РАСТВОРАХ В водном растворе массой
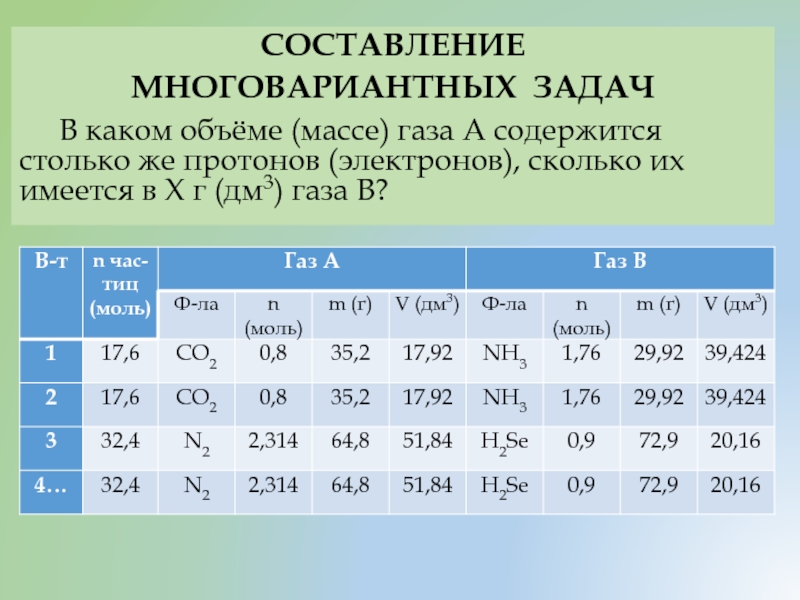
- 36. СОСТАВЛЕНИЕ МНОГОВАРИАНТНЫХ ЗАДАЧ В каком объёме (массе)
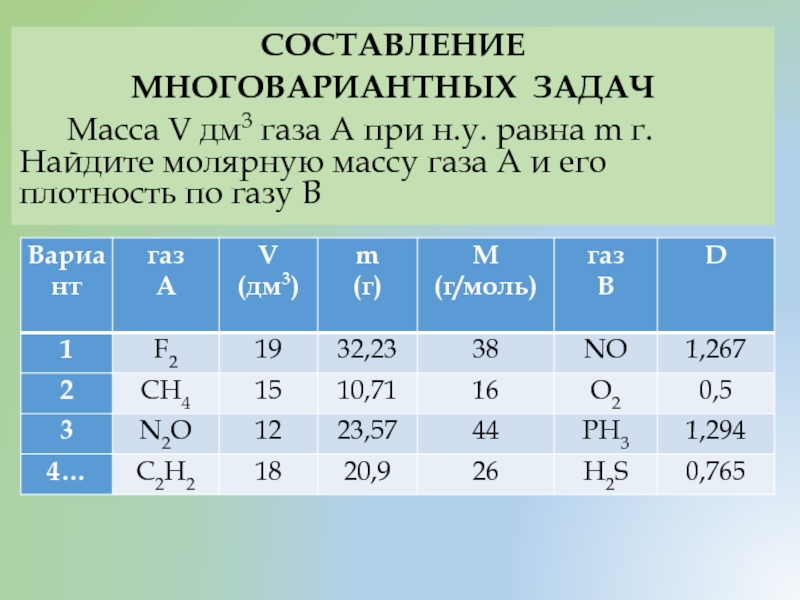
- 37. СОСТАВЛЕНИЕ МНОГОВАРИАНТНЫХ ЗАДАЧ Масса V дм3
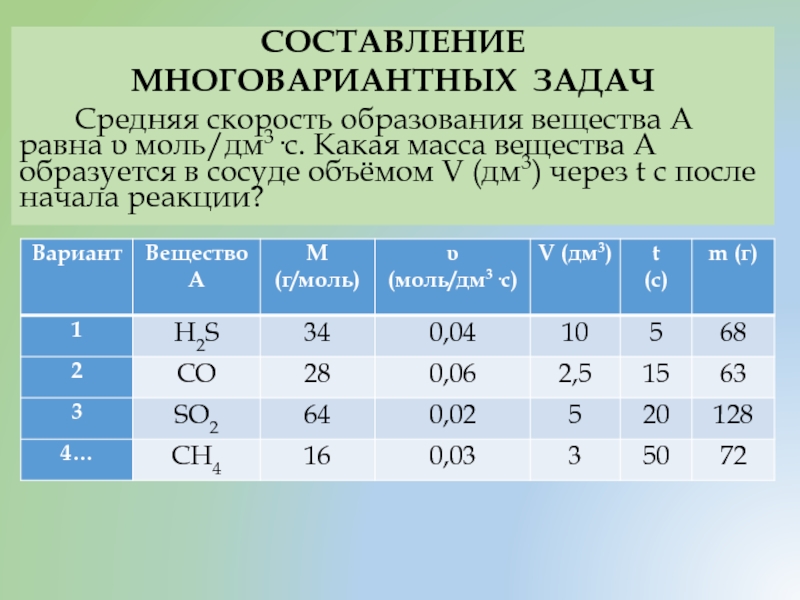
- 38. СОСТАВЛЕНИЕ МНОГОВАРИАНТНЫХ ЗАДАЧ Средняя скорость образования
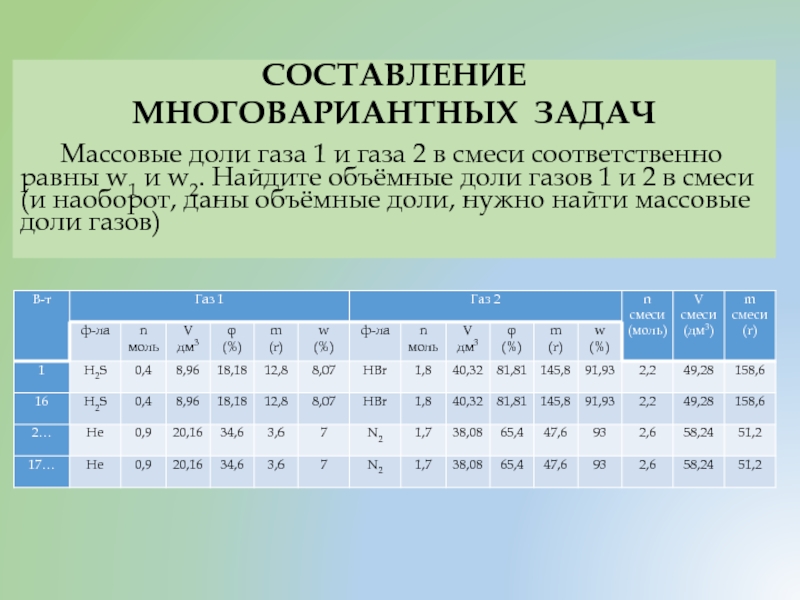
- 39. СОСТАВЛЕНИЕ МНОГОВАРИАНТНЫХ ЗАДАЧ Массовые доли газа 1
- 40. Когда вам покажется, что цель
- 41. Успех – не окончателен, неудачи не
- 42. Возможно всё. На невозможное просто требуется больше времени. Д. Браун
- 43. Литература:Аркавенко, Л.Н. Использование знакового алгоритма при решении
- 44. Литература: Дьяченко, В.К. Организационная структура учебного
Слайд 1«Горизонтальный» способ решения расчётных задач
по химии
Мелеховец Светлана Сергеевна,
учитель-методист, учитель химии
ГУО «Лицей №1 имени
А.С. Пушкина г. Бреста»
Слайд 2«Предмет нашей законной гордости – большой объём фактических знаний – в
В.В. Гузеев
Слайд 4 Научиться решать задачи,
значит научиться
- думать
- анализировать
- размышлять
- рассуждать
- мыслить логически
- считать
- представлять
- сопоставлять
- ставить цели
- мыслить образно
- выделять главное и несущественное
- планировать деятельность
- делать выводы и т.д.
Слайд 5В процессе решения задач:
формируется научное
мировоззрение
реализуется связь теории
с практикой
формируются
приёмы мышления
- реализуются межпредметные связи
происходит закрепление полученной на уроке информации, более прочное усвоение учебного материала, осознание и запоминание фактов, теорий и законов, правил, химических формул и уравнений
воспитывается трудолюбие, ответственность, целеустремлённость и другие важные качества и т.д.
И всё это – в действии!
Слайд 7«Как решать задачи?» - однозначного ответа дать нельзя!
Существует множество методов, способов
Умение решать задачи,
есть искусство,
приобретающееся
практикой.
Д. Пойма
Слайд 8Хорошее решение – результат опыта. А опыт - результат плохих решений. Уолтер
Сложные задачи — понятие объективное, подразумевает большое число элементов теоретических знаний по разным темам курса химии, определенного перечня мыслительных операций и практических навыков решения задач разных типов
Трудные задачи — понятие субъективное. Имеются в виду задачи, требующие творческого подхода, неожиданных решений, умственных действий. Для учеников со слабой обучаемостью трудной задачей может оказаться и сравнительно простая задача
Слайд 9Порядок больше всего помогает ясному усвоению
АНАЛИТИЧЕСКИЙ
(от искомой величины к известным данным)
Этот метод составления плана решения задачи представляет собой ряд связанных между собой и вытекающих один из другого выводов и поэтому при его использовании учащиеся допускают меньше ошибок логического характера.
СПОСОБЫ ЛОГИЧЕСКИХ РАССУЖДЕНИЙ
СИНТЕТИЧЕСКИЙ
(от известных данных к искомой величине)
Главный недостаток: первые шаги при решении задачи (выбор данных для простой задачи) не всегда сразу приводят к искомому результату. Ошибки: в сравнении и выборе данных; в составлении плана решения.
Слайд 10
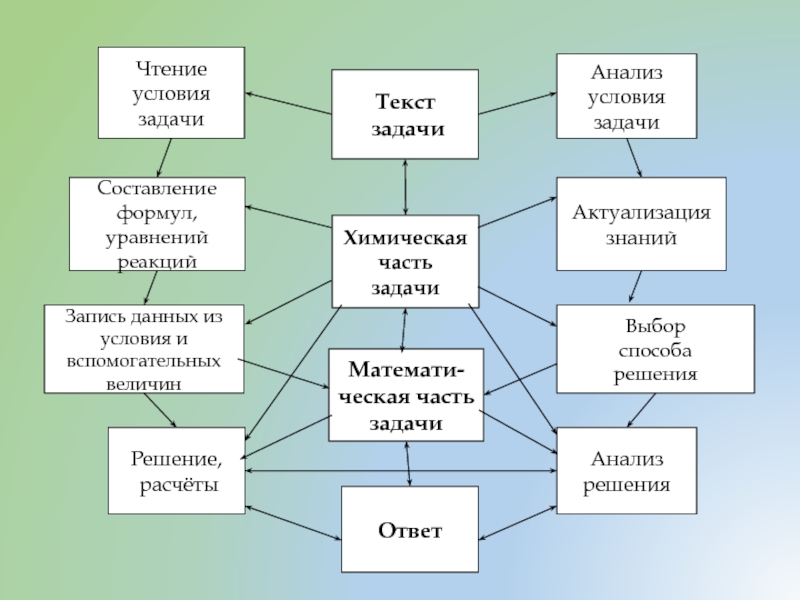
Чтение условия задачи
Составление формул, уравнений реакций
Запись данных из условия и
Решение,
расчёты
Анализ
решения
Выбор
способа
решения
Актуализация знаний
Анализ условия задачи
Ответ
Математи-ческая часть задачи
Химическая часть
задачи
Текст
задачи
Слайд 11Решение любой задачи сводится к верной расстановке чисел.
Георгий Александров
Процесс
Величины следует обозначать соответствующими буквами, помнить о единицах измерения величин и привести их в соответствие друг с другом.
Результат напрямую зависит от того, насколько правильно записано условие задачи. Запись условия задачи должна быть понятной, удобной, компактной и наглядной. Такой, чтобы при необходимости быстро вернуться к исходным данным, восстановить ход решения задачи, проверить расчёты и логику решения.
Слайд 12
В основе системного подхода к решению задач должны лежать принципы
Решение должно начинаться с записи формулы для расчёта искомой величины.
Затем решение разбивается на фрагменты, в каждом из которых последовательно находят величины, необходимые для ответа на главный вопрос
Слайд 13
Основной источник ошибок при решении задач – затруднение в выборе
В условиях большинства задач задана программа их решения, так как между искомой величиной и известным значением данной величиы существует определённая связь. И решение задачи сводится к поиску этой связи.
Мы находим несколько решений одного и того же вопроса не столько потому, что наш ум очень плодовит, сколько потому, что он не слишком прозорлив и, вместо того чтобы остановиться на самом лучшем решении, представляет нам без разбора все возможности сразу.
Ларошфуко Ф.
Слайд 14 ВЫВОД ФОРМУЛ ВЕЩЕСТВ Задача №15 §4 А.И. Врублевский «Тренажёр по химии» При термическом
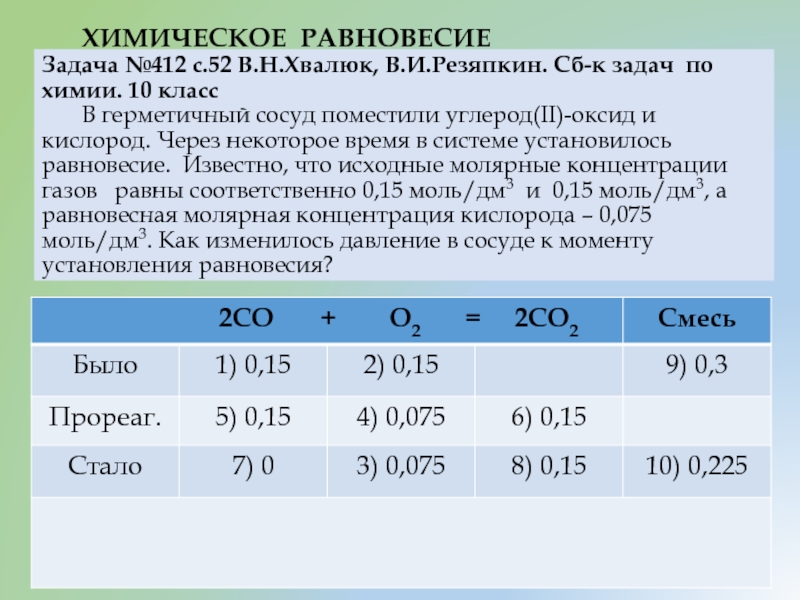
Слайд 15 ХИМИЧЕСКОЕ РАВНОВЕСИЕ Задача №412 с.52 В.Н.Хвалюк, В.И.Резяпкин. Сб-к задач по химии. 10
Слайд 16
ГАЗОВЫЕ СМЕСИ
В смеси SO2 и SO3 на каждые 5 атомов серы приходится 12 атомов кислорода. Определите объёмную долю сернистого газа в смеси.
Слайд 17 ЗАДАЧИ НА ВЫВОД ФОРМУЛ Задача №43 §4 А.И. Врублевский «Тренажёр по
Слайд 18ВЫВОД ФОРМУЛ ПО ПРОДУКТАМ СГОРАНИЯ Задача №8 §5 А.И. Врублевский «Тренажёр по
Слайд 19
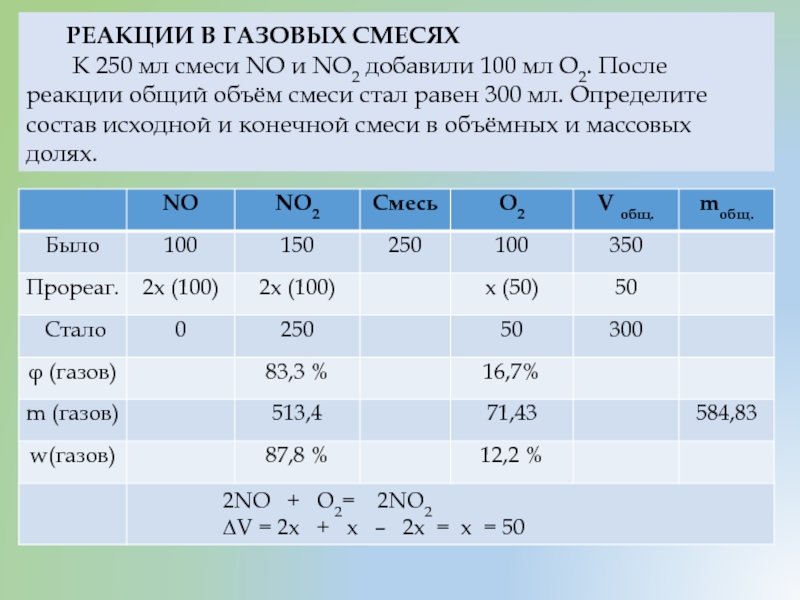
РЕАКЦИИ В ГАЗОВЫХ СМЕСЯХ
К 250 мл смеси NO и NO2 добавили 100 мл О2. После реакции общий объём смеси стал равен 300 мл. Определите состав исходной и конечной смеси в объёмных и массовых долях.
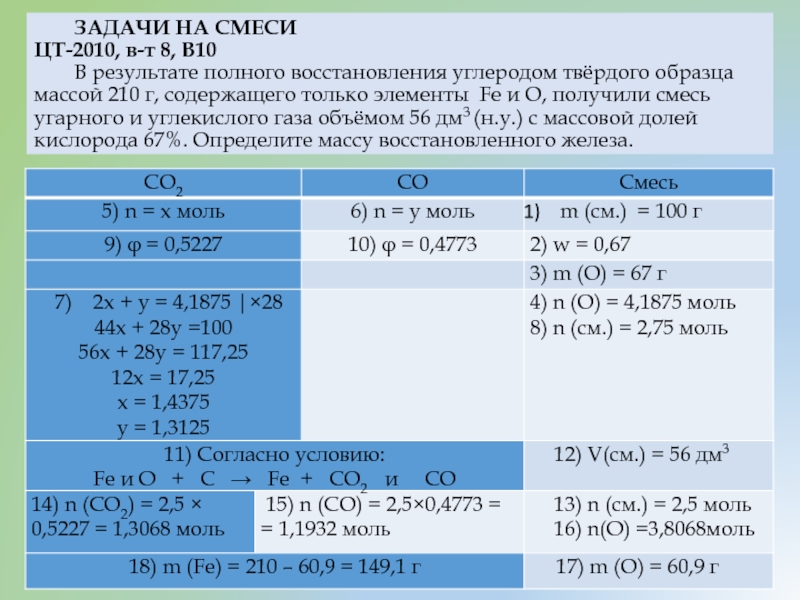
Слайд 20 ЗАДАЧИ НА СМЕСИ ЦТ-2010, в-т 8, В10 В результате полного восстановления углеродом
Слайд 21
ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ
К раствору, содержащему 9,52 г хлорида
Слайд 22
ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ
Какой объём водорода выделится при
5 × 1023 атомов цинка с раствором, содержащим 64 г НCl.
Слайд 23
ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ
Сульфат меди (II) массой 35,00 г
Слайд 24 РЕАКЦИИ В ГАЗОВЫХ СМЕСЯХ ЦТ-2010, в-т 1, В5 Смешали 3 м3
Слайд 25
СМЕСИ
Найдите массовую долю формальдегида в формалине, в котором на
Слайд 26 ЗАДАЧИ НА СМЕСИ Смесь сульфита аммония и сульфата щелочного
Слайд 27 ЗАДАЧИ НА СМЕСИ 2016
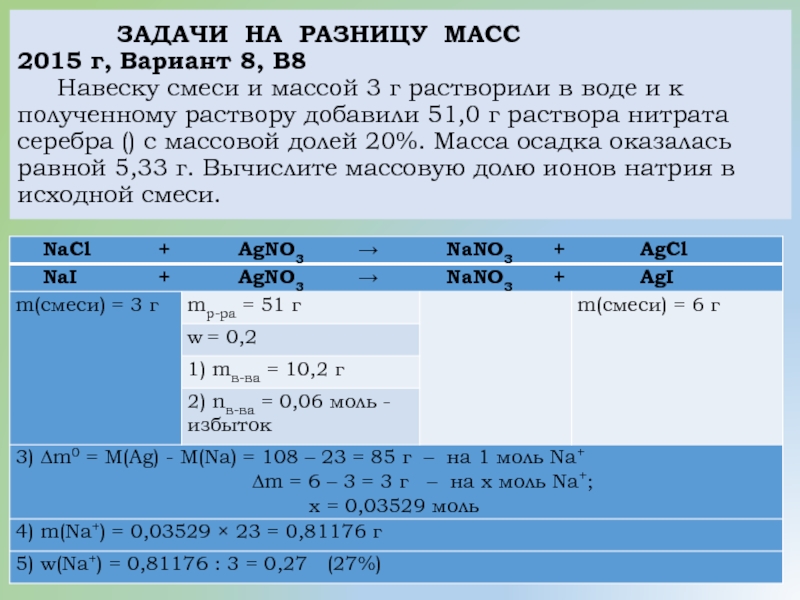
Слайд 28 ЗАДАЧИ НА РАЗНИЦУ МАСС 2015 г,
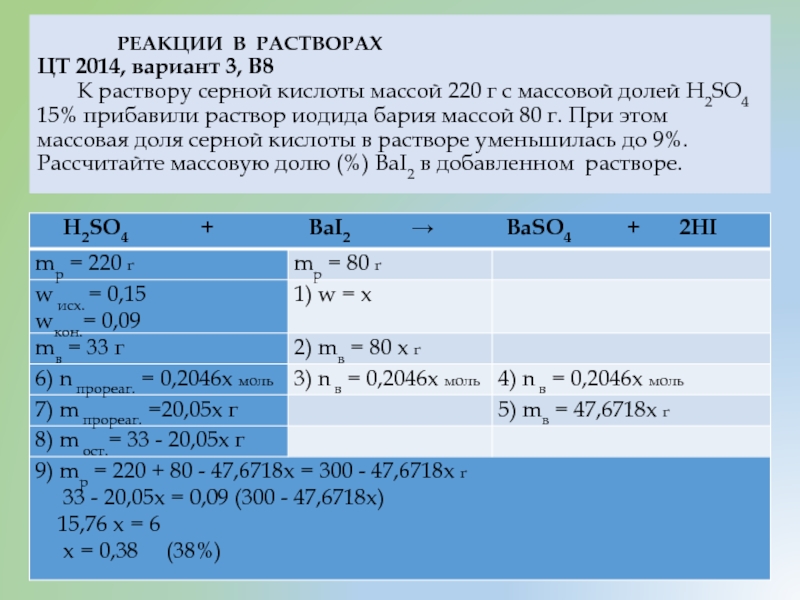
Слайд 29 РЕАКЦИИ В РАСТВОРАХ ЦТ
Слайд 30РЕАКЦИИ В РАСТВОРАХ (КРИСТАЛЛОГИДРАТЫ) Кристаллогидрат карбоната натрия массой 5 г растворили в
Слайд 31СМЕШИВАНИЕ РАСТВОРОВ Смешали 142 см3 20% раствора гидроксида калия (ρ =
Слайд 32 ГАЗОВЫЕ СМЕСИ О смеси алкана и алкина известно
Слайд 33 Задачи на «пластинку» Железную пластинку массой 8 г поместили в 94,4 г
Слайд 34 РЕАКЦИИ В ГАЗОВЫХ СМЕСЯХ ЦТ 2009, В-т 10, В10 Укажите массу воды
Слайд 35РЕАКЦИИ В РАСТВОРАХ В водном растворе массой 147 г с массовой долей
Слайд 36
СОСТАВЛЕНИЕ
МНОГОВАРИАНТНЫХ ЗАДАЧ
В каком объёме (массе) газа А содержится столько
Слайд 37
СОСТАВЛЕНИЕ
МНОГОВАРИАНТНЫХ ЗАДАЧ
Масса V дм3 газа А при н.у.
Слайд 38
СОСТАВЛЕНИЕ
МНОГОВАРИАНТНЫХ ЗАДАЧ
Средняя скорость образования вещества А равна υ
Слайд 39
СОСТАВЛЕНИЕ
МНОГОВАРИАНТНЫХ ЗАДАЧ
Массовые доли газа 1 и газа 2 в
Слайд 40 Когда вам покажется, что цель недостижима, не изменяйте цель, измените
Слайд 41Успех – не окончателен, неудачи не фатальны: значение имеет лишь мужество
Слайд 43Литература:
Аркавенко, Л.Н. Использование знакового алгоритма при решении задач по химии /
Архангельская, О.В. Решение задач: чем проще, тем изящнее / О.В. Архангельская // Химия в школе –1998. – №4. – С. 46 – 49.
Архангельская, О.В., Тюльков, И.А. “Трудная задача? Начнём по порядку…” / О.В.Архангельская, И.А.Тюльков // Химия в школе – 2005, № 2 , с. 51-55
Ахметов, М.А. “Решение задач повышенной трудности с использованием таблиц / М.А.Ахметов // Химия в школе – 2005 № 4 с. 56-58
Белан, Н.А “Нарисуй задачу”/ Н.А. Белан // Химия в школе – 2006 № 2 с. 44-45
Беляев, Н.Н. О системном подходе к решению задач / Н.Н. Беляев // Химия в школе – 1998. – №4. – С. 46 – 49.
Бобков, А.В. К методике решения расчётных задач с использованием табличной формы записи / А.В. Бобков, А.Д. Михайлова // Химия в школе –1990. – №6. – С. 39 – 40.
Бондарь, Д.А.“Трудная задача? Начнём по порядку…” / Д.А. Бондарь, И.А.Тюльков // Химия в школе – 1999, № 1, с.31-33; № 2, с.55-57; 2000, № 5 , с.69-71
Врублевский, А.И. Тренажёр по химии / А.И. Врублевский – 2-е изд. – Минск : Красико-Принт, 2014.
Герещенко, И.И. Решение задач на растворы / И.И .Герещенко // Химия в школе –1994.–№5.–С. 47–48
Давыдов, В.Н. “Генеалогическое древо в обучении решению расчётных задач”/ В.Н. Давыдов // Химия в школе – 1999, № 5 , с. 43-46
Слайд 44
Литература:
Дьяченко, В.К. Организационная структура учебного процесса и ее развитие
Кананович, Ю.С. Решение задач с на смешивание и разбавление растворов / Ю.С. Кананович // Химия в школе – 1992. – № 3. – С. 35 – 39.
Новиков, Ю.Е. Применение опорных схем при решении расчётных задач / Ю.Е. Новиков, О.С. Заречнюк // Химия в школе – 1991. – №5. – С. 31– 33.
Новосёлов, А.В. “Учимся решать задачи на смеси органических веществ” / А.В.Новосёлов // Химия в школе – 2002, № 9 , с. 69-72
Прошлякова, Л.А. От закона к способу решения задачи / Л.А. Прошлякова // Химия в школе –1997. – №3. – С. 28 – 29.
Шабаршин, В.М. “Решение расчётных задач с использованием обобщающих таблиц” / В.М.Шабаршин // Химия в школе – 2002, № 6 , с. 52-54
Шамова, М.О. Решение задач связанных с образованием кристаллогидратов из растворов / М.О.Шамова // Химия в школе –1995. –№5. – С. 24 – 29.
Шамова, М.О. Учимся решать расчетные задачи по химии. / М.О. Шамова М. // Школьная пресса, 2003
Шишкин, Е.А. “Обобщения в процессе обучения решению задач”/ Е.А.Шишкин // Химия в школе – 2000, № 5 , с. 59-62
Яковлев, Ю.Б. Использование условия химической задачи как программы для её решения / Ю.Б.Яковлев // Химия в школе –1996. – №5. – С. 45 – 46.
Сборники заданий централизованного тестирования 2010-2017 год