- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Главная шпаргалка на ОГЭ по химии- ПСХЭ
Содержание
- 1. Презентация по химии Главная шпаргалка на ОГЭ по химии- ПСХЭ
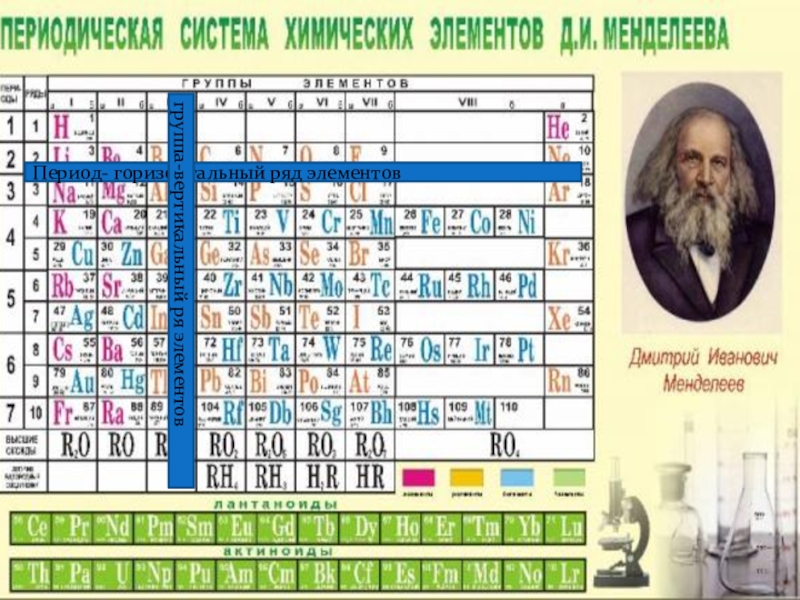
- 2. Период- горизонтальный ряд элементовгруппа-вертикальный ря элементов
- 3. Периодическая система представляет собой многоэтажный «дом», в
- 4. Как в любом доме, здесь имеются «подъезды»,
- 5. Задание1Четыре электрона находятся во внешнем электронном слое
- 6. Задание 2В каком ряду химические элементы расположены
- 7. Задание 16В ряду химических элементов В —
- 8. Подсказка1 1. По порядковому номеру элемента можно
- 9. Реши сам1.В атоме кремния число электронов на
- 10. 1.Семь электронов на внешнем уровне в атоме1)
- 11. Подсказка 2По порядковому номеру элемента можно рассчитать
- 12. 3.Определите число протонов, электронов и нейтронов ватоме
- 13. Подсказка 2Слева направо по периоду:а) металлические свойства
- 14. Сверху вниз по группе:а) металлические свойства
- 15. Слайд 15
- 16. 1.В каком ряду химические элементы расположены в
- 17. 3.В ряду химических элементов F-Cl-Br1) уменьшается число
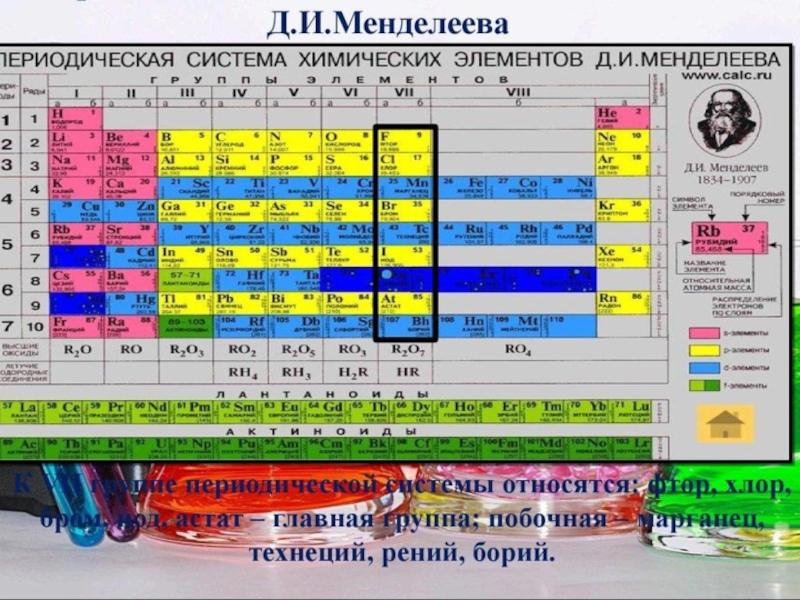
- 18. Металлы и неметаллы
- 19. 1. Ковалентная связь — это связь, которая
- 20. Воспользуйся подсказкой1.В соединении калия с хлором химическая
- 21. Типы кристаллических решеток:а) атомная — образуется у
- 22. 1.В каких веществах ионная и металлическая связи
- 23. Но можно решить и задачи….1.Массовая доля водорода
- 24. Слайд 24
- 25. Слайд 25
- 26. Проверь себя
- 27. Оцени свой успех
- 28. Слайд 28
- 29. 5 интересных фактов…..№1: элемент 115 живет меньше
- 30. №2: Менделеев любил карточные игрыОткрытию периодической системы
- 31. №3: Менделеев предсказал существование элементов, которые еще
- 32. №4: некоторые атомы могут «любить друг друга»Если взять
- 33. №5: Радиоактивные элементы двигаются по таблицеК сожалению,
Слайд 1Главная шпаргалка
на ОГЭ по химии…
………
ПСХЭ
Мастер-класс учителя химии и биологии
Слайд 3Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество
Слайд 4Как в любом доме, здесь имеются «подъезды», а именно группы. Причем
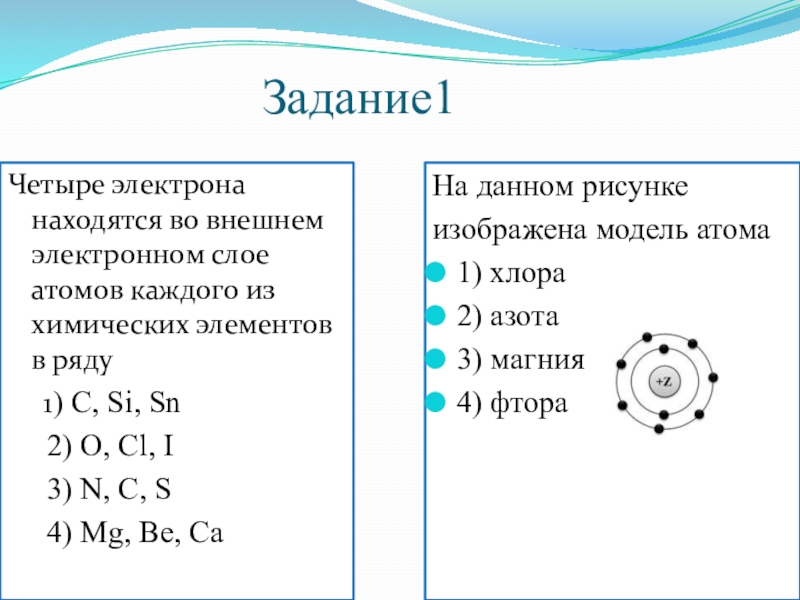
Слайд 5Задание1
Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
1) С, Si, Sn
2) О, Cl, I
3) N, C, S
4) Mg, Be, Ca
На данном рисунке
изображена модель атома
1) хлора
2) азота
3) магния
4) фтора
Слайд 6Задание 2
В каком ряду химические элементы расположены в порядке усиления неметаллических
1) O-S-Se
2) Si-P-S
3) S-Р-Si
4) O-N-C
В каком ряду химические элементы расположены в по-
рядке увеличения металлических свойств?
1) Li-Be-B
2) Li-Na-K
3) Mg-Al-Si
4) Ca-Mg-Be
Слайд 7Задание 16
В ряду химических элементов В — С — N
1) увеличивается
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
Слайд 8Подсказка1
1. По порядковому номеру элемента можно определить:
а) заряд ядра;
б) число
в) число электронов;
г) рассчитать число нейтронов (от относительной атом-ной массы отнять число протонов).
2. По номеру периода определяют число электронных
уровней в атоме.
3. По номеру группы можно определить:
а) число электронов на внешнем уровне для элементов
главной (А) подгруппы;
б) максимальную валентность (есть исключения).
Слайд 9Реши сам
1.В атоме кремния число электронов на внешнем уровне равно
1)
2) 4 4) 5
2.Заряд ядра атома хлора равен
1) +35 3) +17
2) +18 4) +7
3.На данном рисунке
изображена модель атома
1) хлора
2) азота
3) магния
4) фтора
Слайд 101.Семь электронов на внешнем уровне в атоме
1) кислорода
2) фосфора
3) хлора
4) Калия
2.Атомы
1) электронов на внешнем уровне
2) число электронных уровней
3) число протонов
4) число электронов в атоме
Слайд 11Подсказка 2
По порядковому номеру элемента можно рассчитать число нейтронов (от относительной
1.Число нейтронов в изотопе хлора с массой 35 равно
1)17 3) 35 2) 18 4) 20
2. У атомов натрия и магния одинаковое число
1) электронов на внешнем уровне
2) электронных уровней
3) протонов
4) электронов
Слайд 123.Определите число протонов, электронов и нейтронов в
атоме калия с относительной атомной
1) 19 p, 19 e, 20 n
2) 19 p, 20 e, 19 n
3) 39 p, 39 e, 19 n
4) 20 p, 20 e, 19 n
4.Число нейтронов в атоме элемента, имеющего следую-
щее распределение электронов по электронным слоям
2,8,3, с Ar = 27
1) 13
2) 14
3) 15
4) 27
Слайд 13Подсказка 2
Слева направо по периоду:
а) металлические свойства простых веществ, образованных элементами,
б) радиус атома уменьшается;
в) основные свойства оксидов и гидроксидов уменьшаются, а кислотные свойства увеличиваются;
г) восстановительные свойства уменьшаются, а окислительные увеличиваются;
д) электроотрицательность элементов возрастает.
Слайд 14 Сверху вниз по группе:
а) металлические свойства простых веществ, образованных элементами,
б) радиус атома увеличивается;
в) основные свойства оксидов и гидроксидов возрастают, а кислотные свойства убывают;
г) электроотрицательность элементов уменьшается.
Слайд 161.В каком ряду химические элементы расположены в по-
рядке увеличения металлических свойств?
1)
2) Li—Na--K
3) Mg—Al--Si
4) Ca—Mg--Be
2.В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
1) О—S--Se
2) Si—Р---S
3) S----P----Si
4) O---N---C
Слайд 173.В ряду химических элементов F-Cl-Br
1) уменьшается число электронных уровней
2) радиус атома
3) неметаллические свойства убывают
4) увеличивается число электронов на внешнем уровне
5) уменьшаются заряды атомных ядер
4. В ряду химических элементов Si-P-S
1) электроотрицательность атомов уменьшается
2) радиус атома уменьшается
3) уменьшается число электронов на внешнем уровне
4) неметаллические свойства увеличиваются
5) увеличивается число электронных уровней
Слайд 191. Ковалентная связь — это связь, которая образуется между атомами неметаллов.
Полярная
2. Ионная связь образуется между атомами металлов и неметаллов .
3. Металлическая связь образуется между атомами металлов .
Слайд 20Воспользуйся подсказкой
1.В соединении калия с хлором химическая связь
1) ковалентная полярная
2) ковалентная
3) ионная
4) металлическая
2.Химическая связь соответственно: ионная, ковалентная полярная, ковалентная неполярная
1) NaCl, NH3, Br2
2) H2O, CaO, KCl
3) Cl2, MgO, HCl
4) NaOH, H2S, CO
Слайд 21Типы кристаллических решеток:
а) атомная — образуется у веществ с ковалентной по-
лярной
ходятся атомы, эти вещества являются самыми твердыми
и тугоплавкими в природе;
б) молекулярная — образуется у веществ с ковалент-
ной полярной и ковалентной неполярной связями, в узлах
решетки находятся молекулы, эти вещества обладают не-
большой твердостью, легкоплавкие и летучие;
в) ионная — образуется у веществ с ионной связью, в
узлах решетки находятся ионы, эти вещества твердые, ту-
гоплавкие, нелетучие, но в меньшей степени, чем вещества
с атомной решеткой;
г) металлическая — образуется у веществ с металличе-
ской связью, эти вещества обладают теплопроводностью,
электропроводностью, ковкостью и металлическим блеском.
Слайд 221.В каких веществах ионная и металлическая связи соответственно?
1) оксид калия и
2) аммиак и хлор
3) магний и вода
4) бромид натрия и железо
2.В кристалле хлорида калия ионная связь, поэтому хлорид калия
1) пластичен
2) обладает резким запахом
3) тугоплавок
4) летуч
Слайд 23Но можно решить и задачи….
1.Массовая доля водорода в молекуле этанола равна
1)
2) 15% 4) 23%
2. Какая масса осадка получится при взаимодействии избытка раствора сульфата натрия с 74,6 г раствора хлорида бария с массовой долей растворенного вещества 15%?
Слайд 295 интересных фактов…..
№1: элемент 115 живет меньше секунды
Большинство изотопов сверхтяжелых элементов
Так, недавно открытый унунпентий, также известный как элемент 115 и эка-висмут, имеет период полураспада всего около 220-ти миллисекунд.
Слайд 30№2: Менделеев любил карточные игры
Открытию периодической системы поспособствовала любовь Менделеева к
Ученый указывал атомные веса тех или иных элементов на игральных картах, а затем раскладывал их так, как если бы он играл в карточную игру.
Таким образом он визуализировал свое предположение о том, что элементы с похожими свойствами должны быть одинаковых «мастей».
В дальнейшем эти «масти» должны были быть разложены в «стопки» в соответствии с их атомными весами.
Слайд 31№3: Менделеев предсказал существование элементов, которые еще предстояло открыть
Одной из важных
В таблице на момент ее появления оставались пустые ячейки для элементов, которые, согласно предположениям Менделеева, должны существовать, но еще не были открыты.
К примеру, свойства галлия, скандия и магния Менделеев описал еще до их открытия.
Слайд 32№4: некоторые атомы могут «любить друг друга»
Если взять современную периодическую таблицу, вырезать
Элементы из этих групп будут иметь комплиментарные (т.е. дополняющие друг друга) структуры, что и делает возможными реакции между ними.
Слайд 33№5: Радиоактивные элементы двигаются по таблице
К сожалению, у Менделеева не было
Например, в продуктах деления урана-235, обнаружено около 300 изотопов различных элементов: от цинка до гадолиния