- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Газообразные вещества (11 класс)
Содержание
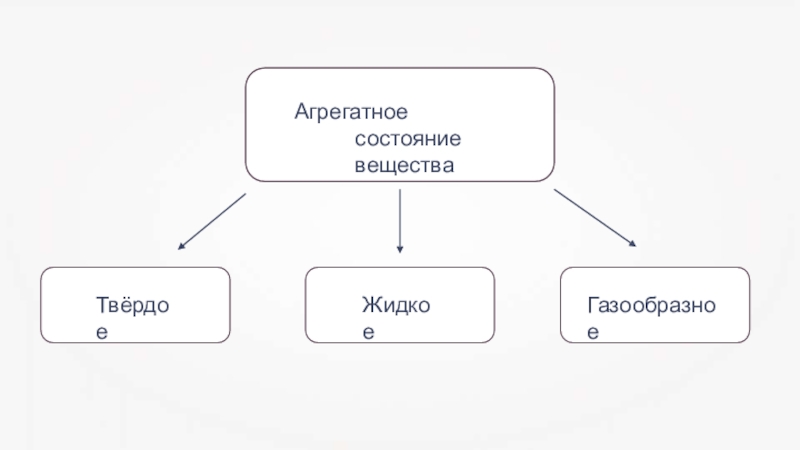
- 1. Презентация по химии Газообразные вещества (11 класс)
- 2. Испарение — переход из жидкого состояния в
- 3. Расстояние между молекуламив разных агрегатных состоянияхГазообразноеЖидкоеТвёрдое
- 4. Амедео Авогадро 1776–1856 гг.Объём, который занимают молекулы
- 5. Амедео Авогадро 1776–1856 гг.Закон Авогадро:В равных объёмах
- 6. Следствие из закона Авогадро1 моль любого газа
- 7. Разные газы могут легко смешиваться друг с
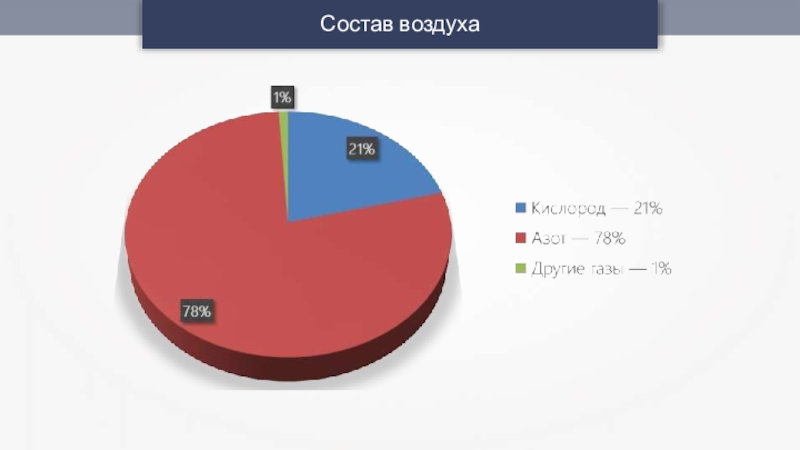
- 8. Состав воздуха
- 9. Состав природного газа, который образуется в недрах
- 10. Природный газ является дешёвым, экологически чистым, энергетически и экономически выгодным топливом.
- 11. Слайд 11
- 12. Применение водородаиспользование в химической промышленности в процессе
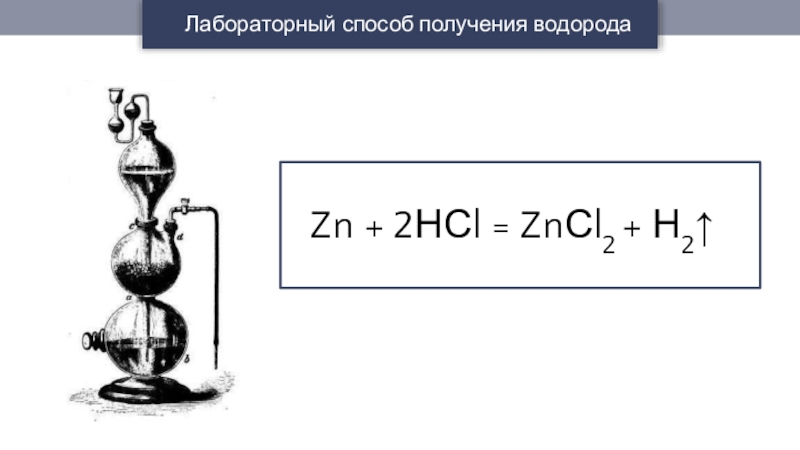
- 13. Лабораторный способ получения водородаZn + 2НСl = ZnСl2 + Н2↑
- 14. Слайд 14
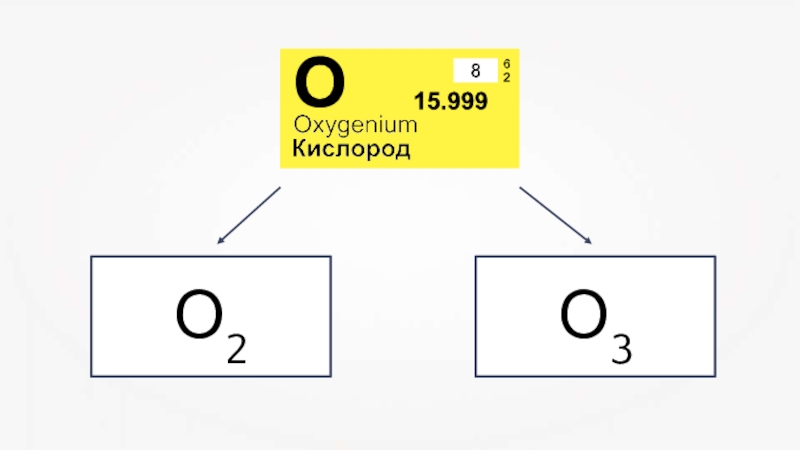
- 15. О2О3
- 16. Лабораторный способ получения кислорода2KMnO4 → K2MnO4 +
- 17. Главные особенности кислорода — это поддержание процессов дыхания и горения, на чём и основано его применение.
- 18. Озон (О3) — газ голубого цвета со
- 19. Слайд 19
- 20. Слайд 20
- 21. Парниковый эффект — нагревание внутренних слоёв атмосферы
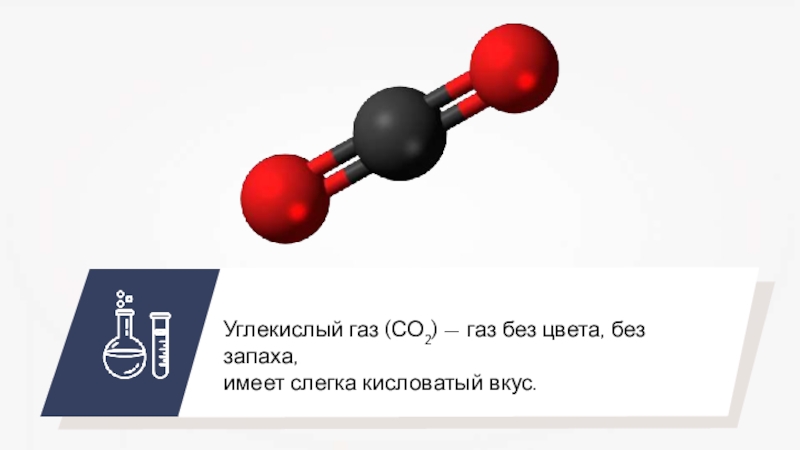
- 22. Углекислый газ (СО2) — газ без цвета, без запаха,имеет слегка кисловатый вкус.
- 23. Получение углекислого газаВ промышленности:В лаборатории:CaCO3 + 2HCl → CaCl2 + CO2↑ + H2OCaCO3 →t CaO + CO2↑
- 24. Качественная реакция на углеродCa(OH)2 + CO2 → CaCO3↓ + H2O
- 25. Углекислый газ не поддерживает процесс горения, поэтому
- 26. Лабораторный способ получения аммиакаNH4Cl + NaOH →
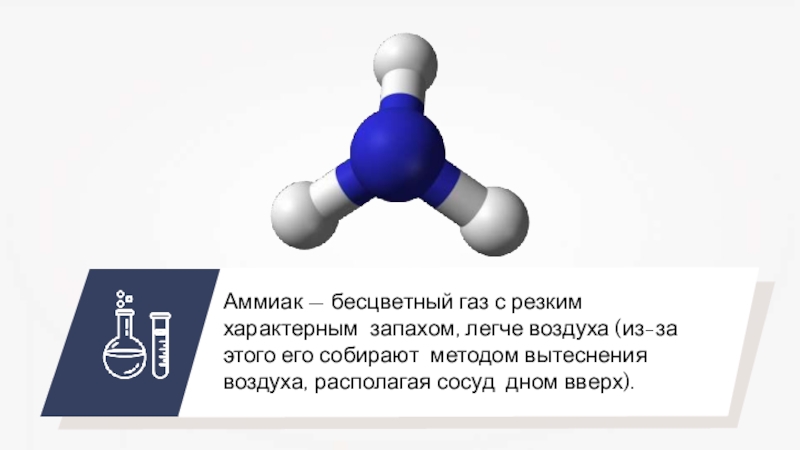
- 27. Аммиак — бесцветный газ с резким характерным
- 28. Способы распознавания аммиакаПо характерному запаху (запах нашатырного
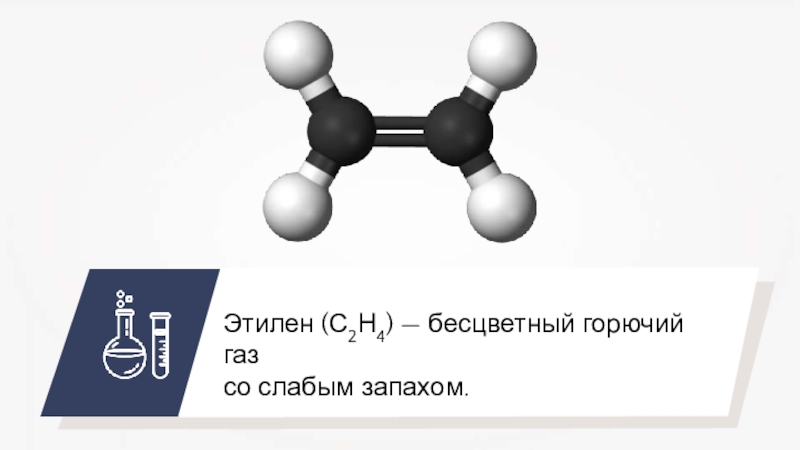
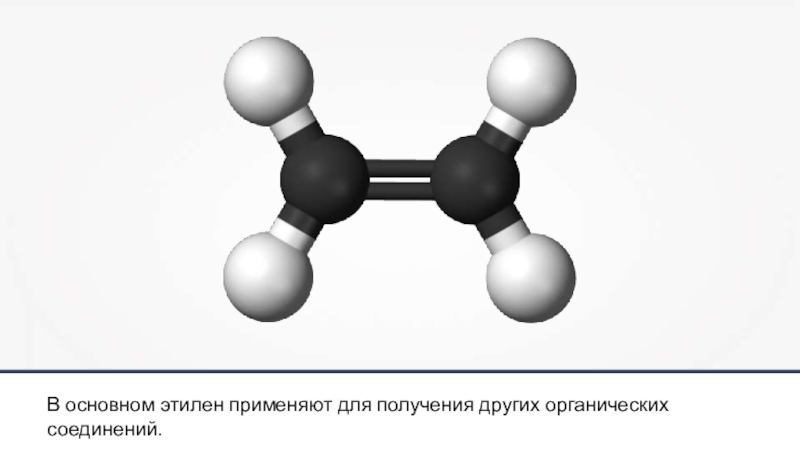
- 29. Этилен (С2Н4) — бесцветный горючий газсо слабым запахом.
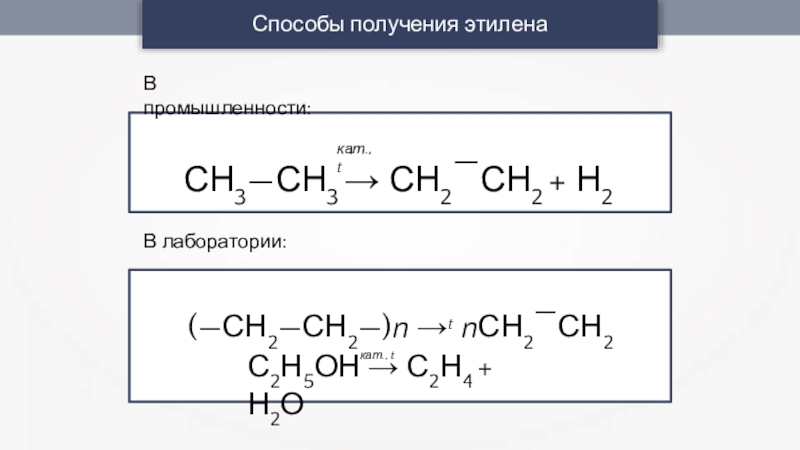
- 30. Способы получения этиленаВ промышленности:С2Н5ОН → С2Н4 + Н2Окат., tСН3—СН3 → СН2—СН2 + Н2В лаборатории:(—СН2—СН2—)n →t nСН2—СН2кат., t
- 31. Реакция распознавания этиленаC2H4 + Br2 → C2H4Br2
- 32. В основном этилен применяют для получения других органических соединений.
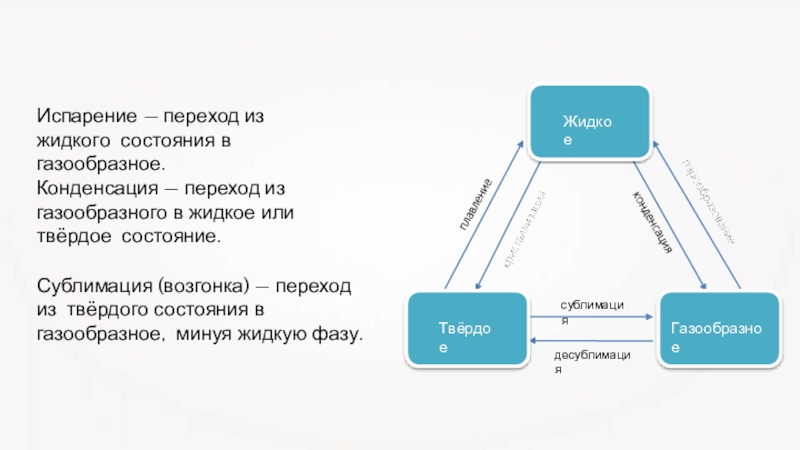
Испарение — переход из жидкого состояния в газообразное.Конденсация — переход из газообразного в жидкое или твёрдое состояние.Сублимация (возгонка) — переход из твёрдого состояния в газообразное, минуя жидкую фазу.ЖидкоеГазообразноеТвёрдоесублимациядесублимация
Слайд 2Испарение — переход из жидкого состояния в газообразное.
Конденсация — переход из
газообразного в жидкое или твёрдое состояние.
Сублимация (возгонка) — переход из твёрдого состояния в газообразное, минуя жидкую фазу.
Сублимация (возгонка) — переход из твёрдого состояния в газообразное, минуя жидкую фазу.
Жидкое
Газообразное
Твёрдое
сублимация
десублимация
Слайд 4Амедео Авогадро 1776–1856 гг.
Объём, который занимают молекулы газа (при одинаковых условиях),
зависит только от числа молекул газа, а не от конкретного вида этих молекул. Поэтому одинаковые количества молекул разных газов должны занимать одинаковые объёмы при данных температуре и давлении.
Слайд 5Амедео Авогадро 1776–1856 гг.
Закон Авогадро:
В равных объёмах различных газов при постоянных
температуре и давлении содержится одинаковое число молекул.
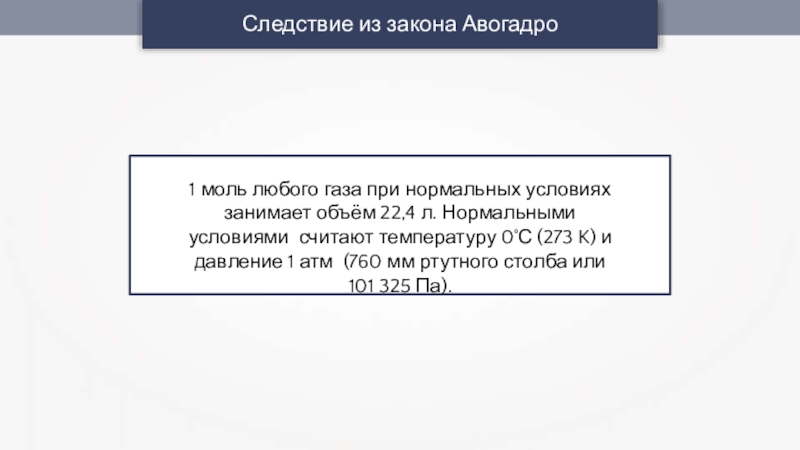
Слайд 6Следствие из закона Авогадро
1 моль любого газа при нормальных условиях занимает
объём 22,4 л. Нормальными условиями считают температуру 0˚С (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па).
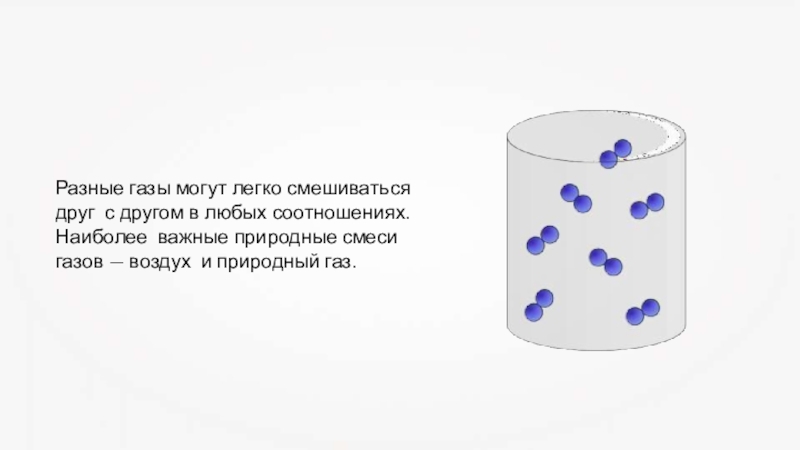
Слайд 7Разные газы могут легко смешиваться друг с другом в любых соотношениях.
Наиболее важные природные смеси газов — воздух и природный газ.
Слайд 9Состав природного газа, который образуется в недрах Земли, не так постоянен
и зависит от месторождения, но всё же основными его компонентами являются предельные углеводороды: метан и его гомологи (этан, пропан, бутан).
Слайд 10Природный газ является дешёвым, экологически чистым, энергетически и экономически выгодным топливом.
Слайд 12Применение водорода
использование в химической промышленности в процессе производства аммиака, хлороводорода;
получение маргарина;
водородная
резка и сварка металлов;
топливо для двигателей космических кораблей;
экологически чистое топливо будущего.
топливо для двигателей космических кораблей;
экологически чистое топливо будущего.
Слайд 16Лабораторный способ получения кислорода
2KMnO4 → K2MnO4 + MnO2 + O2↑
Разложение перманганата
калия:
Разложение пероксида водорода:
2H2O2 → 2H2O + O2↑
MnO2
Слайд 17Главные особенности кислорода — это поддержание процессов дыхания и горения, на
чём и основано его применение.
Слайд 18Озон (О3) — газ голубого цвета со специфическим запахом. Слой, находящийся
на высоте от 12 до 50 км, защищающий Землю от воздействия ультрафиолетовых солнечных лучей, состоит из озона.
Слайд 21Парниковый эффект — нагревание внутренних слоёв атмосферы Земли, обусловленное прозрачностью атмосферы
для основной части излучения Солнца и поглощением атмосферой части теплового излучения поверхности планеты, нагретой Солнцем.
Слайд 23Получение углекислого газа
В промышленности:
В лаборатории:
CaCO3 + 2HCl → CaCl2 + CO2↑
+ H2O
CaCO3 →t CaO + CO2↑
Слайд 25Углекислый газ не поддерживает процесс горения, поэтому он активно используется в
тушении пожаров. С использованием углекислого газа делают газированные напитки, получают «сухой лёд», используемый для охлаждения и хранения продуктов питания.
Слайд 26Лабораторный способ получения аммиака
NH4Cl + NaOH → NH3↑ + NaCl +
H2O
2NH4Cl + CaOH2 → CaCl2 + 2NH3↑ + 2H2O
Слайд 27Аммиак — бесцветный газ с резким характерным запахом, легче воздуха (из-за
этого его собирают методом вытеснения воздуха, располагая сосуд дном вверх).
Слайд 28Способы распознавания аммиака
По характерному запаху (запах нашатырного спирта).
По изменению окраски влажной
лакмусовой бумажки с красного цвета на синий.
По появлению дыма при поднесении стеклянной палочки, которую предварительно окунули в соляную кислоту.
По появлению дыма при поднесении стеклянной палочки, которую предварительно окунули в соляную кислоту.
Слайд 30Способы получения этилена
В промышленности:
С2Н5ОН → С2Н4 + Н2О
кат., t
СН3—СН3 → СН2—СН2
+ Н2
В лаборатории:
(—СН2—СН2—)n →t nСН2—СН2
кат., t