- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Галогены (9 класс)
Содержание
- 1. Презентация по химии Галогены (9 класс)
- 2. Цель:Ознакомление учащихся с особенностями галогенов как химических
- 3. Положение в периодической системе химических элементовЭлементы главной подгруппы VII группы.
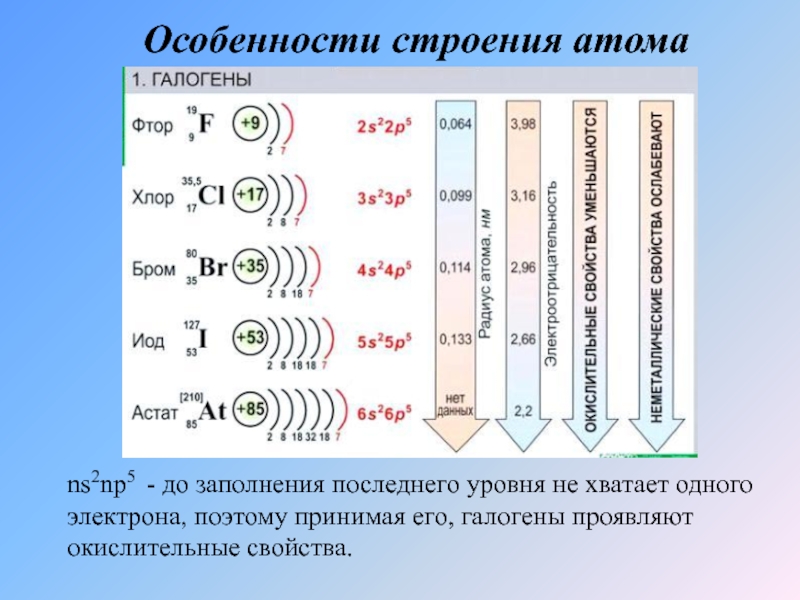
- 4. Особенности строения атомаns2np5 - до заполнения последнего
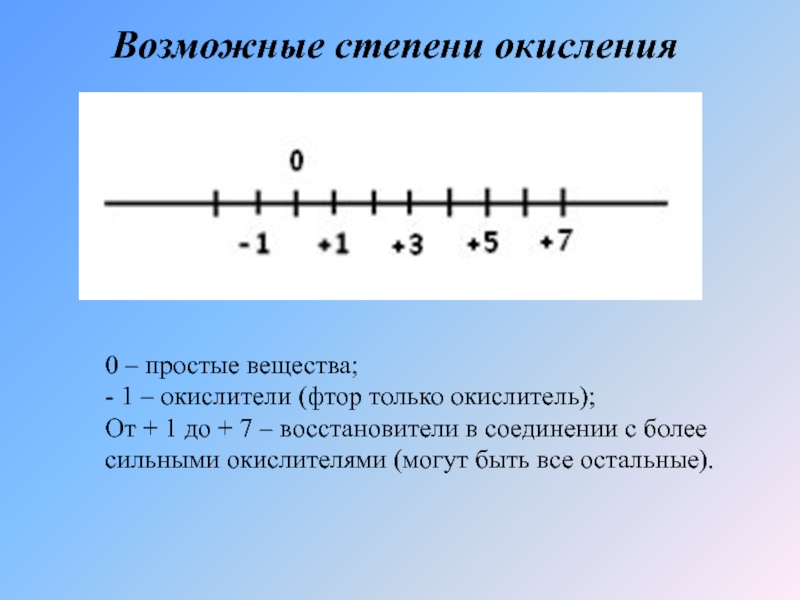
- 5. Возможные степени окисления0 – простые вещества;- 1
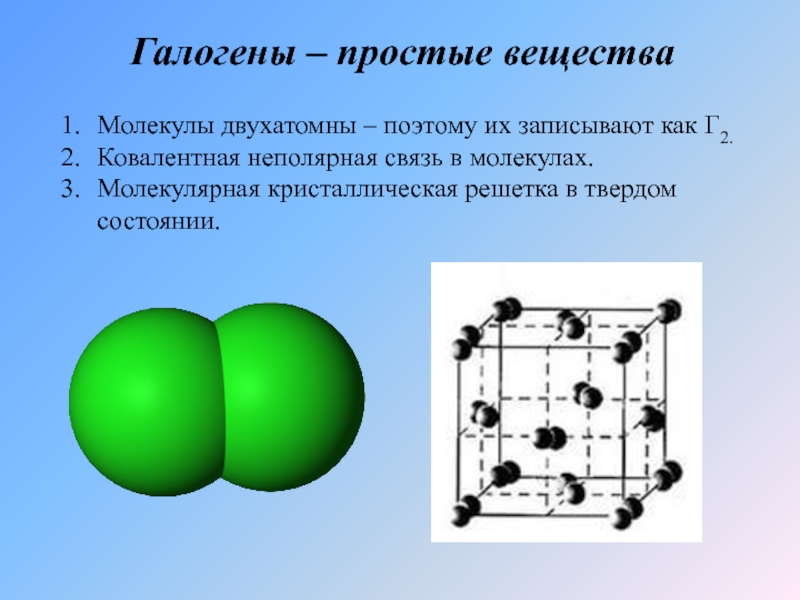
- 6. Галогены – простые веществаМолекулы двухатомны – поэтому
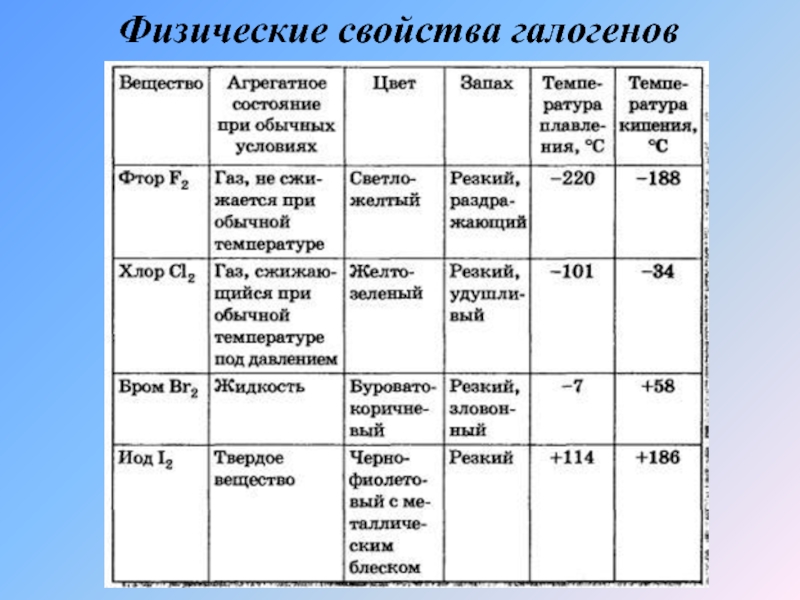
- 7. Физические свойства галогенов
- 8. Уникальность йодаИмеет металлический блеск.Возгонка - переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое. (демонстрация опыта)
- 9. Химические свойстваГ2 + Me = сольГ2 +
- 10. Проверка знаний1. Рассчитать степени окисления атомов химических
- 11. Правильные ответы1. KClO3 (бертолетова соль) - +1,
- 12. Домашнее задание§ 17Разделившись на 5 групп создать
- 13. Список литературыГабриелян О. С. Химия. 9 класс:
Слайд 1Галогены
Учитель биологии, химии
МБОУ «Основная общеобразовательная
школа №1, г. Нытва»
Вилесова Лариса Романовна
Химия 9
Слайд 2Цель:
Ознакомление учащихся с особенностями галогенов как химических элементов и как простых
Задачи:
Сравнить строение атомов галогенов и выделить особенности влияющие на проявление переменной степени окисления.
Дать характеристику физических свойств.
Доказать высокую окислительную способность галогенов при взаимодействии их с другими веществами.
Цели и задачи урока
Слайд 4Особенности строения атома
ns2np5 - до заполнения последнего уровня не хватает одного
Слайд 5Возможные степени окисления
0 – простые вещества;
- 1 – окислители (фтор только
От + 1 до + 7 – восстановители в соединении с более сильными окислителями (могут быть все остальные).
Слайд 6Галогены – простые вещества
Молекулы двухатомны – поэтому их записывают как Г2.
Ковалентная
Молекулярная кристаллическая решетка в твердом состоянии.
Слайд 8Уникальность йода
Имеет металлический блеск.
Возгонка - переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое.
Слайд 9Химические свойства
Г2 + Me = соль
Г2 + Н = Г2Н
Г2 +
Взаимодействие фтора с водой
F2 + H2O = 2HF + O или
3F2 + 3H2O = OF2 + 4HF + H2O2
Взаимодействие со щелочами
Cl2 + KOH = KClO + KCl (на холоде);
3Cl2 + 6KOH = KClO3 + 5KCl + 3Н2О (при нагревании).
Слайд 10Проверка знаний
1. Рассчитать степени окисления атомов химических элементов в следующих соединениях:
2. Самые сильные окислительные свойства из перечисленных галогенов проявляет: F, Cl, Br, I.
3. Соотнесите степени окисления галогена и формулы соединений:
1) –1 а) KClO4 д) I2O7
2) +1 б) KIO3 е) NaClO2
3) +3 в) MgBr2
4) +5 г) HClO
Слайд 11Правильные ответы
1. KClO3 (бертолетова соль) - +1, +5, -2.
HClO4 (хлорная кислота) - +1, +7, -2.
2. F
3. 1 – в, 2 – г, 3 – е, 4 – б.
Слайд 12Домашнее задание
§ 17
Разделившись на 5 групп создать проект на тему «
Слайд 13Список литературы
Габриелян О. С. Химия. 9 класс: Учеб. для общеобразоват. учеб.
Ким Е. П. Химия. 9 класс. Тесты: В 2 ч. – Саратов: Лицей, 2011. – 64 с.