- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Галогены
Содержание
- 1. Презентация по химии Галогены
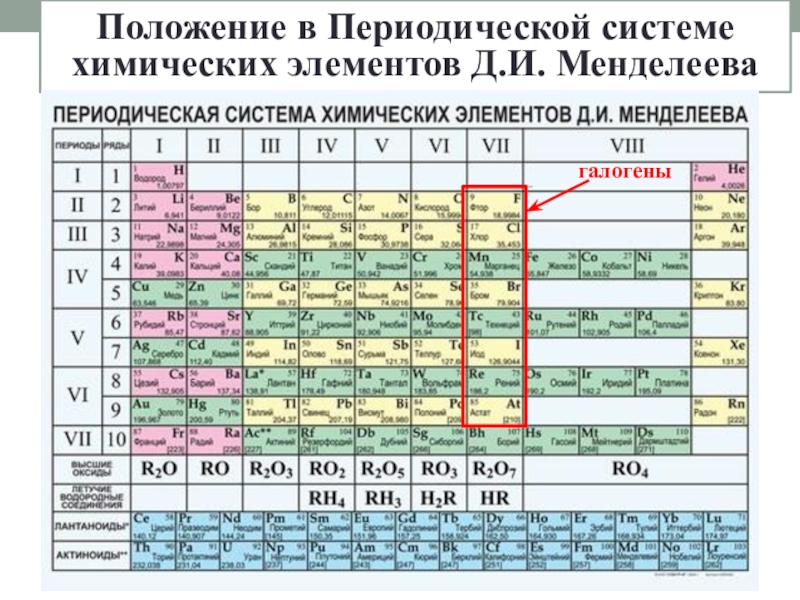
- 2. Положение в Периодической системе химических элементов Д.И. Менделеевагалогены
- 3. Общая характеристика +9 ) )
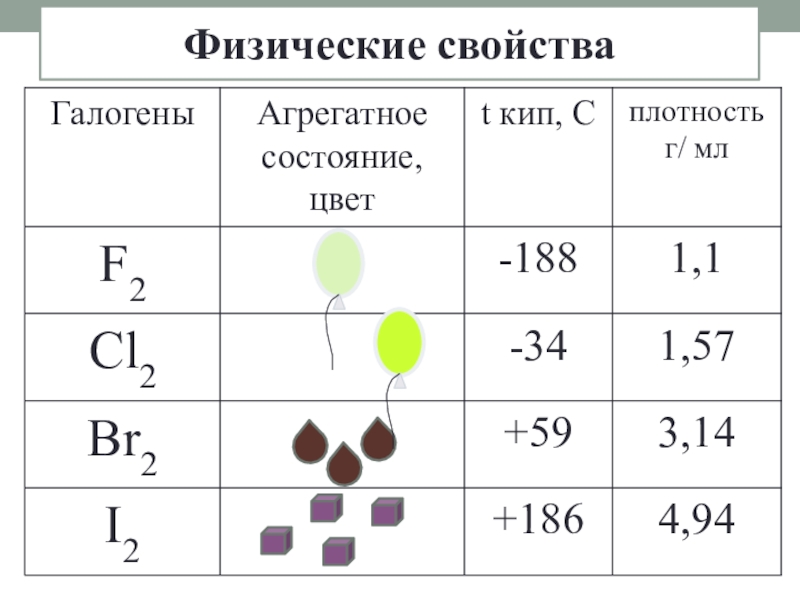
- 4. Физические свойства
- 5. Слайд 5
- 6. В 1774
- 7. В 1825
- 8. В 1811
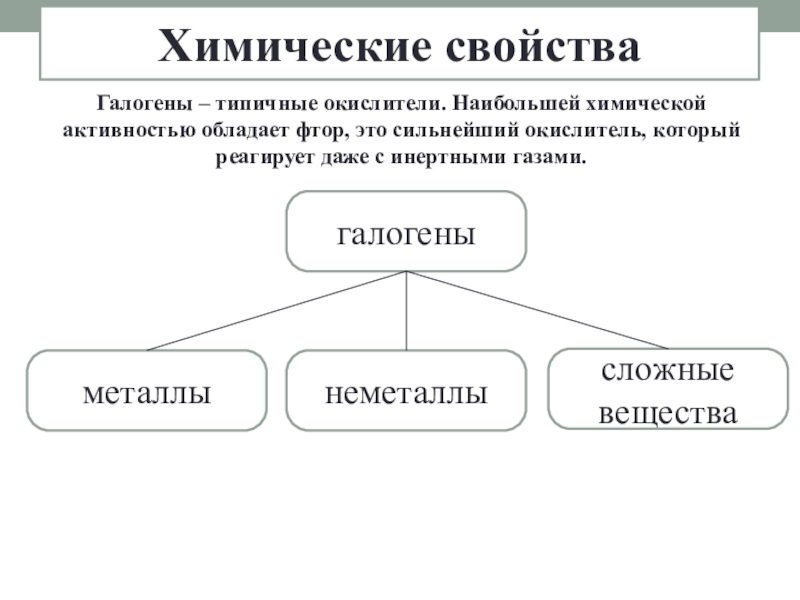
- 9. Галогены – типичные окислители. Наибольшей химической активностью
- 10. С металламиВсе галогены взаимодействуют практически со всеми
- 11. С водородомВсе галогены взаимодействуют с водородом с
- 12. С неметалламиС кислородом и азотом галогены непосредственно
- 13. Взаимодействие со щелочами. Также галогены диспропорционируют в
- 14. Взаимодействие с соединениями других неметаллов:Галогены способны отнимать водород
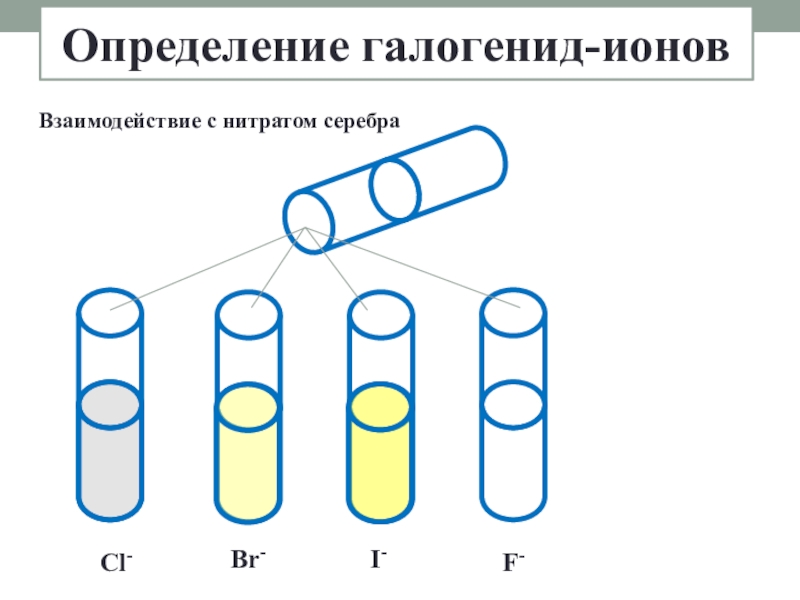
- 15. Определение галогенид-ионовCl-I-Br-F-Взаимодействие с нитратом серебра
- 16. AgNO3 + MeCl = AgCl↓ + MeNO3
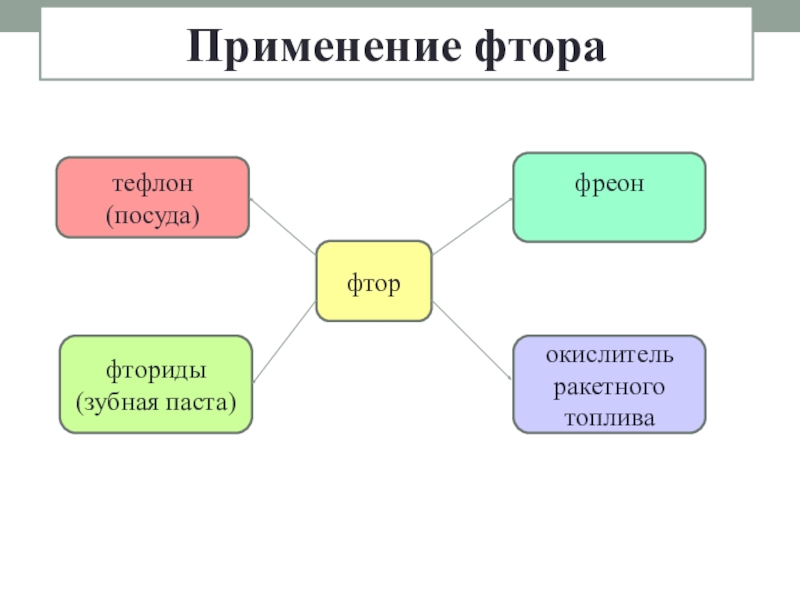
- 17. Применение фторафтортефлон(посуда)фреонокислитель ракетного топливафториды(зубная паста)
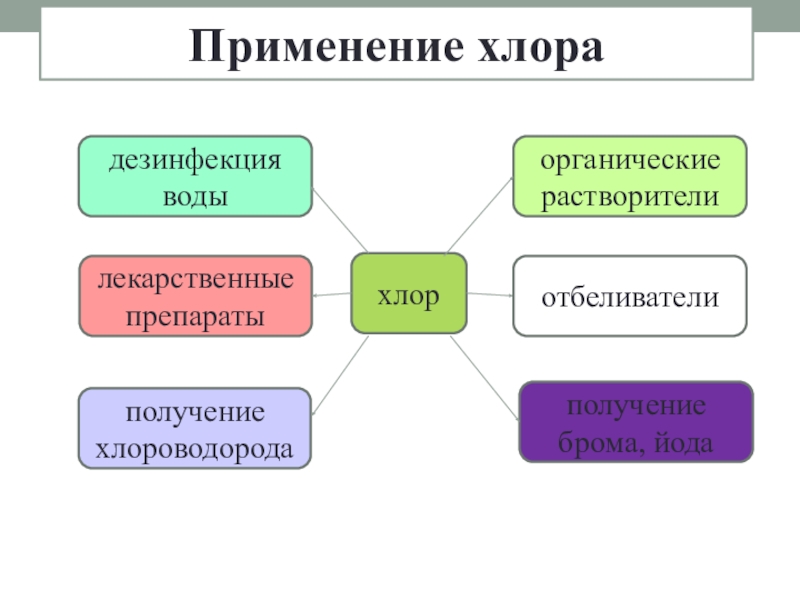
- 18. Применение хлорахлордезинфекция водылекарственные препаратыполучение хлороводородаорганические растворителиотбеливателиполучение брома, йода
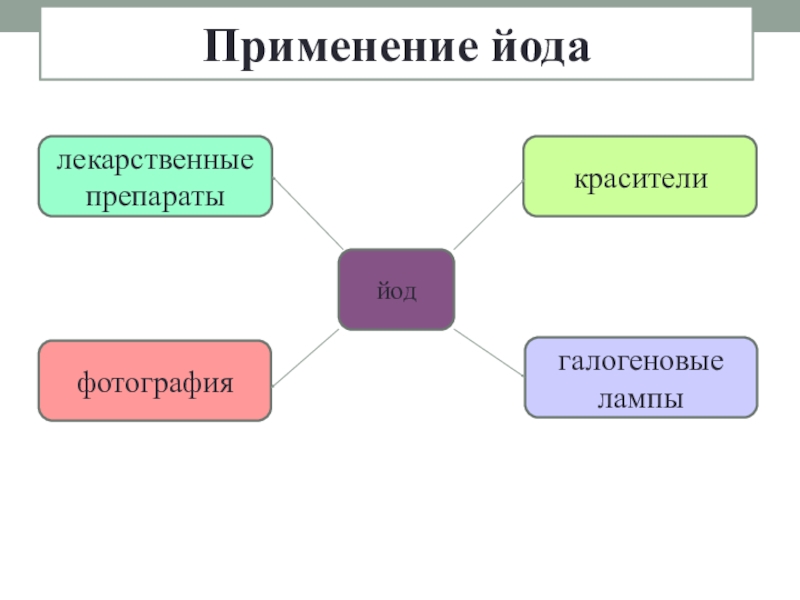
- 19. Применение йодайодлекарственные препаратыфотографиягалогеновые лампыкрасители
Слайд 1Галогены
Выполнила:
учитель химии МАОУ СОШ №27
г. Балаково Саратовской области
Карташова Людмила Александровна
Слайд 3Общая характеристика
+9 ) )
2 7
F
Cl
+17 ) ) )
2 8 7
Br
+35 ) ) ) )
2 8 18 7
I
+53 ) ) ) ) )
2 8 18 18 7
1. Увеличивается заряд ядра;
2. Увеличивается число энергетических уровней;
3. Увеличивается радиус атома;
4. Уменьшается притяжение
к ядру внешних е;
5. Неметаллические свойства ослабевают, металлические усиливаются
6. Уменьшается электроотрицательность
7. Увеличивается сила галогеноводородных кислот
8. Уменьшается кислотный характер высших оксидов
Слайд 5 В 1886 году французский
Анри Муассан
(1852 – 1907 г.)
2HF→H2↑ + F2↑
История открытия фтора
Слайд 6 В 1774 году шведский аптекарь К.
В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу название хлор.
Карл Вильгельм Шееле
(1742 – 1786 г.)
MnO2+ 4HCl Cl2+ MnCl2 + 2H2O
История открытия хлора
Слайд 7 В 1825 году французский химик А.Ж.Балар
Антуан Жером Балар
(1802 – 1876 г.)
2NaBr + Cl2 → 2NaCl + Br2
История открытия брома
Слайд 8 В 1811 году французский химик Бернар
В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров).
Бернар Куртуа (1777 – 1838 г. )
2 NaI + 2 H2SO4 = I2 + SO2 + Na2 SO4 + 2H2O
История открытия йода
Слайд 9Галогены – типичные окислители. Наибольшей химической активностью обладает фтор, это сильнейший
Химические свойства
галогены
сложные вещества
неметаллы
металлы
Слайд 10С металлами
Все галогены взаимодействуют практически со всеми простыми веществами, наиболее энергично
I2+2Cu=2CuI
2Fe+3Cl2=2FeCl3
В результате взаимодействия образуются галогениды, которые являются солями.
Химические свойства
Слайд 11С водородом
Все галогены взаимодействуют с водородом с образованием галогеноводородов:
H2+Hal2=2HHal
При обычных условиях фтор
H2+F2→2HF+Q
взаимодействие с хлором протекает на свету:
H2+Cl2→2HCl
бром и йод реагируют только при нагревании:
H2+Br2→2HBr
причем реакция с йодом обратима:
H2+I2↔2HI
Химические свойства
Слайд 12С неметаллами
С кислородом и азотом галогены непосредственно не взаимодействуют:
Hal2+O2≠
Реагируют с серой,
2P+3Cl2=2PCl3
Si+2F2=SiF4
Cl2+S→SCl2
Химические свойства
Слайд 13Взаимодействие со щелочами.
Также галогены диспропорционируют в растворах щелочей:
на холоде:
Cl2+2KOH=KClO+KCl+H2O образуется хлорид и
при нагревании:
3Cl2+6KOH→KClO3+5KCl+3H2O образуется хлорид и хлорат
Химические свойства
Слайд 14
Взаимодействие с соединениями других неметаллов:
Галогены способны отнимать водород от других веществ:
H2S+Br2=S+2HBr
Реакционная способность
2KI+Br2=2KBr+I2
2HBr+Cl2=2HCl+Br2
Химические свойства
Слайд 16AgNO3 + MeCl = AgCl↓ + MeNO3
AgNO3 + MeBr = AgBr↓ + MeNO3
кремовый
AgNO3 + MeI = AgI↓ + MeNO3
жёлтый
AgNO3 + MeF = AgF + MeNO3
нет осадка
Определение галогенид-ионов