г этого вещества образуется 39,2 л углекислого газа (н. у.) и 36 г воды. Выведите молекулярную формулу органического соединения
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Фенол (10 класс)
Содержание
- 1. Презентация по химии Фенол (10 класс)
- 2. Фенол
- 3. Фенолы – гидроксилпроизводные ароматических углеводородов, в которых группа ОН связана с атомом углерода ароматического ядра.
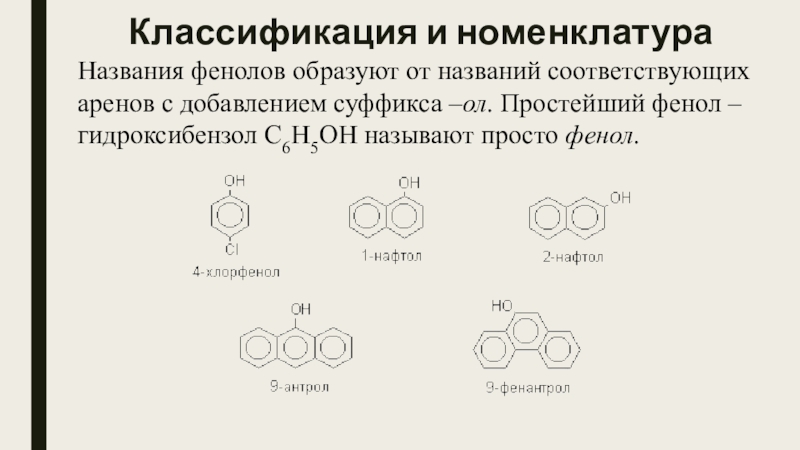
- 4. Классификация и номенклатураНазвания фенолов образуют от названий соответствующих
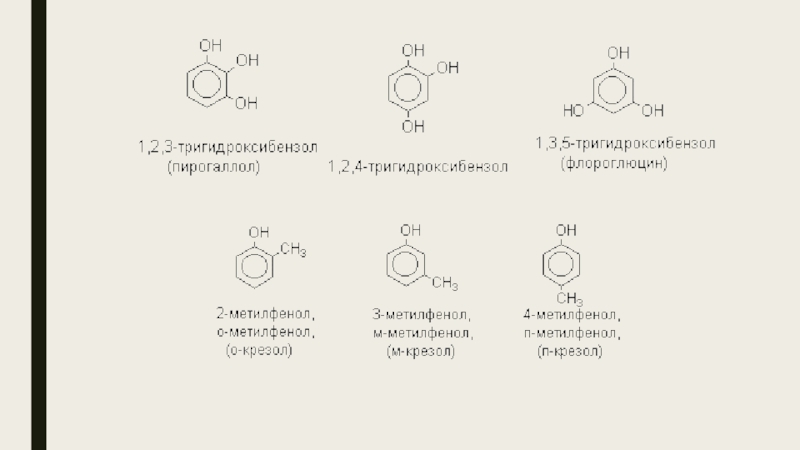
- 5. Слайд 5
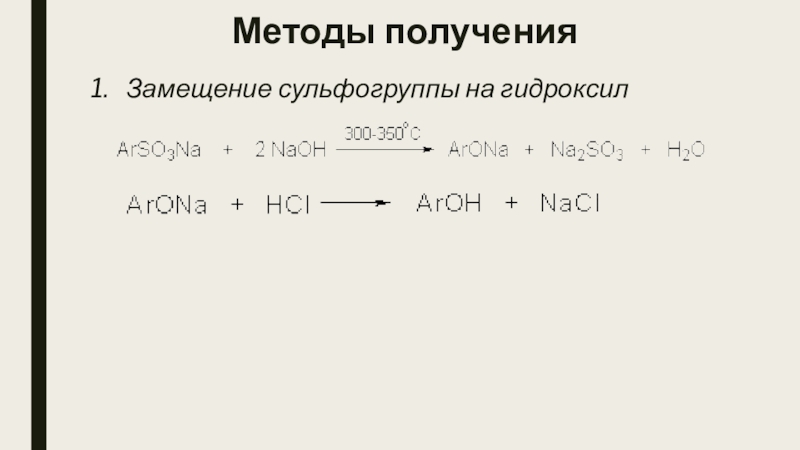
- 6. Методы полученияЗамещение сульфогруппы на гидроксил
- 7. 2. Замещение галогена на гидроксилC6H5Cl + 2NaOH ® C6H5O-Na+
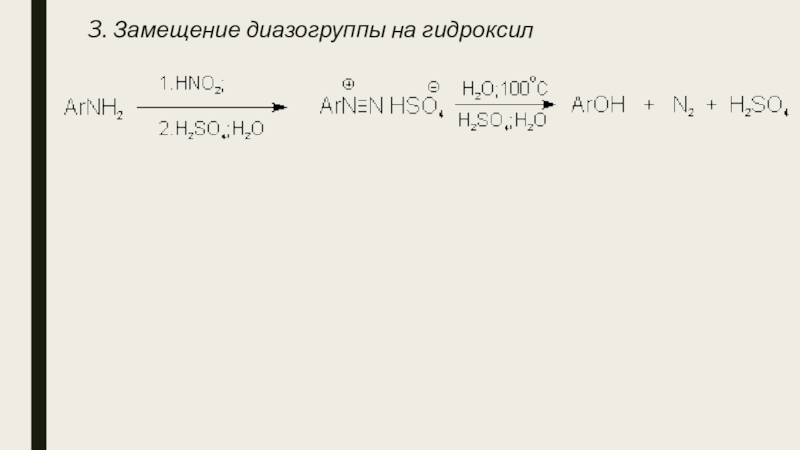
- 8. 3. Замещение диазогруппы на гидроксил
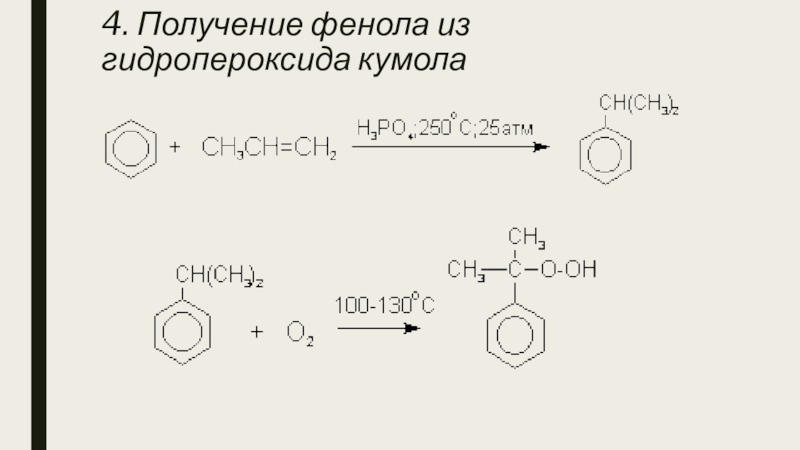
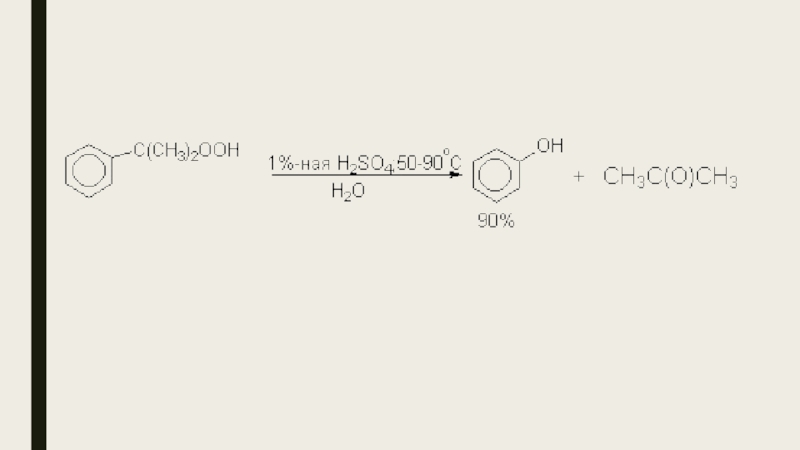
- 9. 4. Получение фенола из гидропероксида кумола
- 10. Слайд 10
- 11. Физические свойства и строениеФенолы – жидкие или кристаллические
- 12. Химические свойства 1. Кислотные свойства Фенолы являлются слабыми
- 13. Получение простых и сложных эфиров феноловСложные эфиры
- 14. Феноляты легко алкилируются , алкилгалогенидами и диалкилсульфатами
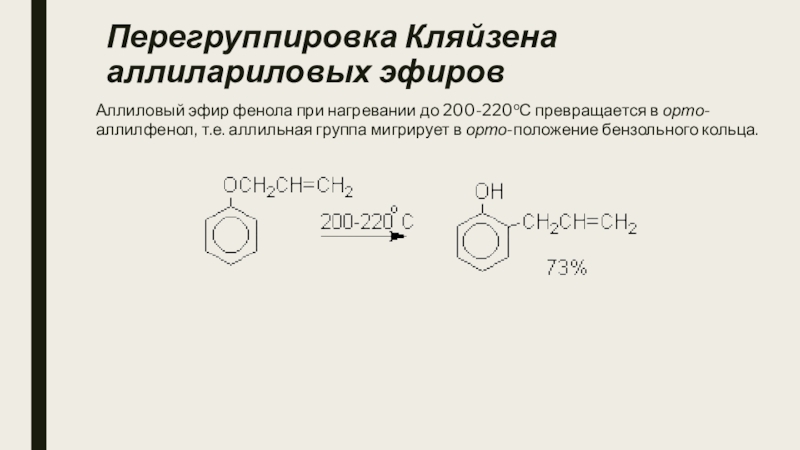
- 15. Перегруппировка Кляйзена аллилариловых эфировАллиловый эфир фенола при
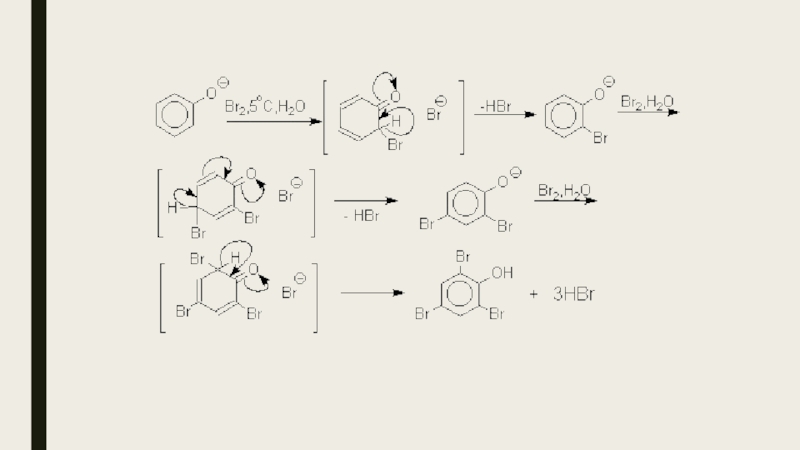
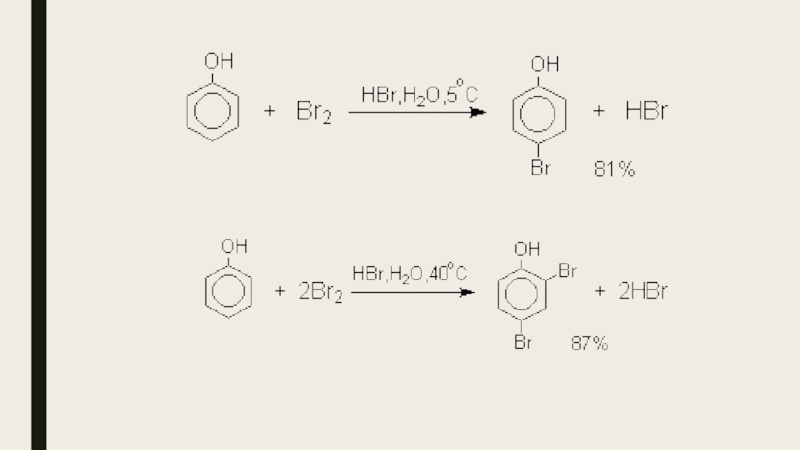
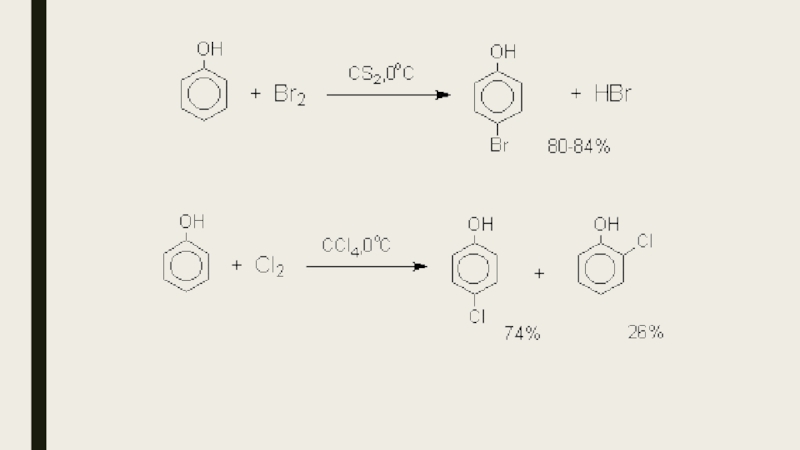
- 16. Реакции электрофильного замещения в ароматическом кольцеГалогенированиеГалогенирование фенолов
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
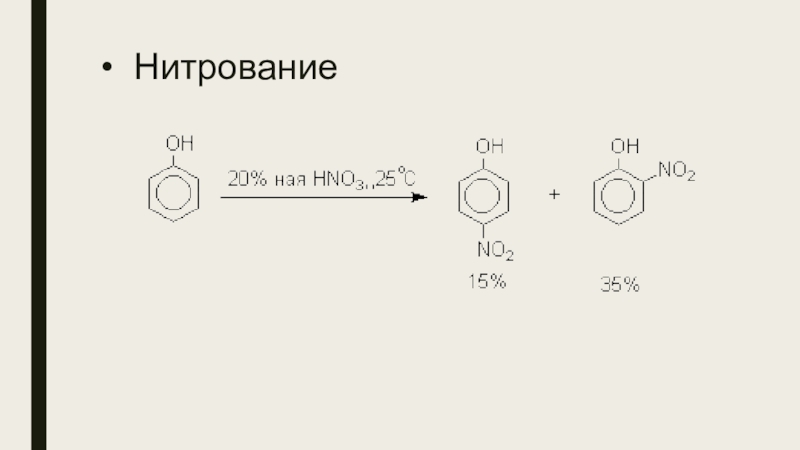
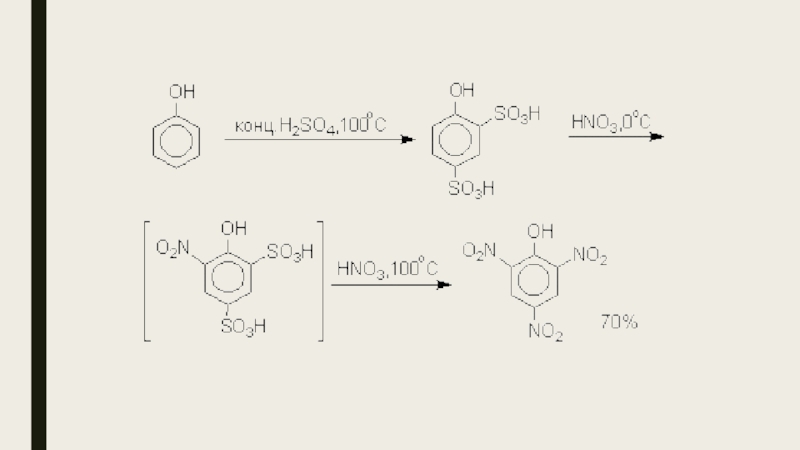
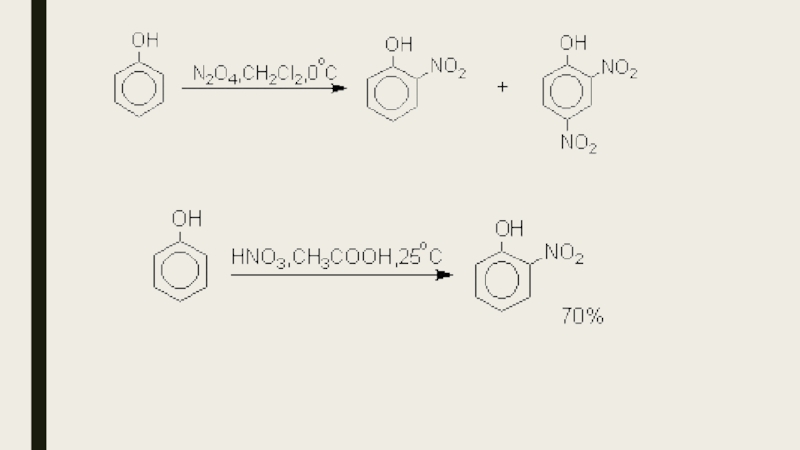
- 20. Нитрование
- 21. Слайд 21
- 22. Слайд 22
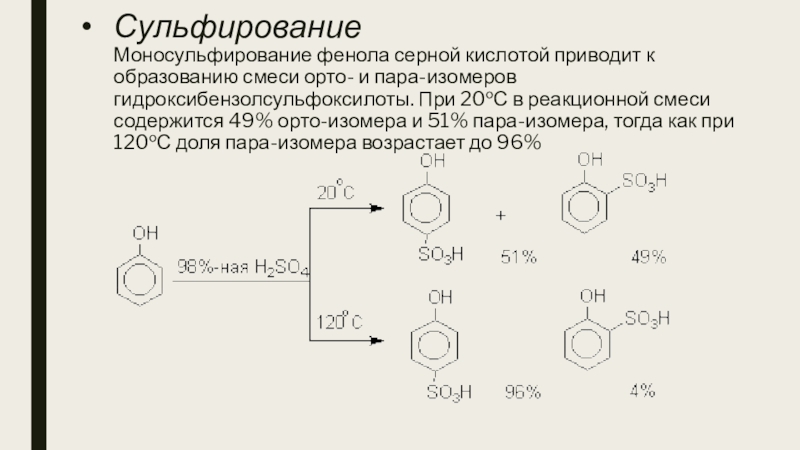
- 23. Сульфирование Моносульфирование фенола серной кислотой приводит
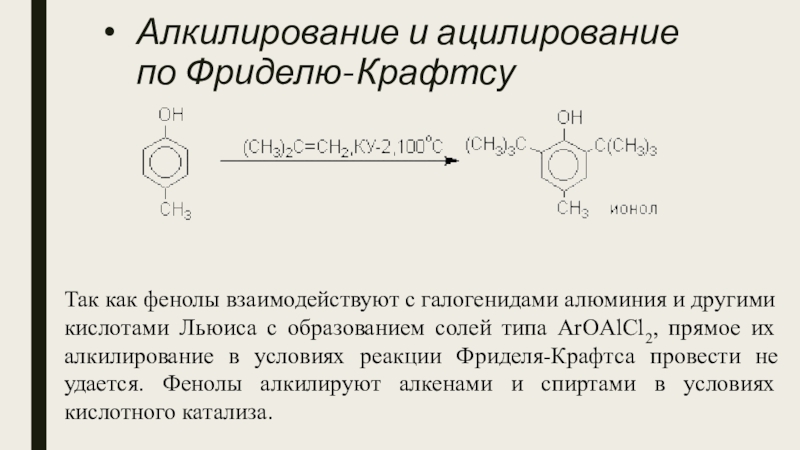
- 24. Алкилирование и ацилирование по Фриделю-КрафтсуТак как фенолы
- 25. Слайд 25
Фенол
Слайд 1Относительная плотность паров органического соединения по кислороду равна 3,625.11ри сжигании 29
Слайд 3Фенолы – гидроксилпроизводные ароматических углеводородов, в которых группа ОН связана с
атомом углерода ароматического ядра.
Слайд 4Классификация и номенклатура
Названия фенолов образуют от названий соответствующих аренов с добавлением суффикса –ол.
Простейший фенол – гидроксибензол С6Н5ОН называют просто фенол.
Слайд 72. Замещение галогена на гидроксил
C6H5Cl + 2NaOH ® C6H5O-Na+ + NaCl + H2O
C6H5O-Na+
+ HCl ® C6H5OH + NaCl
Применение солей меди (II) позволяет проводить региоселективное замещение галогена на гидроксил без примеси какого-либо другого изомерного фенола.
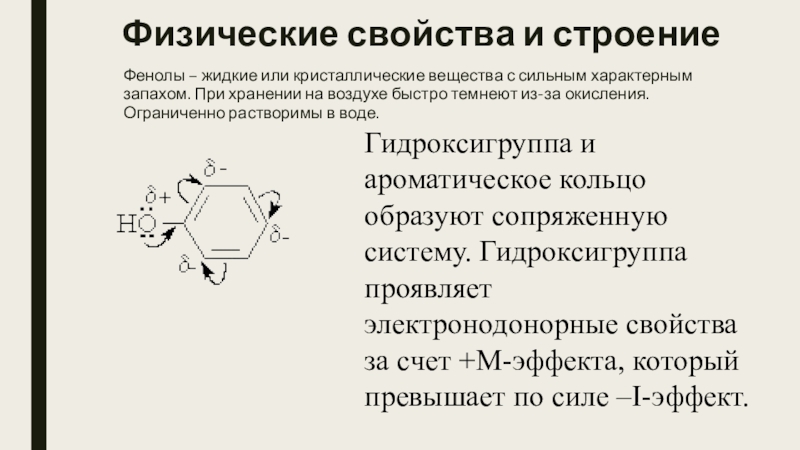
Слайд 11Физические свойства и строение
Фенолы – жидкие или кристаллические вещества с сильным характерным
запахом. При хранении на воздухе быстро темнеют из-за окисления. Ограниченно растворимы в воде.
Гидроксигруппа и ароматическое кольцо образуют сопряженную систему. Гидроксигруппа проявляет электронодонорные свойства за счет +М-эффекта, который превышает по силе –I-эффект.
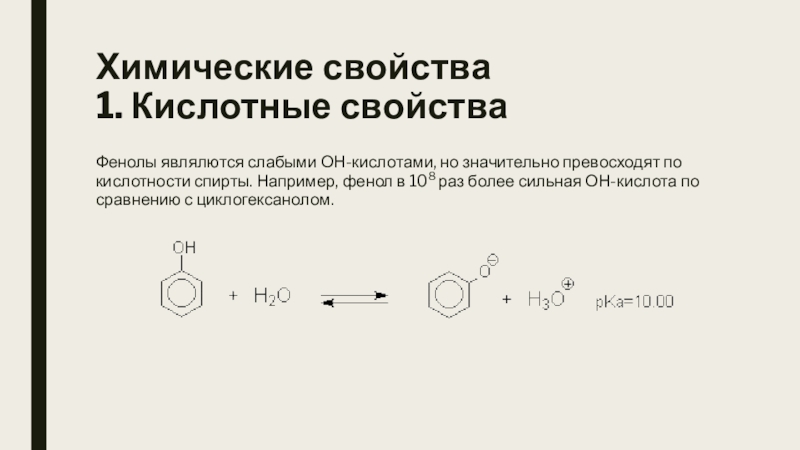
Слайд 12Химические свойства
1. Кислотные свойства
Фенолы являлются слабыми ОН-кислотами, но значительно превосходят по
кислотности спирты. Например, фенол в 108 раз более сильная ОН-кислота по сравнению с циклогексанолом.
Слайд 13Получение простых и сложных эфиров фенолов
Сложные эфиры получают ацилированием фенолов или
их
Na-и K-солей галогенангидридами или ангидридами кислот.
ArOH + RCOX ® RCOOAr + HX
ArO-Na+ + RCOX ® RCOOAr + NaX
(X=Cl, OCOR)
Na-и K-солей галогенангидридами или ангидридами кислот.
ArOH + RCOX ® RCOOAr + HX
ArO-Na+ + RCOX ® RCOOAr + NaX
(X=Cl, OCOR)
Слайд 14Феноляты легко алкилируются , алкилгалогенидами и диалкилсульфатами с образованием простых эфиров.
ArO-Na+ +
RX ® ArOR + NaX
(X=Hal, ROSO3)
Метиловые эфиры фенолов получают также действием диазометана в эфирном растворе.
ArOH + CH2N2 ® AROCH3 + N2
(X=Hal, ROSO3)
Метиловые эфиры фенолов получают также действием диазометана в эфирном растворе.
ArOH + CH2N2 ® AROCH3 + N2
Слайд 15Перегруппировка Кляйзена аллилариловых эфиров
Аллиловый эфир фенола при нагревании до 200-220оС превращается
в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца.
Слайд 16Реакции электрофильного замещения в ароматическом кольце
Галогенирование
Галогенирование фенолов не требует катализа кислотами
Льюиса и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион, который содержит очень сильную активирующую группу –O-. Скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем сам фенол, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.
Слайд 23Сульфирование Моносульфирование фенола серной кислотой приводит к образованию смеси орто- и
пара-изомеров гидроксибензолсульфоксилоты. При 20оС в реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при 120оС доля пара-изомера возрастает до 96%
Слайд 24Алкилирование и ацилирование по Фриделю-Крафтсу
Так как фенолы взаимодействуют с галогенидами алюминия
и другими кислотами Льюиса с образованием солей типа ArOAlCl2, прямое их алкилирование в условиях реакции Фриделя-Крафтса провести не удается. Фенолы алкилируют алкенами и спиртами в условиях кислотного катализа.