- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии для 9 класса Гидролиз солей
Содержание
- 1. Презентация по химии для 9 класса Гидролиз солей
- 2. «ГИДРОЛИЗ СОЛЕЙ»
- 3. Слайд 3
- 4. Ход урока: 1) Организационный момент, психологический настрой
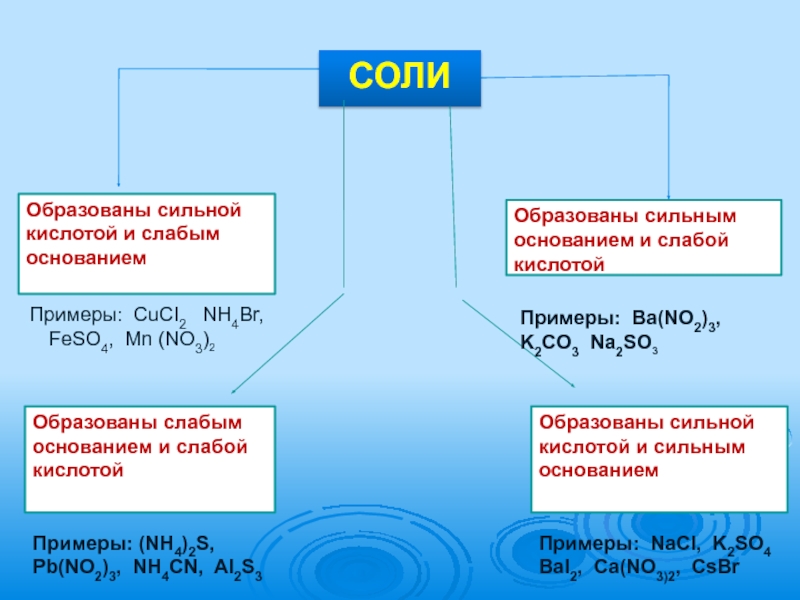
- 5. СОЛИОбразованы сильной кислотой и слабым основаниемПримеры: CuCI2
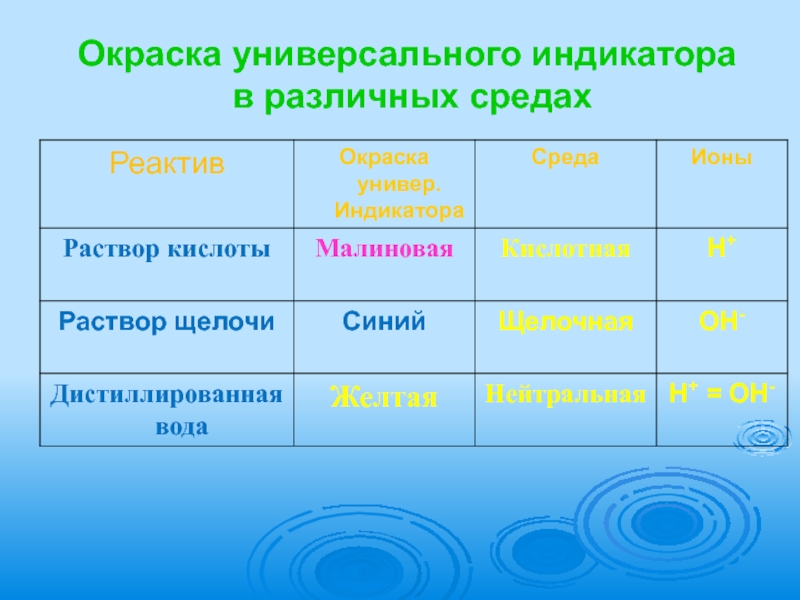
- 6. Окраска универсального индикатора в различных средах
- 7. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
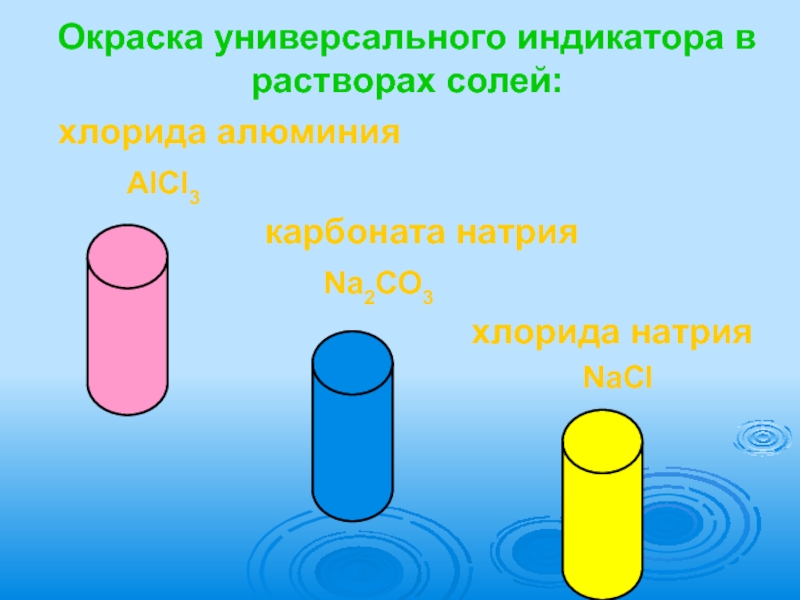
- 8. Окраска универсального индикатора в растворах солей:хлорида алюминия
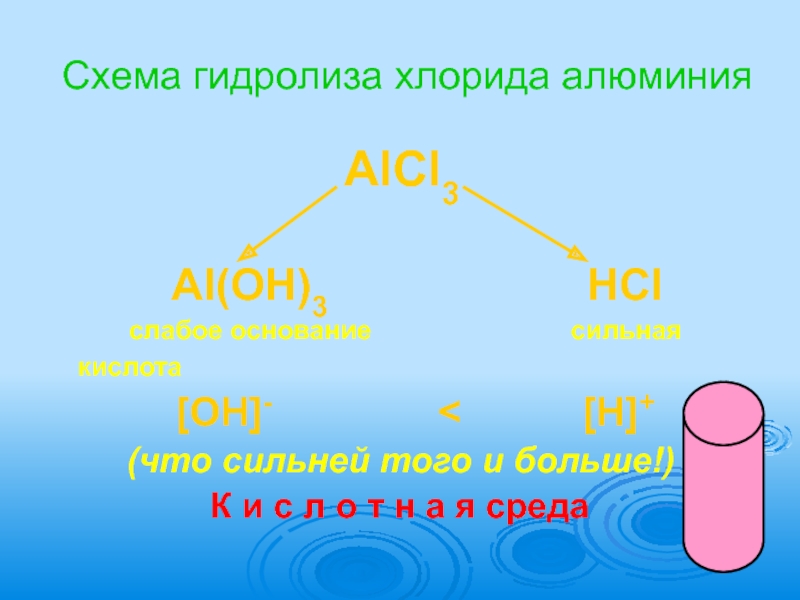
- 9. Схема гидролиза хлорида алюминия
- 10. Механизм гидролиза хлорида алюминия AlCl3
- 11. Al3+ + HOH AlOH2+ + H+
- 12. Схема гидролиза карбоната натрияNa2CO3
- 13. Механизм гидролиза карбоната натрияNa2CO3
- 14. CO32- +HOH HCO3- +OH- Na2CO3 +H2O
- 15. Схема гидролиза хлорида натрияNaCl
- 16. Механизм гидролиза хлорида натрияNaСl
- 17. ГИДРОЛИЗ – это
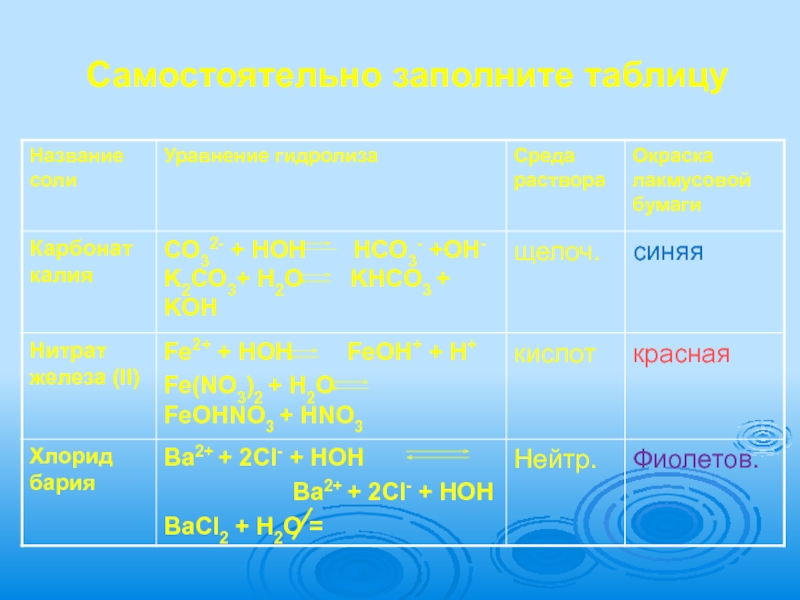
- 18. Самостоятельно заполните таблицу
- 19. Самостоятельно заполните таблицу
- 20. Роль гидролиза в природеПреобразование земной коры Обеспечение слабощелочной среды морской воды
- 21. Роль гидролиза в народном хозяйствеПорча производственного оборудованияВыработка
- 22. Роль гидролиза в повседневной жизни человека СтиркаМытье посудыУмывание с мыломПроцессы пищеварения
- 23. Закрепление знаний:1. Исключите лишнее:а) NaCl, K2SO4, K2SO3,
- 24. Взаимопроверка: 1
- 25. Домашнее задание:§10. А (1,2). B (1,3). С
Слайд 1Хромтауская средняя школа № 4
учитель химии и
Фоминых Л. П.
Стаж – 31 год
Категория – первая
Проблема:
«Использование инновационных
технологий и элементов
дифференцированного обучения на уроках химии и биологии»
Слайд 3 Цель урока: 1) Сформировать у учащихся понятие «гидролиз солей» Задачи урока: Образовательные: 1.Сформировать у
Слайд 4Ход урока:
1) Организационный момент, психологический настрой
2) Подготовка к изучению
(метод «ЗХУ»)
3) Изучение нового материала
а) работа в группах
б) «Проверь себя»
в) значение гидролиза (индивидуальные сообщения учащихся)
4)физминутка
5) Закрепление и применение знаний и умений
6) Подведение итогов урока
7) (Рефлексия)
8) Домашнее задание
Слайд 5СОЛИ
Образованы сильной кислотой и слабым основанием
Примеры: CuCI2 NH4Br, FeSO4, Mn
Образованы сильным основанием и слабой кислотой
СОЛИ
Образованы слабым основанием и слабой кислотой
Примеры: (NH4)2S, Pb(NO2)3, NH4CN, AI2S3
Образованы сильной кислотой и сильным основанием
Примеры: NaCI, K2SO4 BaI2, Ca(NO3)2, CsBr
Примеры: Ba(NO2)3, K2CO3 Na2SO3
Слайд 8Окраска универсального индикатора в растворах солей:
хлорида алюминия
карбоната натрия
Na2CO3
хлорида натрия
NaCl
Слайд 9Схема гидролиза хлорида алюминия
Al(OH)3 HCl
слабое основание сильная кислота
[OH]- < [H]+
(что сильней того и больше!)
К и с л о т н а я среда
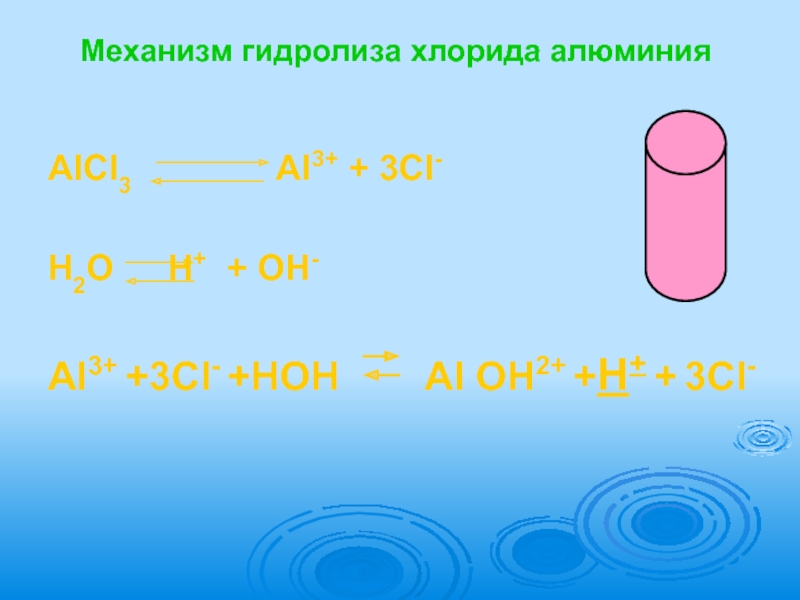
Слайд 10Механизм гидролиза хлорида алюминия
AlCl3 Al3+ +
H2O H+ + OH-
Al3+ +3Cl- +HOH Al OH2+ +H+ + 3Cl-
Слайд 11Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O
Сформулируем вывод:
Раствор соли, образованной
________________, имеет _____________реакцию, так как в растворе избыток___________________.
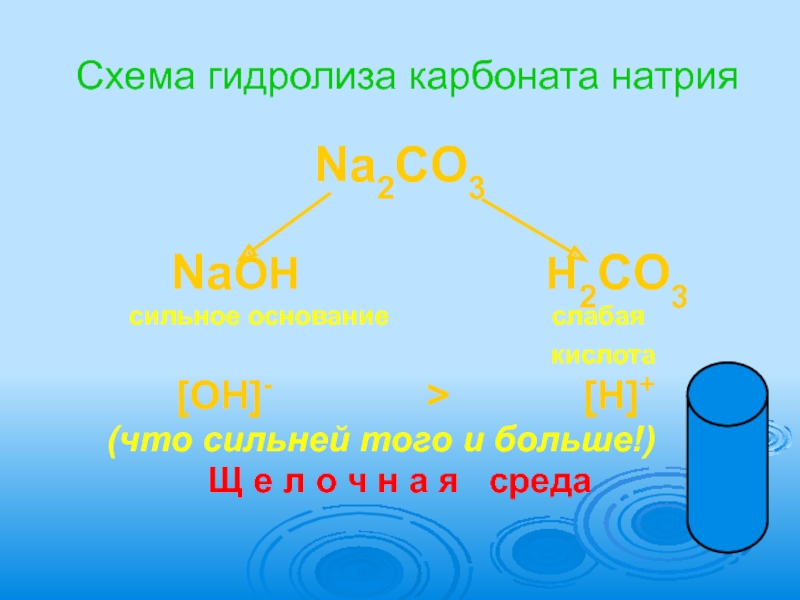
Слайд 12Схема гидролиза карбоната натрия
Na2CO3
NaOH
сильное основание слабая
кислота
[OH]- > [H]+
(что сильней того и больше!)
Щ е л о ч н а я среда
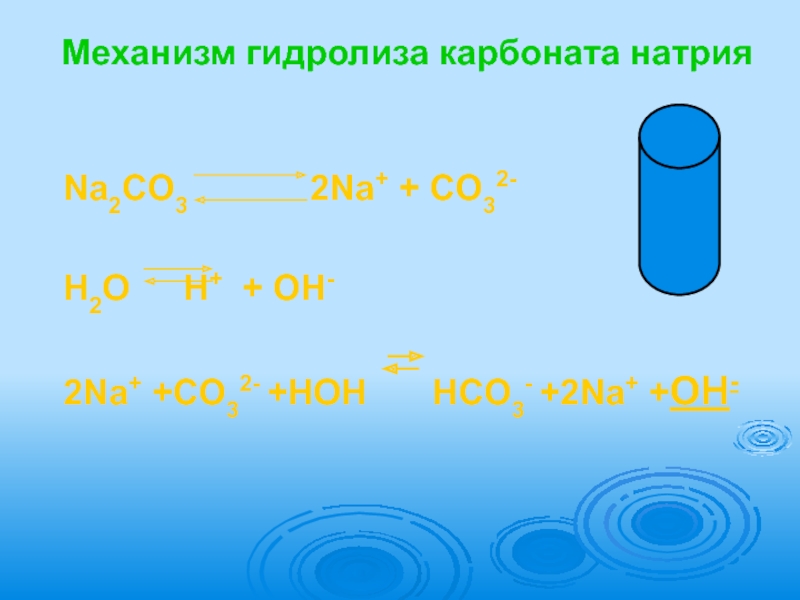
Слайд 13Механизм гидролиза карбоната натрия
Na2CO3
H2O H+ + OH-
2Na+ +CO32- +HOH HCO3- +2Na+ +OH-
Слайд 14CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов
Сформулируем вывод:
Раствор соли, образованной
________________, имеет__________реакцию, так как в растворе избыток ________________.
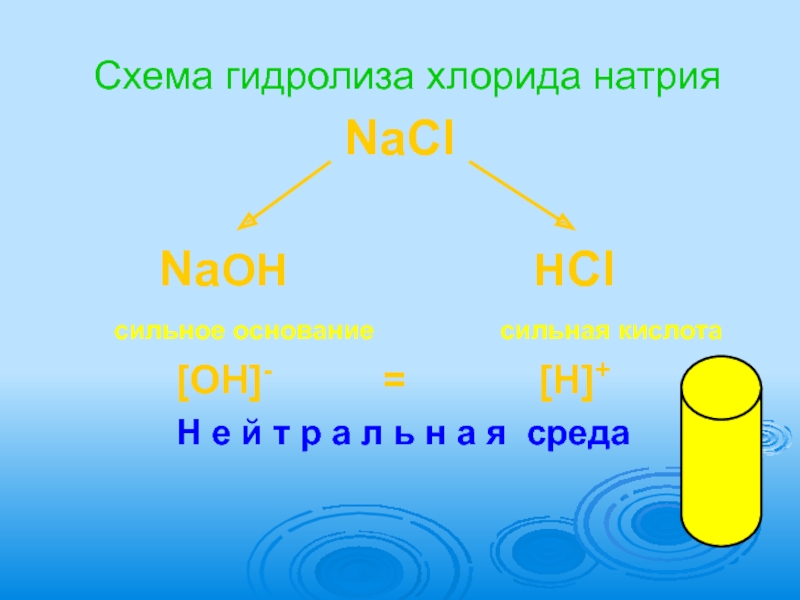
Слайд 15Схема гидролиза хлорида натрия
NaCl
сильное основание сильная кислота
[OH]- = [H]+
Н е й т р а л ь н а я среда
Слайд 16Механизм гидролиза хлорида натрия
NaСl Na+ + Cl-
H2O H+
Na+ +Cl- +HOH Cl- + Na+ + HOH
Сформулируем вывод:
Раствор соли, образованной
________________, имеет__________реакцию, так как в растворе ________________.
Слайд 17
ГИДРОЛИЗ –
это реакция обмена между
Слайд 20Роль гидролиза в природе
Преобразование земной коры
Обеспечение слабощелочной среды морской воды
Слайд 21Роль гидролиза в народном хозяйстве
Порча производственного оборудования
Выработка из непищевого сырья ценных
Очистка промышленных стоков и питьевой воды
(сульфат алюминия + вода - гидроксид алюминия)
Подготовка тканей к окрашиванию
Известкование почв основано на гидролизе
Слайд 22Роль гидролиза
в повседневной жизни человека
Стирка
Мытье посуды
Умывание с мылом
Процессы пищеварения
Слайд 23Закрепление знаний:
1. Исключите лишнее:
а) NaCl, K2SO4, K2SO3, NaNO3
б) Al(NO3)3, FeCl2, Zn
в) Na2S, K2CO3, BaCl2, Na2SiO3
2. Гидролиз солей – это:
А) реакция обмена соли с водой; Б) растворение соли в воде;
В) диссоциация соли в воде.
3. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы; Б) в образовании слабого электролита;
В) в образовании сильных электролитов.
4. Раствор соли магния МgCl2 имеет
А) кислую среду; Б) щелочную среду;
В) нейтральную среду.
Слайд 24 Взаимопроверка: 1 а) K2SO3, б) LiCl в) BaCl2,
Слайд 25Домашнее задание:
§10. А (1,2). B (1,3). С (1 вариант).
Исследовательское задание:
Изготовить растительный
1. Что называется гидролизом?
2. Какие соли подвергаются гидролизу?
3. От чего зависит реакция среды раствора соли?
Подведение итогов урока: