- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Азотная кислота
Содержание
- 1. Презентация по химии Азотная кислота
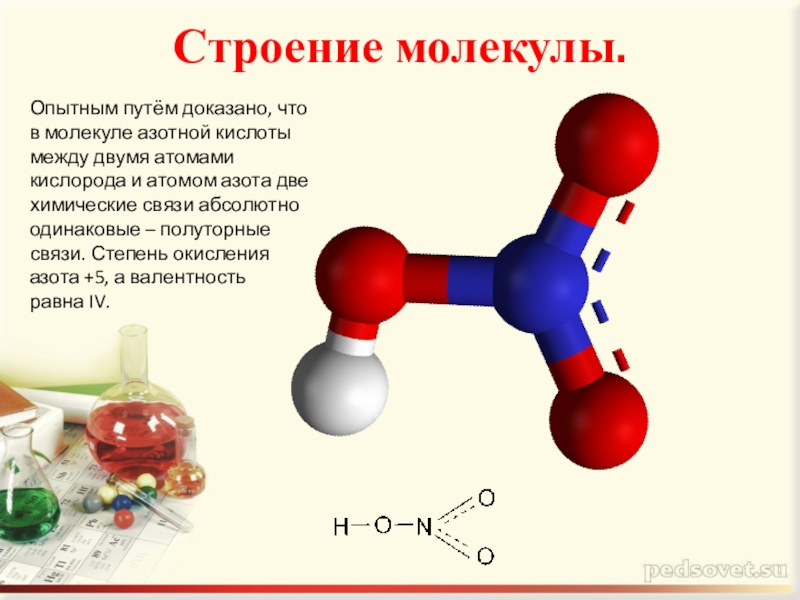
- 2. Строение молекулы. Опытным путём доказано, что в
- 3. Физические свойстваАзотная кислота HNO3 в чистом виде - бесцветная
- 4. Техника безопасностиАзотная кислота окисляет многие органические вещества.
- 5. Получение1. Лабораторный способ
- 6. Применениев производстве минеральных удобрений;в военной промышленности;в фотографии —
- 7. ТЕСТ№1. Степень окисления атома азота в молекуле
- 8. №4. Установите соответствие между исходными веществами и
- 9. Химические свойства азотной кислоты
- 10. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ Азотная кислота -
- 11. 3. Реагирует с металлами.При взаимодействии с металлами
- 12. Слайд 12
- 13. Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет
- 14. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ№1. Осуществите превращения по схеме,
- 15. №3. Напишите уравнения реакций взаимодействия азотной кислоты
Слайд 2Строение молекулы.
Опытным путём доказано, что в молекуле азотной кислоты между двумя
Слайд 3Физические свойства
Азотная кислота HNO3 в чистом виде - бесцветная жидкость с резким удушливым
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
Под действием света азотная кислота
частично разлагается с выделением NО2 и
приобретает светло-бурый цвет:
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Слайд 4Техника безопасности
Азотная кислота окисляет многие органические вещества.
Бумага и ткани разрушаются
Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция).
Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Слайд 5Получение
1. Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при
2. Промышленный способ
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
Слайд 6Применение
в производстве минеральных удобрений;
в военной промышленности;
в фотографии — подкисление некоторых тонирующих растворов;
в
в производстве взрывчатых и отравляющих веществ
Слайд 7ТЕСТ
№1. Степень окисления атома азота в молекуле азотной кислоты
b. +3
c. +5
d. +2
№2. Атом азота в молекуле азотной кислоты имеет валентность равную -
a. II
b. V
c. IV
d. III
№3. Какими физическими свойствами характеризуют чистую азотную кислоту?
a. без цвета
b. не имеет запаха
c. имеет резкий раздражающий запах
d. дымящая жидкость
e. окрашена в жёлтый цвет
Слайд 8
№4. Установите соответствие между исходными веществами и продуктами реакции:
№5. Расставьте коэффициенты
NO2 + О2 + H2O ↔ HNO3
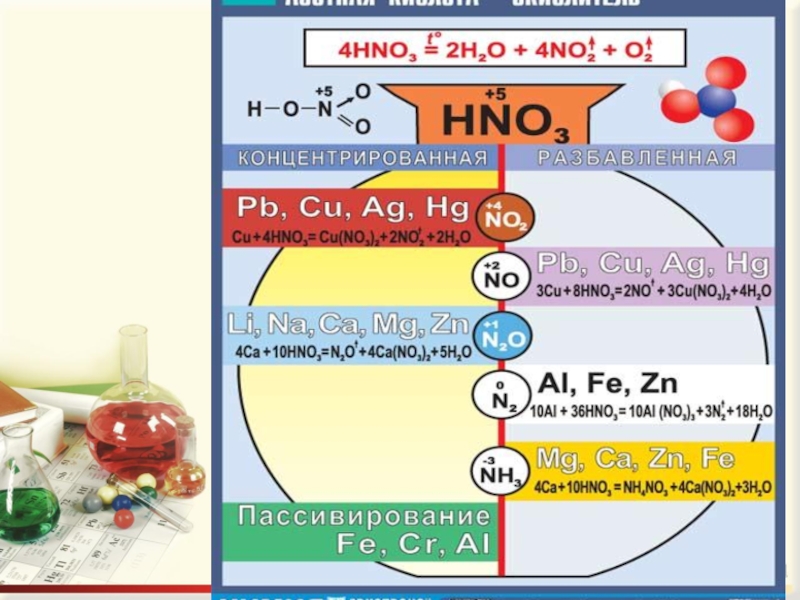
Слайд 10СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота - сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e-→N-3 окислитель, восстанавливается.
1. Разлагается
2. Окрашивает белки в оранжево-
желтый цвет (при попадании на кожу рук )
Слайд 11 3. Реагирует с металлами.
При взаимодействии с металлами никогда не выделяется водород
Слайд 13Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы. HNO3 + 4HCl + Au = H[AuCl4] +
4. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
Слайд 14ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществите превращения по схеме, назовите вещества, для УХР
NH4Cl**→ NH3* → N2 → NO → NO2 → HNO3 → NO2
№2. Осуществить превращения по схеме (внимательно посмотрите, куда направлены стрелки):
Соль аммония←Аммиак←Нитрид Лития ←Азот → Оксид азота (II)←Азотная кислота
Для ОВР составить электронный баланс, для РИО полные, ионные уравнения.
Слайд 15№3. Напишите уравнения реакций взаимодействия азотной кислоты со следующими веществами в
№4. Запишите уравнения, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
А) Сa + HNO3 (конц.)
Б) Сa + HNO3 (paзбавл.)










![Презентация по химии Азотная кислота Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы. HNO3 + 4HCl + Au = H[AuCl4] Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы. HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O 4HNO3 + 18HCl](/img/thumbs/9fabd8413ab34367555de73bd8c8ccd5-800x.jpg)







