- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Азот и его соединения 9 класс
Содержание
- 1. Презентация по химии Азот и его соединения 9 класс
- 2. План урока:Открытие азотаПоложение азота в периодической
- 3. Открытие азота12 сентября 1772 года — Даниель
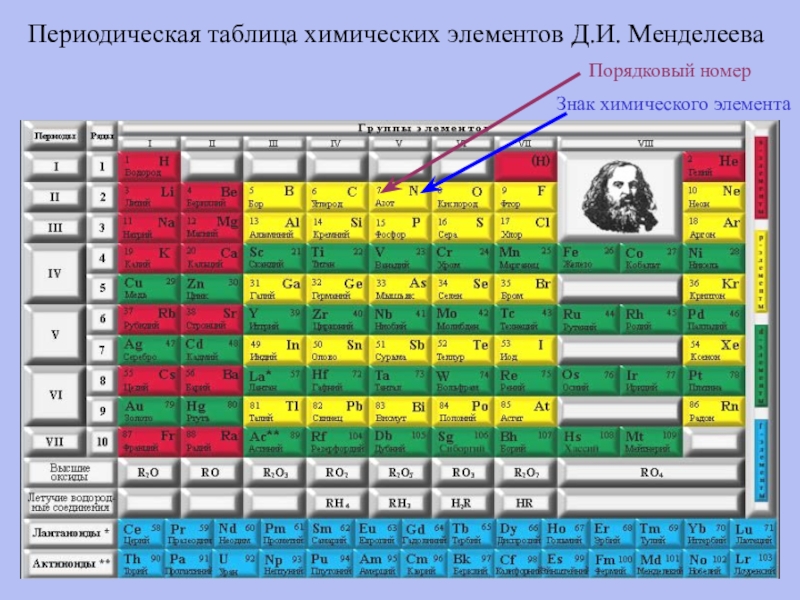
- 4. ММЦ 74212Периодическая таблица химических элементов Д.И. МенделееваПорядковый номерЗнак химического элемента
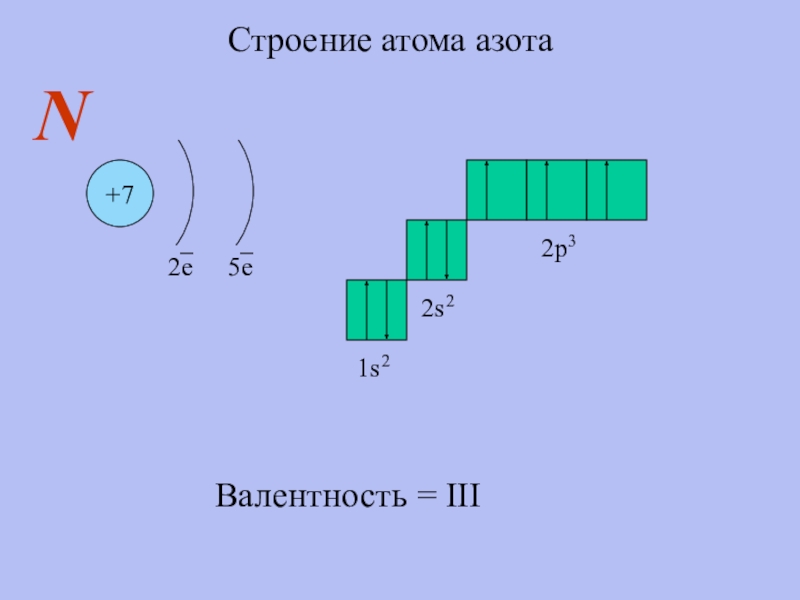
- 5. Строение атома азота+72е5еN1s22s22p3Валентность = III
- 6. Азот - простое веществоN2NNNNМолекулярная формулаЭлектронная формулаСтруктурная формулаковалентная
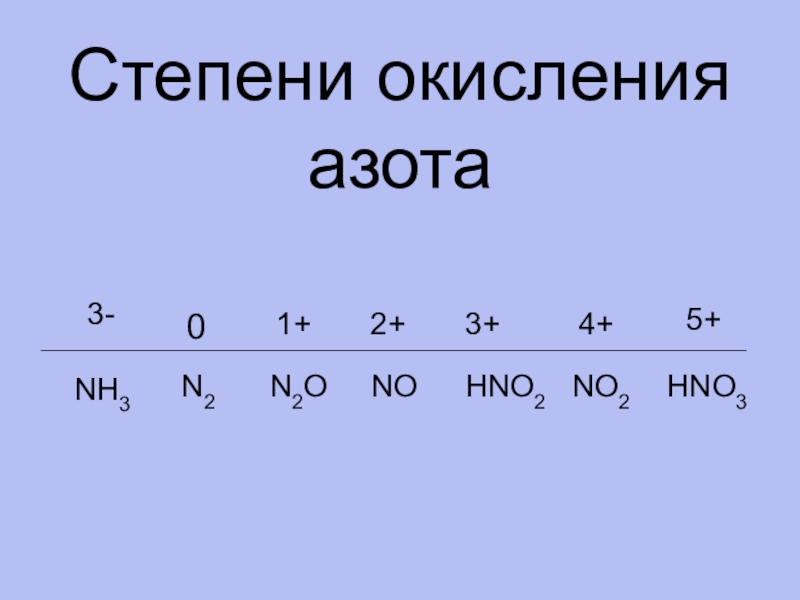
- 7. Степени окисления азота0N21+N2O3+NO2+HNO34+5+HNO2NO23-NH3
- 8. Химические свойства атома азотаОкислительные свойстваN0+3eN-3Ca3N2AlNH3N(аммиак)нитридыВосстановительные свойстваN - neN+4N+5N+2N+3N+1NO; N2O5; NF3
- 9. Химические свойства вещества азотаОкислительные свойстваВосстановительные свойства Взаимодействие
- 10. Задание:Расставьте степени окисления и дайте названия следующим соединениям азотаN2O3+3-2NO2-2+4Li3N+1-3Оксид азота (III)Оксид азота (IV)Нитрид лития
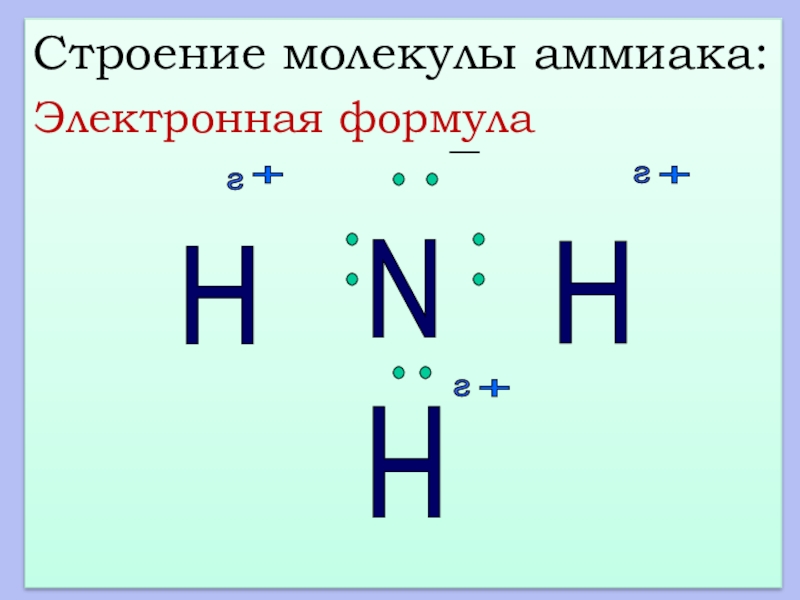
- 11. Строение молекулы аммиака:Молекулярная формулаNH3
- 12. Строение молекулы аммиака:Электронная формулаN H H H s s s + + + -
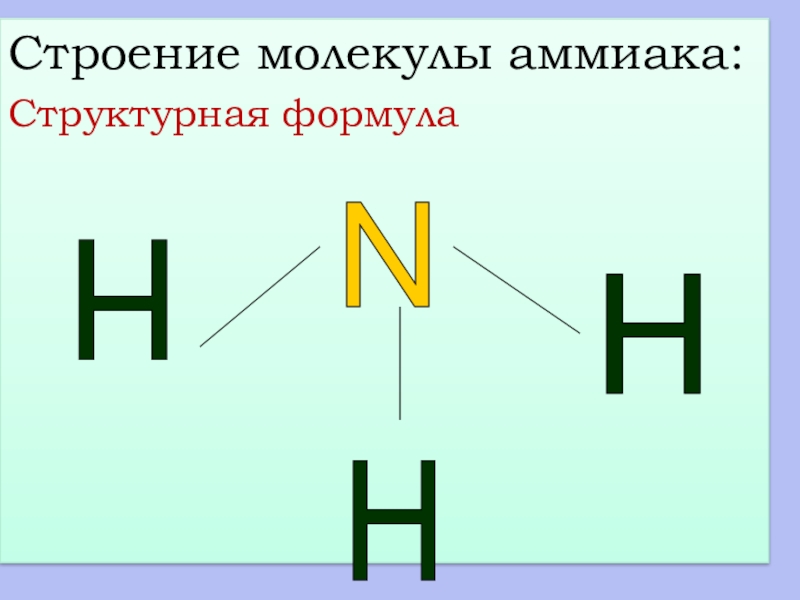
- 13. Строение молекулы аммиака:Структурная формула
- 14. Строение молекулы аммиака:Ковалентная полярная
- 15. Свойства физическиеЛегче воздухаХорошо растворим в водеH2ONH3Молекулярная кристаллическая решетка
- 16. Физические свойства аммиака Аммиак- бесцветный газ с
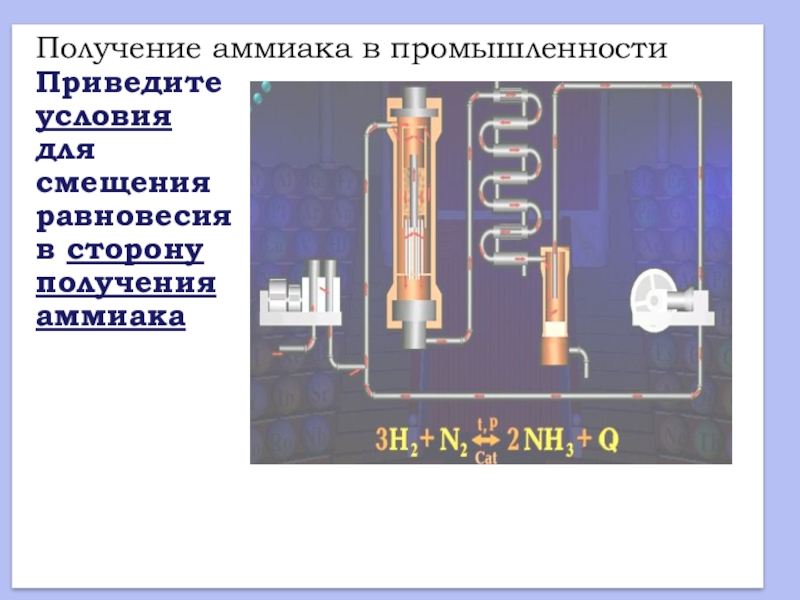
- 17. Получение аммиака в промышленностиПриведите условия длясмещения равновесия в сторону получения аммиака
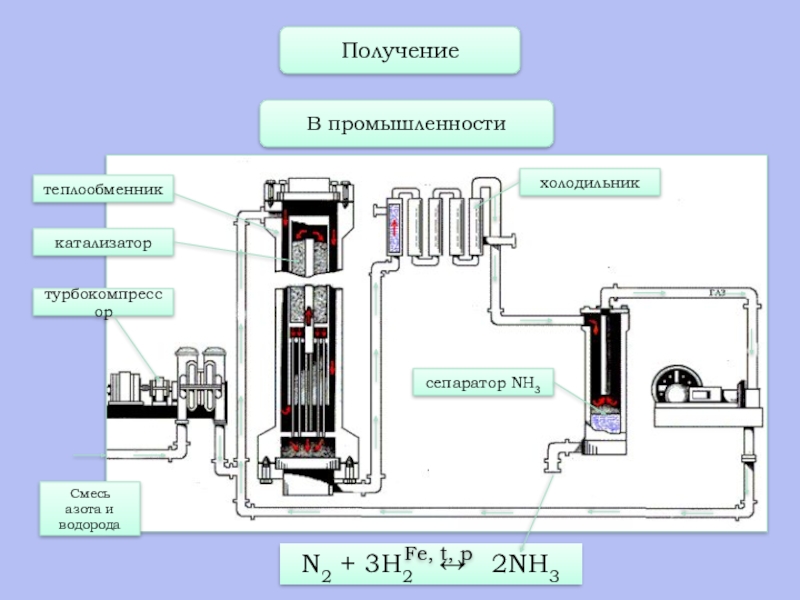
- 18. В промышленностиПолучениеСмесь азота и водородатурбокомпрессоркатализатортеплообменникхолодильниксепаратор NH3
- 19. Получение аммиака в лабораторииВ лабораторных условиях аммиак
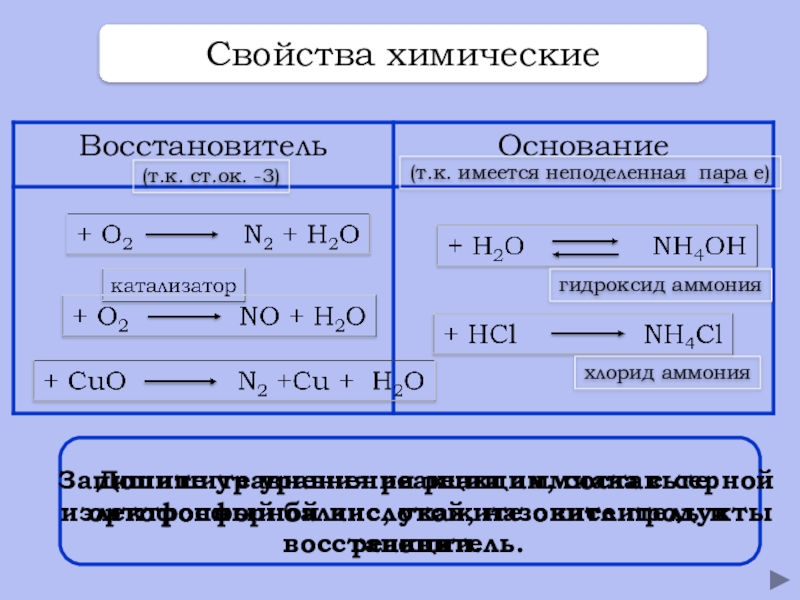
- 20. Свойства химические(т.к. ст.ок. -3)(т.к. имеется неподеленная пара
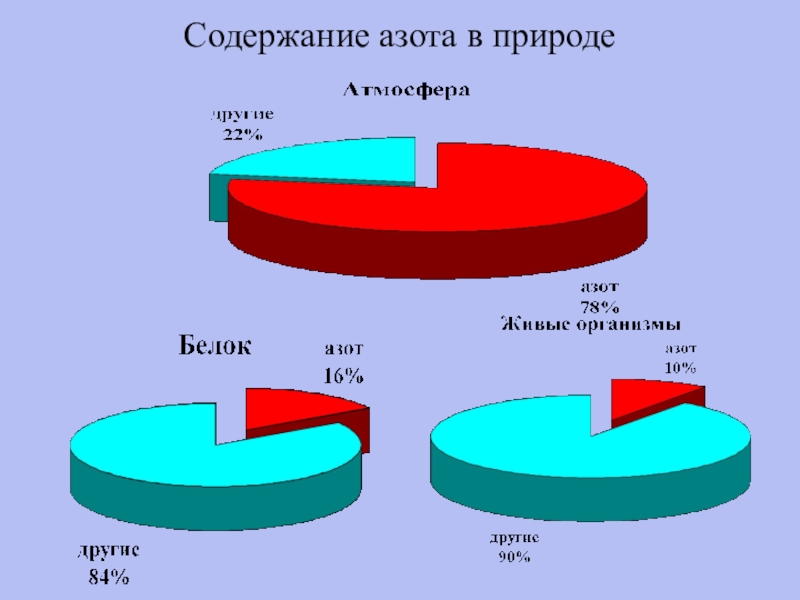
- 21. Содержание азота в природе
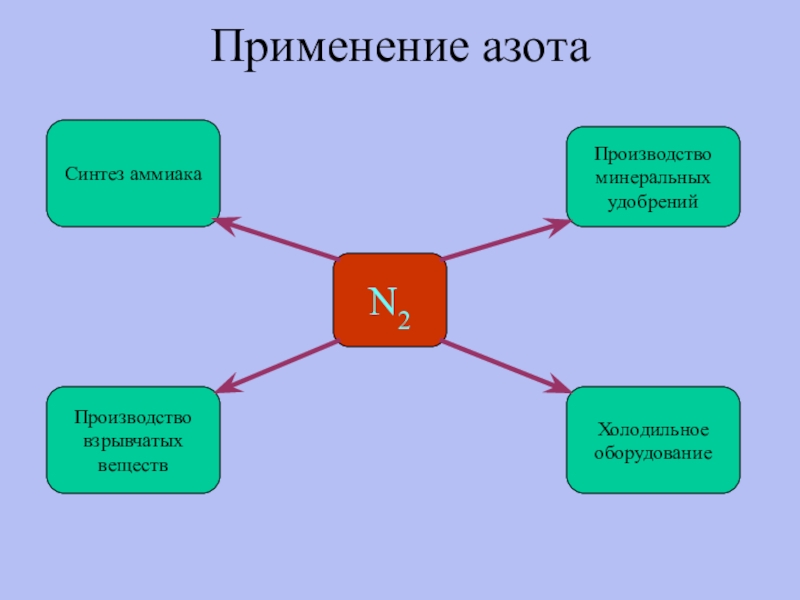
- 22. Применение азотаN2Синтез аммиакаХолодильноеоборудованиеПроизводствовзрывчатыхвеществПроизводствоминеральныхудобрений
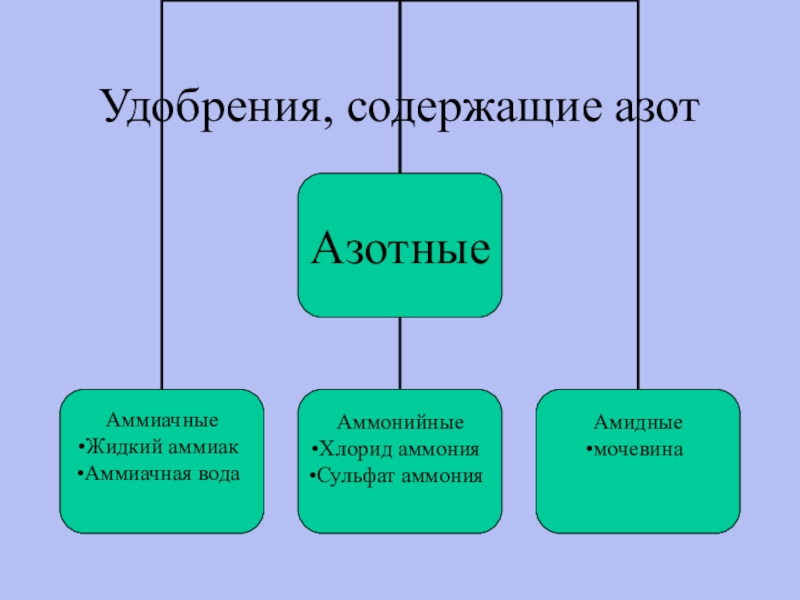
- 23. Удобрения, содержащие азот
- 24. Распределение площадей почв по природным зонам по области в тыс.га (по Г.Ф. Тараториной)
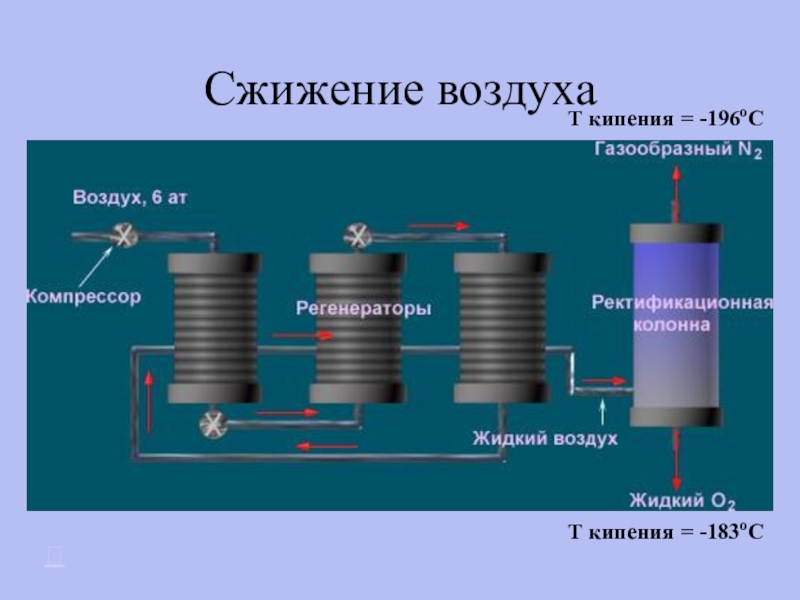
- 25. Получение азота Сжижение воздуха Взаимодействие нитрита натрия с хлоридом аммония
- 26. Сжижение воздухаT кипения = -196oCT кипения = -183oC
- 27. Реакция получения N2NaNO2нитритнатрия+NH3Clхлоридаммония=NaCl+N2?2H2O+
- 28. Тестовый контроль1. Степень окисления азота не может
- 29. ММЦ 74212Домашнее задание:§ 23, читать, записи в
- 30. ММЦ 74212Молодцы!
Слайд 2 План урока:
Открытие азота
Положение азота в периодической таблице
Строение атома азота
Азот
Химические свойства азота
Содержание азота в природе
Применение азота
Получение азота
Тестовый контроль
Слайд 3Открытие азота
12 сентября 1772 года — Даниель Резерфорд
1771 - 1773 гг.
1770 -1777 гг. — К. Шееле
1787 год — А. Лавуазье, Л. Гитоном де Морво и А. Фуркруа было предложено название «азот» (от греч., означающего безжизненный)
Антуан Лоран Лавуазье
Слайд 4ММЦ 74212
Периодическая таблица химических элементов Д.И. Менделеева
Порядковый номер
Знак химического элемента
Слайд 6Азот - простое вещество
N2
N
N
N
N
Молекулярная формула
Электронная формула
Структурная формула
ковалентная неполярная связь
Газ без цвета,
При t = -196oC жидкость
При t = -210oC белая снегообразная масса
Слайд 8Химические свойства атома азота
Окислительные свойства
N0+3e
N-3
Ca3N2
AlN
H3N
(аммиак)
нитриды
Восстановительные свойства
N - ne
N+4
N+5
N+2
N+3
N+1
NO; N2O5; NF3
Слайд 9Химические свойства вещества азота
Окислительные свойства
Восстановительные свойства
Взаимодействие с металлами (to, с
3Mg + N2 = Mg3N2 нитрид магния
0
0
+2
-3
в-ль
о-ль
Взаимодействие с водородом:
N2 + 3H2
2NH3 + Q
Kat.
в-ль
о-ль
аммиак
0
0
-3
+1
Взаимодействие с кислородом
N2 + O2
2NO - Q
3000 - 4000oС
0
0
-2
+2
о-ль
в-ль
Слайд 10Задание:
Расставьте степени окисления и дайте названия следующим соединениям азота
N2O3
+3
-2
NO2
-2
+4
Li3N
+1
-3
Оксид азота (III)
Оксид
Нитрид лития
Слайд 15Свойства физические
Легче воздуха
Хорошо растворим в воде
H2O
NH3
Молекулярная
кристаллическая
решетка
Слайд 16Физические свойства аммиака
Аммиак- бесцветный газ с резким запахом,
t
легче воздуха, хорошо растворим в воде(раствор аммиака в воде называется НАШАТЫРНЫМ СПИРТОМ)
Слайд 17Получение аммиака в промышленности
Приведите
условия
для
смещения
равновесия
в сторону
получения
аммиака
Слайд 18В промышленности
Получение
Смесь
азота и
водорода
турбокомпрессор
катализатор
теплообменник
холодильник
сепаратор NH3
Слайд 19Получение аммиака в лаборатории
В лабораторных условиях аммиак обычно получают слабым нагреванием
2NH4Cl+Ca(OH)2=CaCl2+2NH3+2H2O
Эта реакция основана на смещении
Равновесия взаимодействия аммиака с водой при добавлении гидроксид-ионов.
(видео: получение аммиака)
Слайд 20
Свойства химические
(т.к. ст.ок. -3)
(т.к. имеется неподеленная пара е)
Допишите уравнения реакции, составьте
гидроксид аммония
хлорид аммония
Запишите уравнения реакции аммиака с серной и ортофосфорной кислотой, назовите продукты реакции.
Слайд 22Применение азота
N2
Синтез аммиака
Холодильное
оборудование
Производство
взрывчатых
веществ
Производство
минеральных
удобрений
Слайд 28Тестовый контроль
1. Степень окисления азота не может быть равна:
а) +1;
б) -4; г) -3.
2. Какое из данных соединений называется чилийской селитрой: а) нитрат калия; в) нитрат кальция;
б) нитрат натрия; г) нитрат аммония.
3. Какая формула соответствует оксиду азота (II):
а) N2O; в) NO;
б) N2O3; г) NH3.
Тестовый контроль
1. Степень окисления азота не может быть равна:
б) -4
2. Какое из данных соединений называется чилийской селитрой:;
б) нитрат натрия
3. Какая формула соответствует оксиду азота (II):
в) NO
Слайд 29ММЦ 74212
Домашнее задание:
§ 23, читать, записи в тетради, классифицировать уравнение реакции
Вопрос № 4 – письменно