- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Атом - сложная частица (11 кл., базовый уровень)
Содержание
- 1. Презентация по химии Атом - сложная частица (11 кл., базовый уровень)
- 2. в 1897г английский химик Дж. Томсон открыл
- 3. «Пудинг с изюмом» 1902 - 1904г.г. Ф.
- 4. Малость атомов демонстрируют следующие примеры:человеческий волос по
- 5. Протоны, нейтроны, электроны, атомы, ионы частицы микромира обладают корпускулярно-волновым дуализмом
- 6. явление дифракции - огибание волной препятствия, то есть проникновение волны в область геометрической тени
- 7. Интерференция -изменение в характере звуковых, тепловых, световых и электрических явлений
- 8. Квантово-механическая модель атома (1932г.)А́том – это электронейтральная
- 9. Сравнительная характеристика элементарных частиц
- 10. Химический элемент – это вид атомов с
- 11. на 77,35% из нуклидов 35Clна 22,65% из
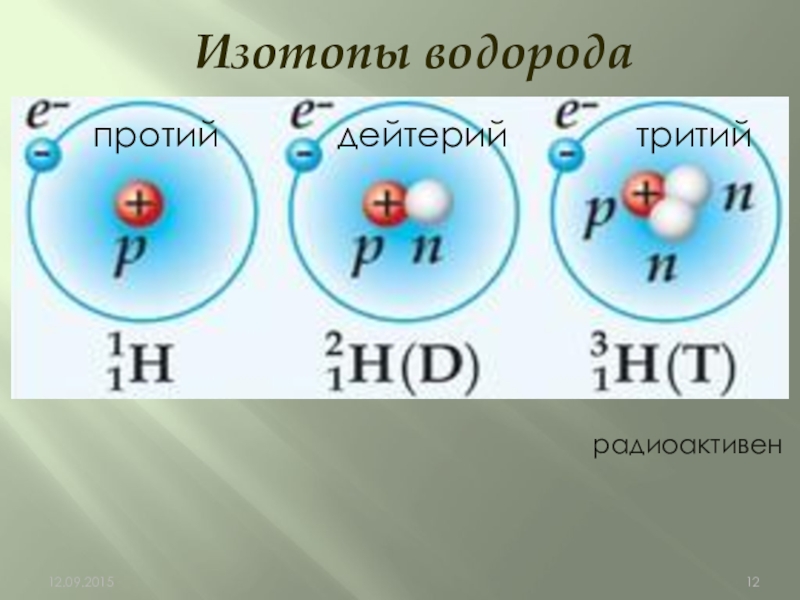
- 12. Изотопы водородапротий дейтерий тритийрадиоактивен
- 13. Формы существования химического элементаНОНННННННННООООООООН2О2
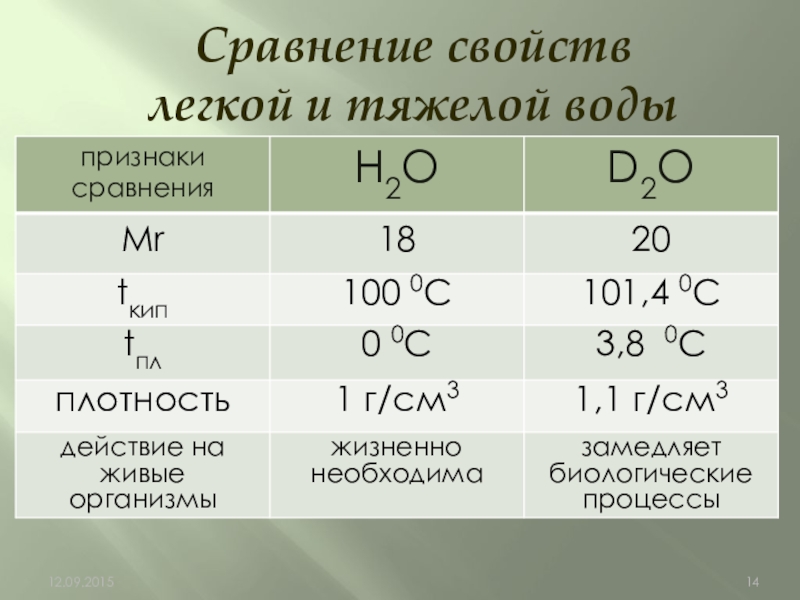
- 14. Сравнение свойств легкой и тяжелой воды
- 15. Ионыесли N(+p) = N(ē), то атом в
- 16. Домашнее задание§1; записи в тетради, ТПО
- 17. Ядро атома (нуклид) характеризуется:40Ar18Массовое число (А) –
- 18. Понятие «изотопы»(от греч. ισος — «равный», «одинаковый»,
- 19. Слайд 19
Слайд 2в 1897г английский химик Дж. Томсон открыл электрон (ē) – частицу,
в 1913г был открыт протон (+р);
в 1932г физик Дж. Чедвик открыл нейтрон (0n), за это открытие он получил Нобелевскую премию по физике в 1935 г.;
однако в конце XIX — начале XX века физиками были открыты субатомные частицы
стало ясно, что атом в действительности не является «неделимым».
модели строения атома
современные представления о строении атома на основе квантовой механики
История становления понятия «атом»
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами;
В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов.
На международном съезде химиков в г. Карлсруе (Германия) в 1860 г. были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Слайд 3«Пудинг с изюмом» 1902 - 1904г.г.
Ф. Леннард
Дж. Томсон Х. Накаока
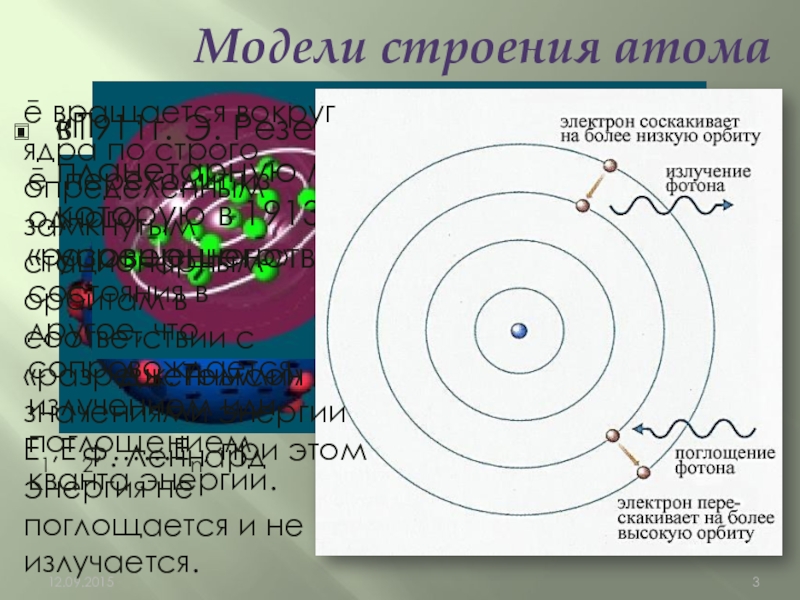
в1911г. Э. Резерфорд предложил планетарную модель стрения атома, которую в 1913г дополнил и усовершенствовал Н.Бор
ē переходит из одного «разрешенного» состояния в другое, что сопровождается излучением или поглощением кванта энергии.
Модели строения атома
ē вращается вокруг ядра по строго определенным замкнутым стационарным орбитам в соответствии с «разрешенными» значениями энергии
Е1,Е 2, ……Еn, при этом энергия не поглощается и не излучается.
Слайд 4Малость атомов демонстрируют следующие примеры:
человеческий волос по толщине в миллион раз
одна капля воды содержит 2 секстиллиона (2×1021) атомов кислорода, и в два раза больше атомов водорода.
один карат алмаза с массой 0,2г состоит из 10 секстиллионов атомов углерода.
если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.
Слайд 5Протоны, нейтроны, электроны, атомы, ионы
частицы микромира
обладают
корпускулярно-волновым дуализмом
Слайд 6явление дифракции - огибание волной препятствия, то есть проникновение волны в
Слайд 8Квантово-механическая модель атома (1932г.)
А́том – это электронейтральная система, которая включает ядро,
ē
Атом–электронейтральная система
+
ядро
+p
0n
нуклоны
элементарные частицы
Слайд 10Химический элемент
– это вид атомов с одинаковым зарядом ядра
– химический элемент
«изотопы» – разновидности атомов одного химического элемента с разным количеством нейтронов в ядре;
обозначают изотопы
35Cl (хлор-35), 37Cl (хлор-37)
разновидность одного элемента – изотопы
AЭ
Z
А = Z + N
число нейтронов
Слайд 11на 77,35% из нуклидов 35Cl
на 22,65% из нуклидов 37Cl
Ar(Cl) =
Природный хлор состоит
35,453
?
среднее арифметическое м/у массами всех изотопов существующих в природе
сумма масс всех протонов и нейтронов, образующих ядро атома
Слайд 15Ионы
если N(+p) = N(ē), то атом в целом оказывается электрически нейтральным;
в
катион
анион
Слайд 17Ядро атома (нуклид) характеризуется:
40Ar
18
Массовое число (А)
– сумма масс протонов и
Порядковый номер (Z)
– число протонов
А = Z + N
число нейтронов
Слайд 18Понятие «изотопы»
(от греч. ισος — «равный», «одинаковый», и τόπος — «место»)
количество нейтронов в ядре называется его изотопическим числом N
название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева.