- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Аммиак и соли аммония
Содержание
- 1. Презентация по химии Аммиак и соли аммония
- 2. История названияАммиак (в европейских языках его название
- 3. ИСТОРИЧЕСКАЯ СПРАВКАВпервые аммиак был получен в чистом
- 4. Состав молекулыNH3 или H3N-3-3
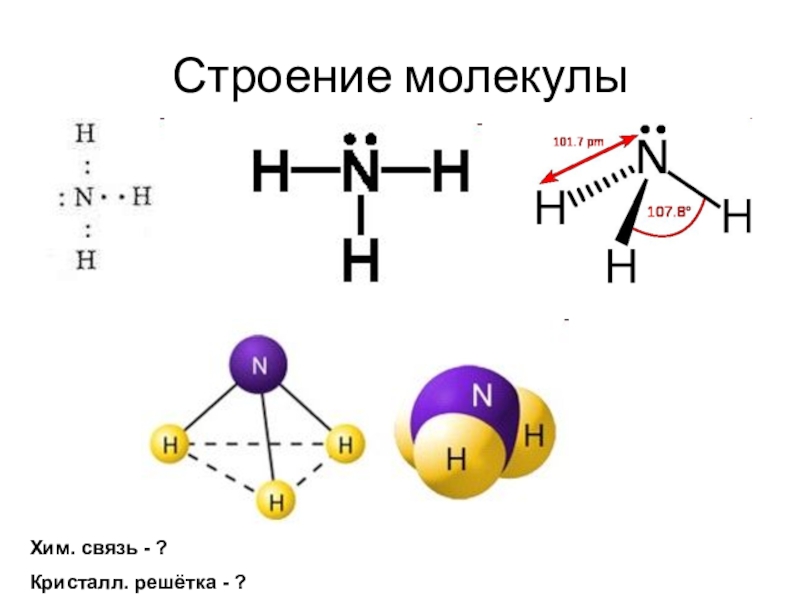
- 5. Строение молекулыХим. связь - ?Кристалл. решётка - ?
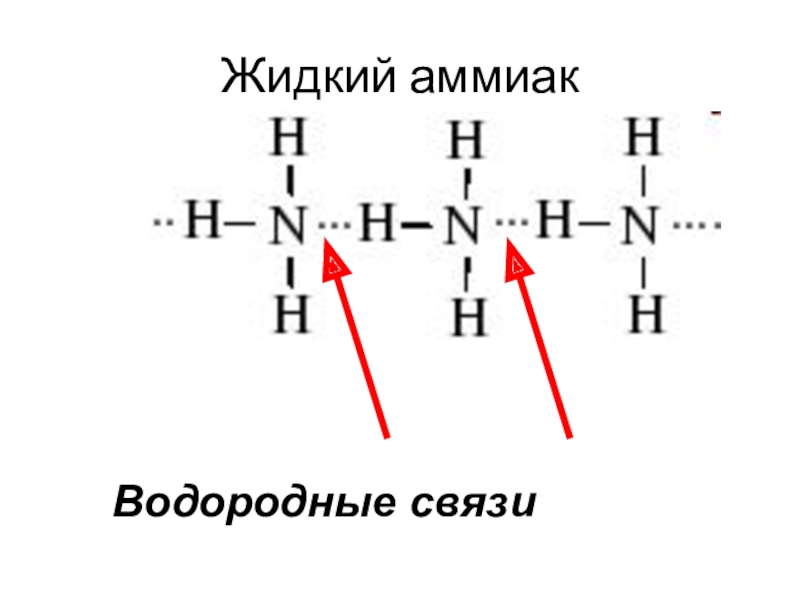
- 6. Жидкий аммиакВодородные связи
- 7. Физические свойства (при н.у. ) бесцветный газ
- 8. ТоксикологияОтносится к группе веществ удушающего и нейротропного
- 9. Биологическая рольАммиак является конечным продуктом азотистого обмена
- 10. Химические свойстваВзаимодействие с водой: NH3
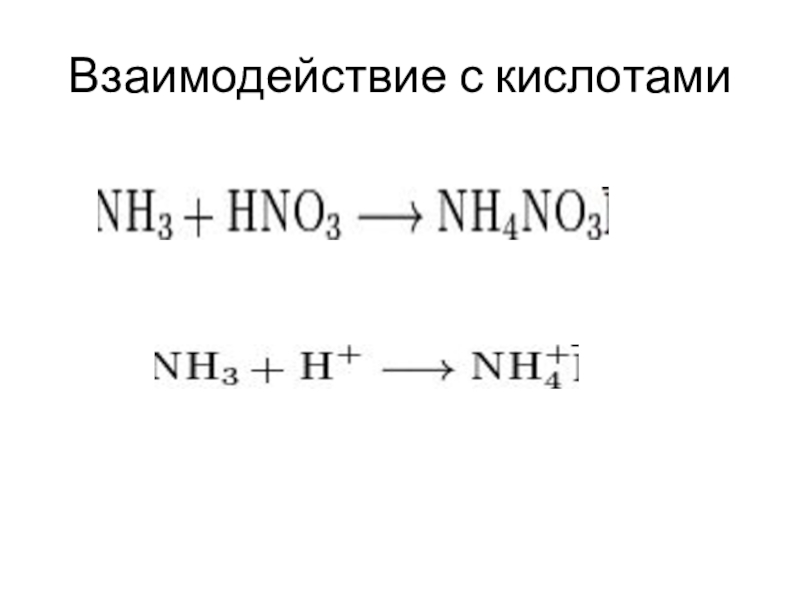
- 11. Взаимодействие с кислотами
- 12. ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА (связанные с изменениями
- 13. ПРОВЕРЬ СЕБЯ!1) 2 N-3H3+ =
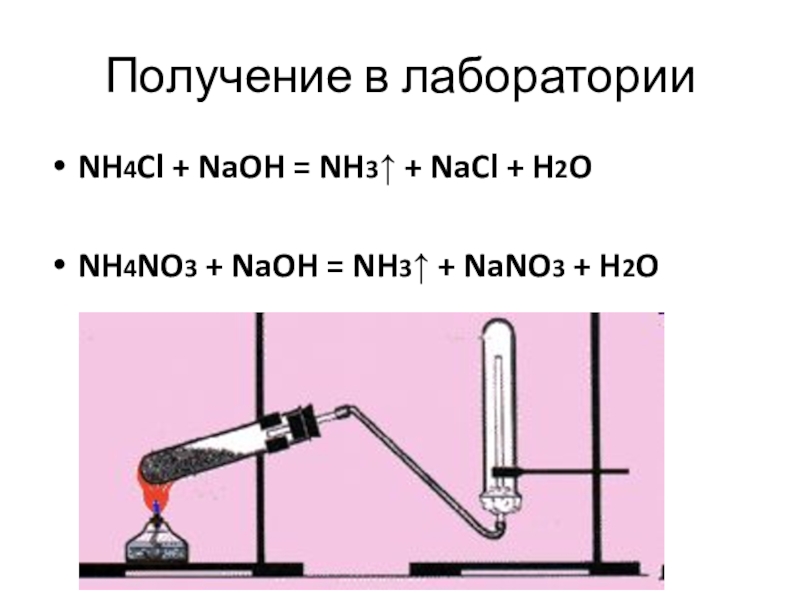
- 14. Получение в лабораторииNH4Cl + NaOH = NH3↑
- 15. Слайд 15
- 16. Слайд 16
- 17. соли аммония
- 18. Соли аммо́ния — соли, содержащие одновалентный ион
- 19. Химические свойства 1.
- 20. Химические свойства 1.
- 21. Химические свойства
- 22. Химические свойства
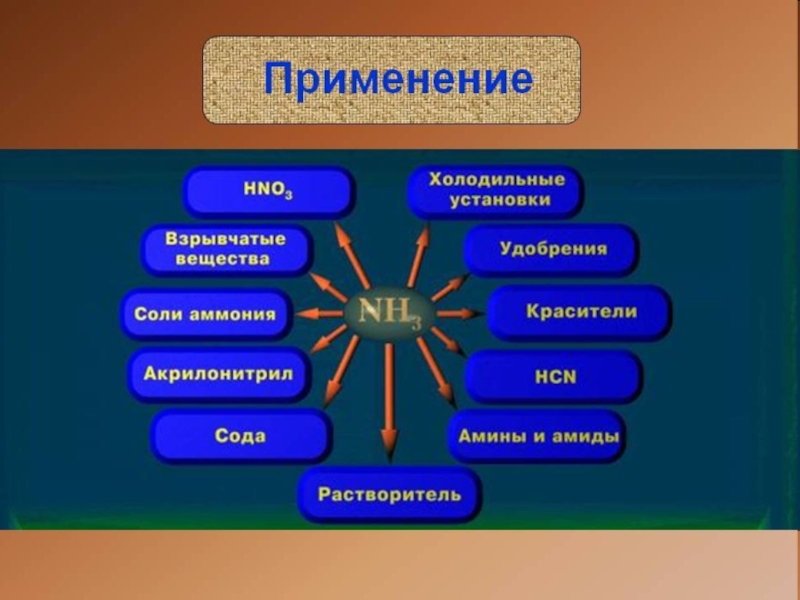
- 23. применение солей аммонияНитрат аммония NH4NО3 в смеси
- 24. применение солей аммонияГидрокарбонат аммония NH4HCO3 и карбонат
- 25. применение солей аммонияСоли аммония используются в качестве удобрений
- 26. применение солей аммонияХлорид аммония применяется при изготовлении дымовых шашек
История названияАммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро.
Слайд 2История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак.
По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Слайд 3ИСТОРИЧЕСКАЯ СПРАВКА
Впервые аммиак был получен в чистом виде в 1774 г.
английским химиком Джозефом Пристли. В 1784 г. французский химик Клод Луи Бертолле с помощью электрического разряда разложил аммиак на элементы и установил таким образом состав этого газа, который в 1787г. получил официальное название «аммониак» – от латинского названия нашатыря – sal ammoniac; эту соль получали близ храма бога Амона в Египте.
Джозеф Пристли
Клод Луи Бертолле
Слайд 7Физические свойства (при н.у. )
бесцветный газ
с резким характерным запахом
(запах нашатырного спирта)
легче воздуха (М=17 г/моль)
хорошо растворяется в воде (1200 объёмов (при 0 °C) и 700 объёмов (при 20 °C) в объёме воды
Температура плавления -77.73 °C
Температура кипения -33.34 °C
Токсичен!
легче воздуха (М=17 г/моль)
хорошо растворяется в воде (1200 объёмов (при 0 °C) и 700 объёмов (при 20 °C) в объёме воды
Температура плавления -77.73 °C
Температура кипения -33.34 °C
Токсичен!
Слайд 8Токсикология
Относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном
поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м³.
ПДК в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно.
ПДК в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м³.
ПДК в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно.
ПДК в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области.
Слайд 9Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и
животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Большая часть аммиака конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование».
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование».
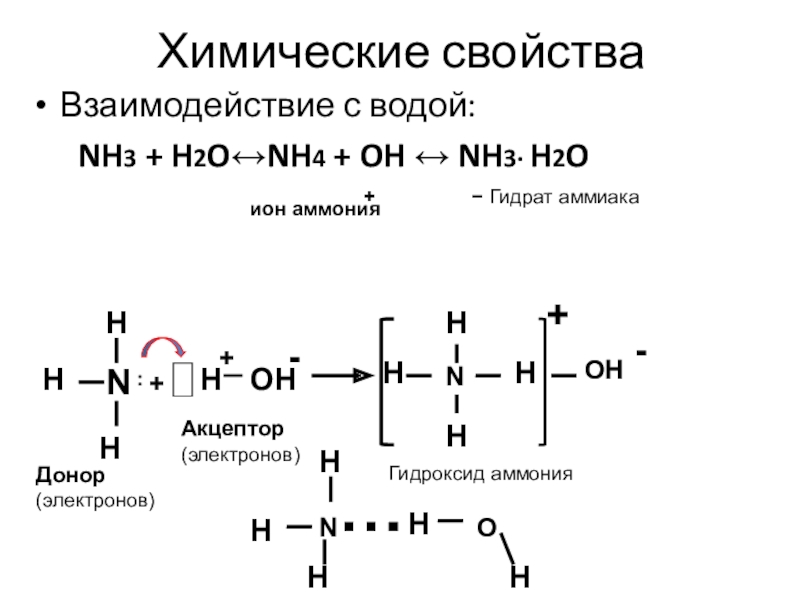
Слайд 10Химические свойства
Взаимодействие с водой:
NH3 + H2O↔NH4 + OH
↔ NH3· H2O
+
−
ион аммония
Гидрат аммиака
N
H
H
H
H
H
:
…
+
+
ОН
-
Донор (электронов)
Акцептор (электронов)
H
H
H
H
N
+
ОН
-
Гидроксид аммония
H
H
H
H
N
О
Слайд 12ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
(связанные с изменениями степени окисления азота)
Разложение аммиака:
?
N-3H3+ = N20 + ? H20
. Горение аммиака:
? N-3H3+ + ? О20 = ? N20 + ? H2O-2 + Q
Каталитическое окисление аммиака :
? N-3H3+ + ? О20 = ? N+2O + ? H2O-2 + Q
. Горение аммиака:
? N-3H3+ + ? О20 = ? N20 + ? H2O-2 + Q
Каталитическое окисление аммиака :
? N-3H3+ + ? О20 = ? N+2O + ? H2O-2 + Q
Задание: составьте электронный баланс,
укажите окислитель/восстановитель, процесс окисление /восстановитель
Слайд 13ПРОВЕРЬ СЕБЯ!
1) 2 N-3H3+ = N20 + 3 H20
1 2N -3 -6 е = N20 - окисление/восстановитель
3 2H+ +2e = H20 –восстановление/окислитель
2) 4 N-3H3+ + 3 О20 = 2 N20 + 6 H2O-2 + Q
2 2N -3 -6 е = N20 - окисление/восстановитель
3 О20 +4e = 2О-2 –восстановление/окислитель
3) 4 N-3H3+ + 5 О20 = 4 N+2O + 6 H2O-2 + Q
4 N -3 -5 е = N+2 - окисление/восстановитель
5 О20 +4e = 2О-2 –восстановление/окислитель
3 2H+ +2e = H20 –восстановление/окислитель
2) 4 N-3H3+ + 3 О20 = 2 N20 + 6 H2O-2 + Q
2 2N -3 -6 е = N20 - окисление/восстановитель
3 О20 +4e = 2О-2 –восстановление/окислитель
3) 4 N-3H3+ + 5 О20 = 4 N+2O + 6 H2O-2 + Q
4 N -3 -5 е = N+2 - окисление/восстановитель
5 О20 +4e = 2О-2 –восстановление/окислитель
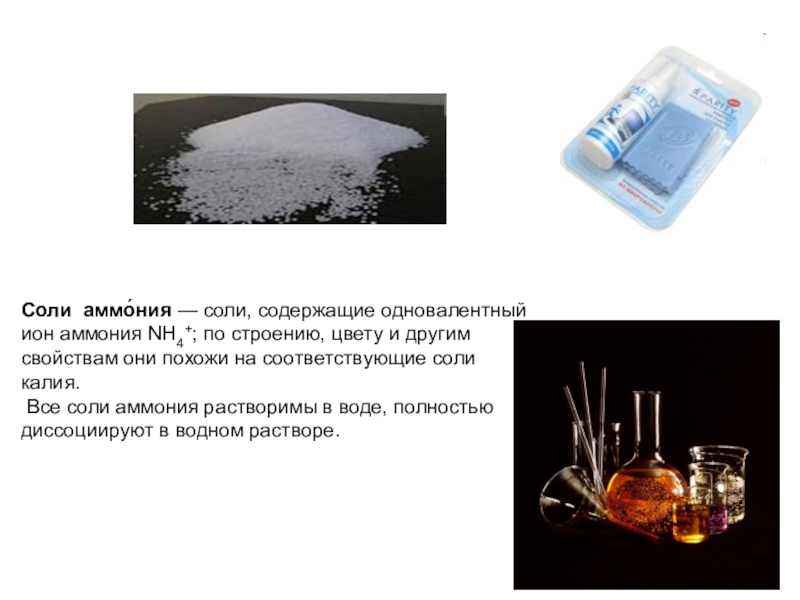
Слайд 18Соли аммо́ния — соли, содержащие одновалентный
ион аммония NH4+; по строению,
цвету и другим
свойствам они похожи на соответствующие соли калия.
Все соли аммония растворимы в воде, полностью диссоциируют в водном растворе.
свойствам они похожи на соответствующие соли калия.
Все соли аммония растворимы в воде, полностью диссоциируют в водном растворе.
Слайд 19 Химические свойства
1. Сильные электролиты (диссоциируют в
водных растворах):
NH4Cl ↔
2. С кислотами (реакция обмена):
(NH4) 2CO3 + НCl →
NH4Cl ↔
2. С кислотами (реакция обмена):
(NH4) 2CO3 + НCl →
Слайд 20 Химические свойства
1. Сильные электролиты (диссоциируют в
водных растворах):
NH4Cl ↔ NH4 ++ Cl-
2. С кислотами (реакция обмена):
(NH4) 2CO3 + 2НCl → 2NH 4Cl + Н2O + CO2 ↑
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2 ↑
CO32- + 2H+ → Н2O + CO2 ↑
NH4Cl ↔ NH4 ++ Cl-
2. С кислотами (реакция обмена):
(NH4) 2CO3 + 2НCl → 2NH 4Cl + Н2O + CO2 ↑
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2 ↑
CO32- + 2H+ → Н2O + CO2 ↑
Слайд 21 Химические свойства
3. C
солями (реакция обмена):
(NH4)2SO4 + Ba(NO3)2 →
4. При нагревании со щелочами выделяется аммиак (качественная реакция на ион аммония):
NH4Cl + NaOH →
(NH4)2SO4 + Ba(NO3)2 →
4. При нагревании со щелочами выделяется аммиак (качественная реакция на ион аммония):
NH4Cl + NaOH →
Слайд 22 Химические свойства
3. C
солями (реакция обмена):
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 ↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4 ↓
4. При нагревании со щелочами выделяется аммиак (качественная реакция на ион аммония):
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 ↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4 ↓
4. При нагревании со щелочами выделяется аммиак (качественная реакция на ион аммония):
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
Слайд 23применение солей аммония
Нитрат аммония NH4NО3 в смеси с порошками алюминия и
угля используют в качестве взрывчатого вещества - аммонала , который широко применяют при разработке горных пород.
Слайд 24применение солей аммония
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в
кондитерском деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑