- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Алюминий
Содержание
- 1. Презентация по химии Алюминий
- 2. Алюминий
- 3. Алюминий Получение
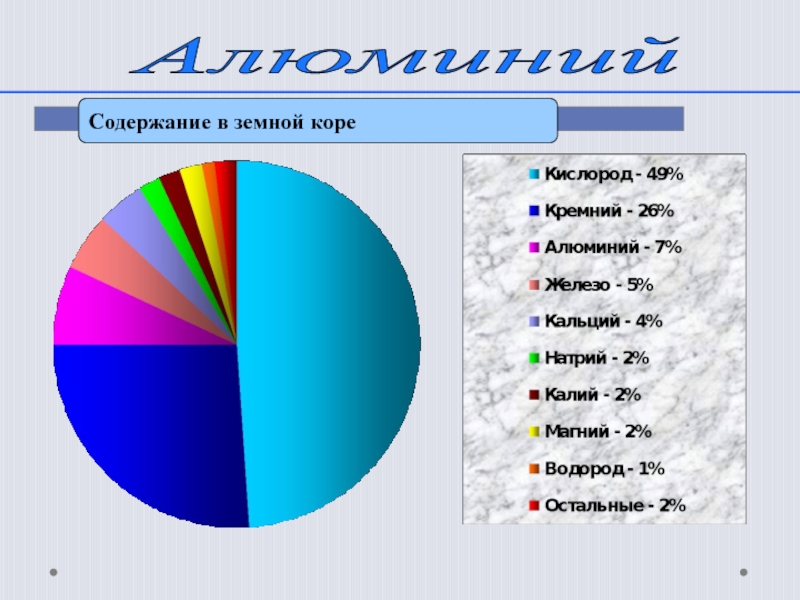
- 4. Алюминий Содержание в земной коре
- 5. Алюминий Нахождение в природе
- 6. Слайд 6
- 7. Алюминий Электронное строение27Аl+1302e8e3e1s22s22p63s23p1Краткая электронная запись1s22s22p63s23p1Порядок заполнения
- 8. Алюминий Строение простого вещества Металл
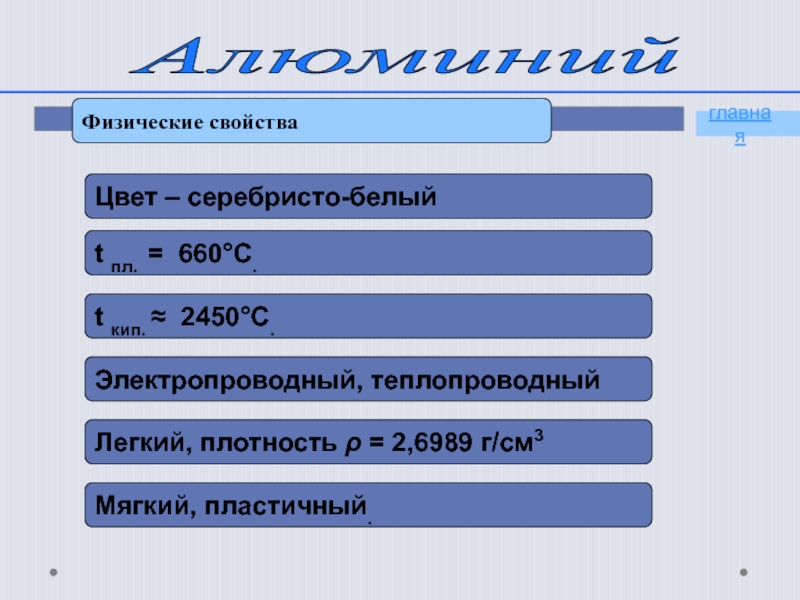
- 9. Алюминий Физические свойстваглавная
- 10. Алюминий Химические свойства4Аl + 3O2 = 2Al2O3
- 11. Алюминий при обычных
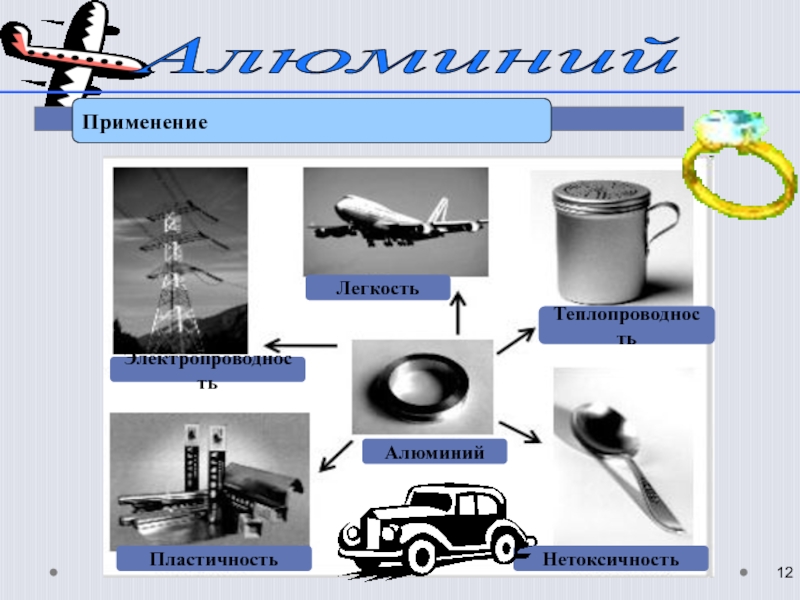
- 12. Алюминий Применение
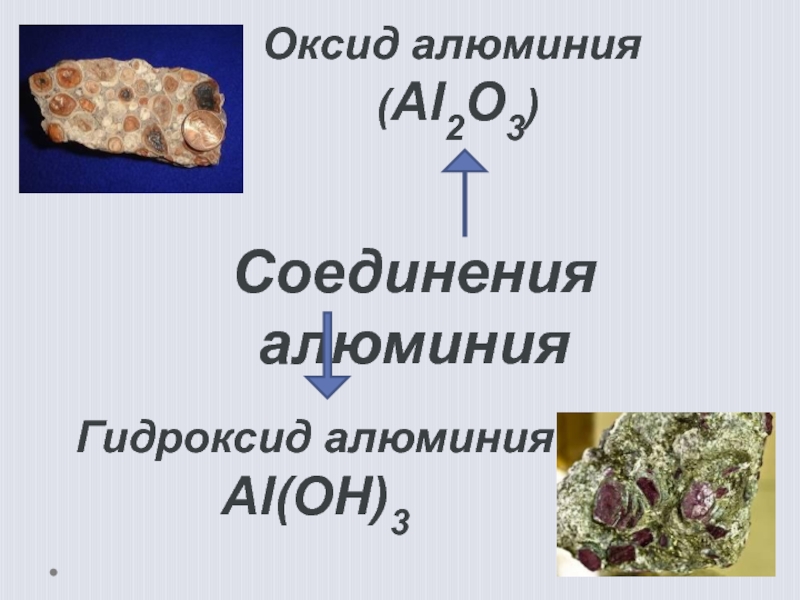
- 13. Соединения алюминияОксид алюминия (Al2O3)Гидроксид алюминияAl(OH)3
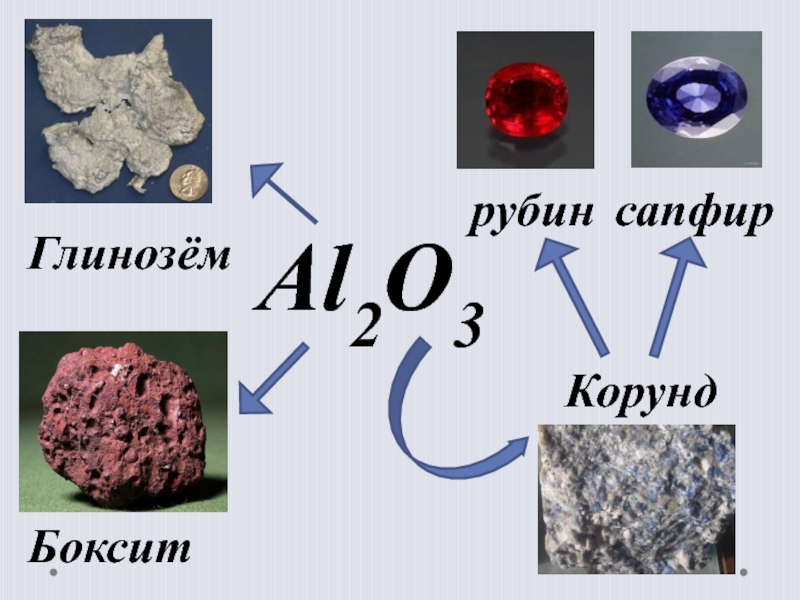
- 14. Al2O3ГлинозёмКорундсапфиррубинБоксит
- 15. Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAl2O3 + 6HCl=2AlCl3 + 3H2OAl2O3+ 2NaOH +3H2O=2Na[Al(OH)4]
- 16. Оксид алюминия Al2О3Очень твердый (корунд, рубин) порошок
- 17. Химические свойства гидроксида алюминияАмфотерныйРеагирует с кислотамиРеагирует с
- 18. Гидроксид алюминия Al(ОН)3Белый нерастворимый в воде порошок.Проявляет
- 19. Соли алюминияРастворимые в водеНерастворимые в водеПри реакции
Слайд 1“Однажды к древнеримскому императору Тиберию правившему Римом в 14–27 гг. н.
“Дальновидный” император, испугавшись, что новый металл, который можно получать из обыкновенной глины, обесценит серебро и подорвёт могущество Рима, повелел:
чашу уничтожить, ремесленника обезглавить, а его мастерскую сравнять с землёй!”
Слайд 6
Алюминий
Из истории открытия
Слайд 7Алюминий
Электронное строение
27
Аl
+13
0
2e
8e
3e
1s2
2s2
2p6
3s2
3p1
Краткая электронная запись
1s2
2s2
2p6
3s2
3p1
Порядок заполнения
Слайд 8
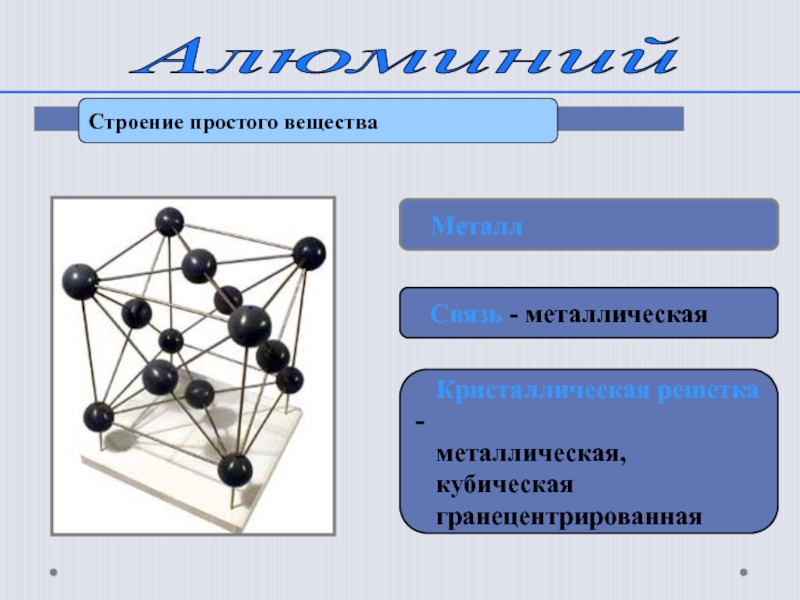
Алюминий
Строение простого вещества
Металл
Связь - металлическая
металлическая,
кубическая
гранецентрированная
Слайд 10Алюминий
Химические свойства
4Аl + 3O2 = 2Al2O3
t
2Al +
C н е м е т а л л а м и (c кислородом, с серой)
2Аl + 3Cl2 = 2AlCl3
4Al + 3C = Al4C3
C неметаллами (c галогенами, с углеродом)
(Снять оксидную пленку)
2Al + 6H2O = 2Al(OH)3 + 3H2↑
C в о д о й
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
C к и с л о т а м и
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2↑
2Al + 2NaOH + 2H2O =2NaAlO2 +3H2↑
Cо щ е л о ч а м и
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + WO3 = Al2O3 + W
C о к с и д а м и м е т а л л о в
Слайд 15Химические свойства оксида алюминия
Амфотерный оксид
Реагирует с кислотами
Реагирует с щелочами
Al2O3 + 6HCl=2AlCl3
Al2O3+ 2NaOH +3H2O=2Na[Al(OH)4]
Слайд 16Оксид алюминия Al2О3
Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий -
Амфотерный оксид, взаимодействует:
а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O
Образуется:
а) при окислении или горении алюминия на воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O
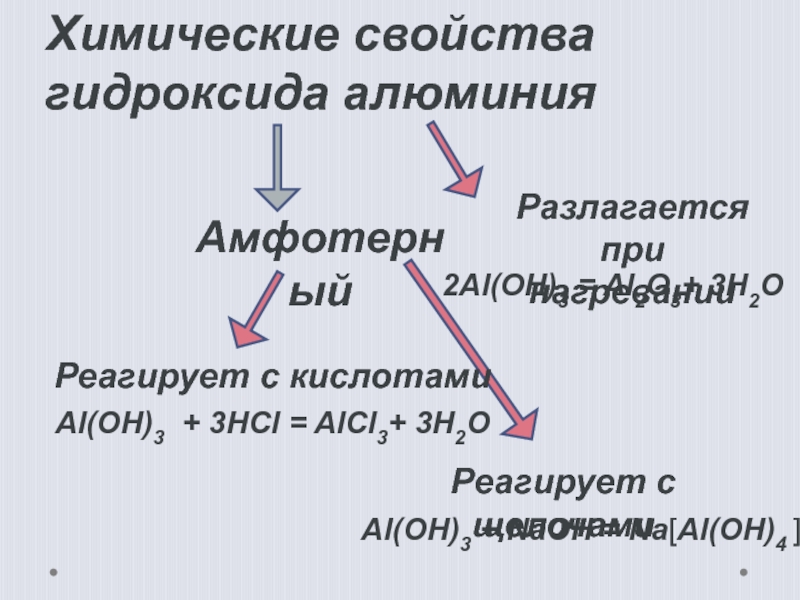
Слайд 17Химические свойства
гидроксида алюминия
Амфотерный
Реагирует с кислотами
Реагирует с щелочами
Al(OH)3 + 3HCl =
Al(OH)3 + NaOH = Nа[Al(OH)4 ]
Разлагается при
нагревании
2Al(OH)3 = Al2О3+ 3H2O
Слайд 18Гидроксид алюминия Al(ОН)3
Белый нерастворимый в воде порошок.
Проявляет амфотерные свойства, взаимодействует:
а) с
б) со щелочами Al (OH)3 + Na OH = NaAlO2 + 2H2O
Разлагается при нагревании 2Al (OH)3 = Al2O3 + 3H2O
Образуется:
а) при взаимодействии растворов солей алюминия с растворами щелочей (без избытка)
Al3+ + 3OH- = Al (OH)3
б) при взаимодействии алюминатов с кислотами (без избытка)
AlO-2 + H+ + H2O = Al (OH)3
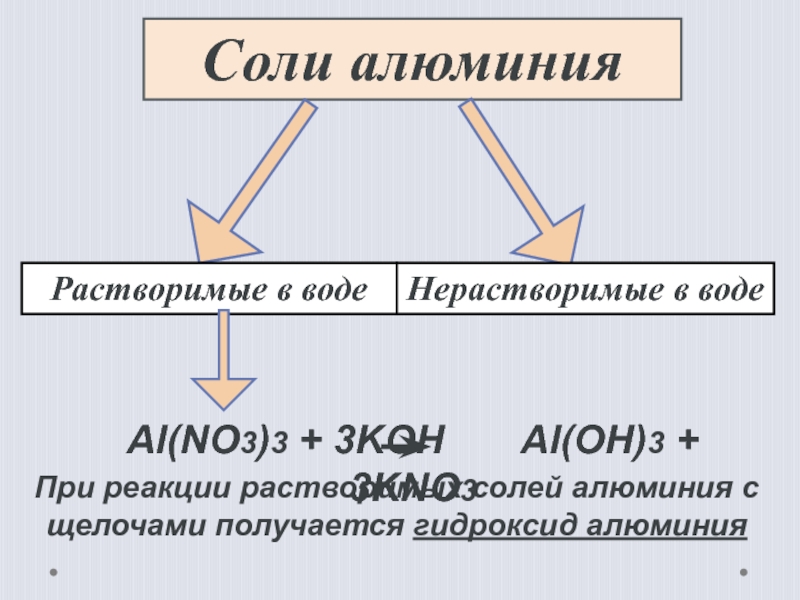
Слайд 19Соли алюминия
Растворимые в воде
Нерастворимые в воде
При реакции растворимых солей алюминия с
Al(NO3)3 + 3KOH Al(OH)3 + 3KNO3








![Презентация по химии Алюминий Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAl2O3 + 6HCl=2AlCl3 + 3H2OAl2O3+ 2NaOH +3H2O=2Na[Al(OH)4] Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочамиAl2O3 + 6HCl=2AlCl3 + 3H2OAl2O3+ 2NaOH +3H2O=2Na[Al(OH)4]](/img/thumbs/1d1efa680b93a15cb21859f5c55ce7cd-800x.jpg)