- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии АЛКЕНЫ
Содержание
- 1. Презентация по химии АЛКЕНЫ
- 2. Алкены — ациклические углеводороды, содержащие в молекуле, помимо
- 3. Атомы углерода, между которыми имеется двойная связь
- 4. Молекулярные формулы алкенов из гомологического ряда представлены
- 5. Гибридные орбитали атомов, образующих двойную связь, находятся
- 6. Для алкенов, так же как и для
- 7. Вокруг одинарной углерод-углеродной связи возможно практически свободное
- 8. Физические свойства.Общая формула алкенов определяет физическое состояние
- 9. Физические свойства.В жидкой форме представлены углеводороды гомологического
- 10. Физические свойства.Всем олефинам причисляют растворимость плохую в
- 11. Химические свойства.Для алкенов наиболее типичными являются реакции
- 12. Химические свойства.Важным химическим свойством всех алкенов является
- 13. Химические свойства.К важным реакциям относится гидрирование олифинов
- 14. Химические свойства.Реакция присоединения алкенами воды под действием
- 15. Химические свойства.Алкены подвержены окислению во время их
- 16. Алкены нашли применение в различных отраслях народного
- 17. Пропилен используется как сырье для получения некоторых
- 18. Слайд 18
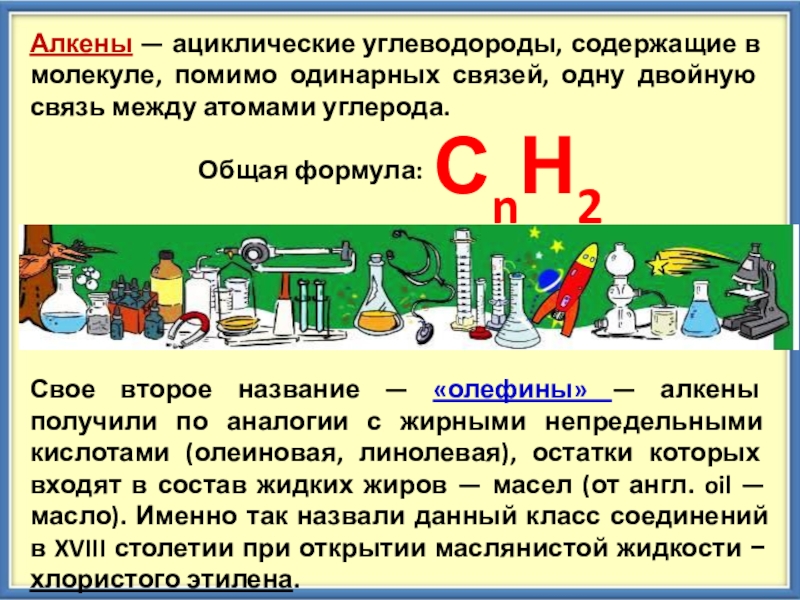
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода. Общая формула: СnН2nСвое второе название — «олефины» —
Слайд 2Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную
связь между атомами углерода.
Общая формула:
Общая формула:
СnН2n
Свое второе название — «олефины» — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от англ. oil — масло). Именно так назвали данный класс соединений в XVIII столетии при открытии маслянистой жидкости − хлористого этилена.
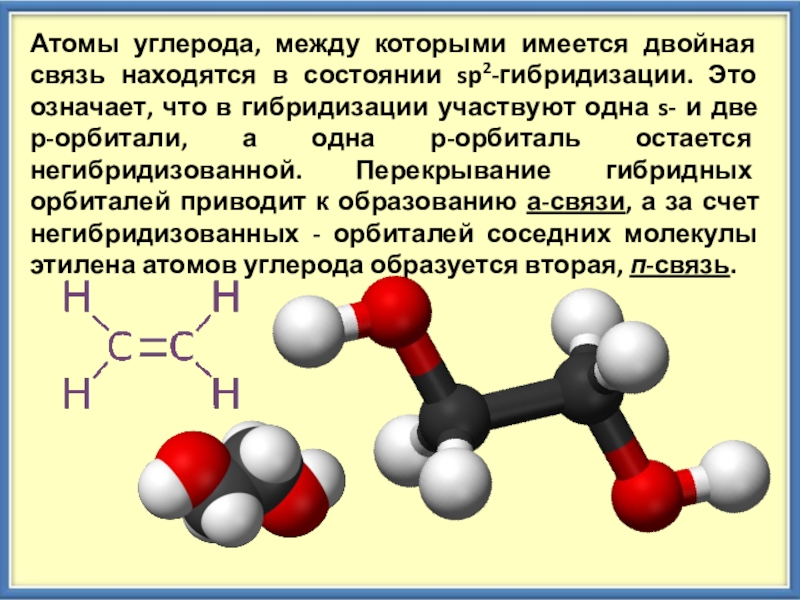
Слайд 3Атомы углерода, между которыми имеется двойная связь находятся в состоянии sp2-гибридизации.
Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию а-связи, а за счет негибридизованных - орбиталей соседних молекулы этилена атомов углерода образуется вторая, п-связь.
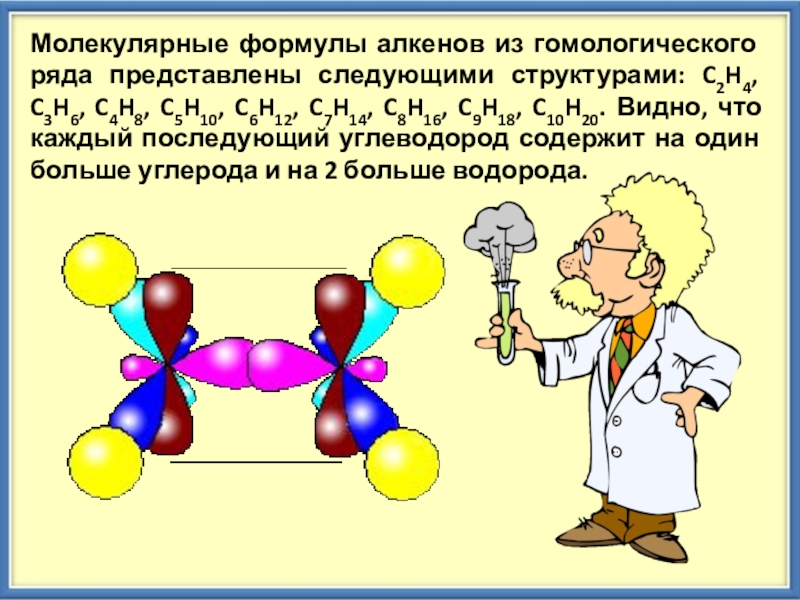
Слайд 4Молекулярные формулы алкенов из гомологического ряда представлены следующими структурами: C2H4, C3H6,
C4H8, C5H10, C6H12, C7H14, C8H16, C9H18, C10H20. Видно, что каждый последующий углеводород содержит на один больше углерода и на 2 больше водорода.
Слайд 5Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а
орбитали, образующие п-связь, располагаются перпендикулярно плоскости молекулы.
Двойная связь (0,132 нм) короче одинарной, а ее энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой п-связи приводит к тому, что алкены химически более активны, чем алканы.
Двойная связь (0,132 нм) короче одинарной, а ее энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой п-связи приводит к тому, что алкены химически более активны, чем алканы.
Слайд 6Для алкенов, так же как и для алканов, характерна структурная изомерия.
Структурные изомеры, как вы помните, отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен.
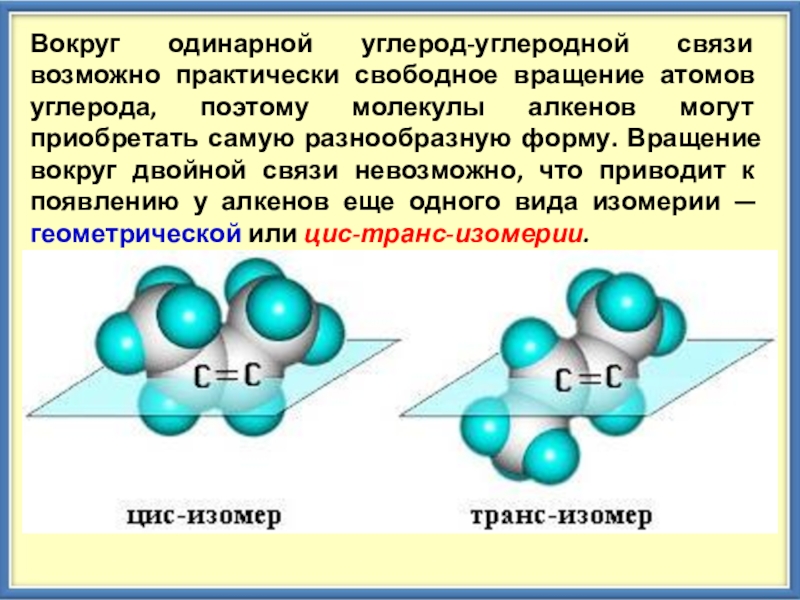
Слайд 7Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому
молекулы алкенов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической или цис-транс-изомерии.
Слайд 8Физические свойства.
Общая формула алкенов определяет физическое состояние всех представителей данного класса.
Начиная с этилена и заканчивая бутиленом (от С2 до С4), вещества существуют в газообразном виде. Так у бесцветного этена имеется сладковатый запах, малая растворимость в воде, молекулярная масса меньше, чем у воздуха.
Слайд 9Физические свойства.
В жидкой форме представлены углеводороды гомологического промежутка от С5 до
С17. Начиная с алкена, имеющего в основной цепи 18 атомов углерода, происходит переход физического состояния в твердую форму.
Слайд 10Физические свойства.
Всем олефинам причисляют растворимость плохую в водной среде, зато хорошую
в растворителях органической природы, типа бензола или бензина. Их молекулярная масса меньше, чем у воды.
Увеличение углеродной цепочки приводит к повышению температурных показателей при плавлении и кипении данных соединений.
Некоторые алкены (этилен и пропилен) горят коптящим пламенем.
Увеличение углеродной цепочки приводит к повышению температурных показателей при плавлении и кипении данных соединений.
Некоторые алкены (этилен и пропилен) горят коптящим пламенем.
Слайд 11Химические свойства.
Для алкенов наиболее типичными являются реакции присоединения. В реакциях присоединения
двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
Слайд 12Химические свойства.
Важным химическим свойством всех алкенов является процесс галогенирования с выделением
соединений, подобным дигалогенопроизводным веществам. Галогеновые атомы способны прикрепляться по двойному соединению к углеродам. Примером может служить бромирование пропилена с формированием дибромпропана.
Слайд 13Химические свойства.
К важным реакциям относится гидрирование олифинов с присоединением молекулы водорода
под действием каталитических металлов типа платины, палладия или никеля. В результате получаются углеводороды с насыщенной связью.
Слайд 14Химические свойства.
Реакция присоединения алкенами воды под действием кислот носит название гидратации.
В результате получается молекула спирта пропанола-2.
При воздействии на алкены кислотой серной происходит процесс сульфирования. Реакция протекает с образованием кислых эфиров, например, изопропилсерной кислоты.
При воздействии на алкены кислотой серной происходит процесс сульфирования. Реакция протекает с образованием кислых эфиров, например, изопропилсерной кислоты.
Слайд 15Химические свойства.
Алкены подвержены окислению во время их сжигания при действии кислорода
с формированием воды и газа углекислого.
Молекулы алкенов могут быть задействованы в процессе полимеризации со свободнорадикальным или катионно-анионным механизмом.
Молекулы алкенов могут быть задействованы в процессе полимеризации со свободнорадикальным или катионно-анионным механизмом.
Слайд 16Алкены нашли применение в различных отраслях народного хозяйства.
Например, этилен широко
используется в промышленном органическом синтезе для получения разнообразных органических соединений, таких как спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. В большом количестве этилен расходуется для производства полимеров.
Слайд 17Пропилен используется как сырье для получения некоторых спиртов (например, пропанола-2, глицерина),
ацетона и др. Полимеризацией пропилена получают полипропилен.
Полиэтиленовая плёнка (особенно упаковочных, например, пузырчатая упаковка или скотч ).
Тара ( бутылки , банки , ящики , канистры , садовые лейки , горшки для рассады.
Полимерные трубы для канализации , дренажа , водо-, газоснабжения.
Полиэтиленовая плёнка (особенно упаковочных, например, пузырчатая упаковка или скотч ).
Тара ( бутылки , банки , ящики , канистры , садовые лейки , горшки для рассады.
Полимерные трубы для канализации , дренажа , водо-, газоснабжения.