№ 68
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 9 класс Щелочные металлы
Содержание
- 1. Презентация по химии 9 класс Щелочные металлы
- 2. Методы урока: проблемные, поисково-исследовательские, самостоятельная работа учащихся.
- 3. ЗагадкиПервый слог – предлог известный. Слог второй
- 4. Угадай !Соединения этого металла способствуют быстрому росту
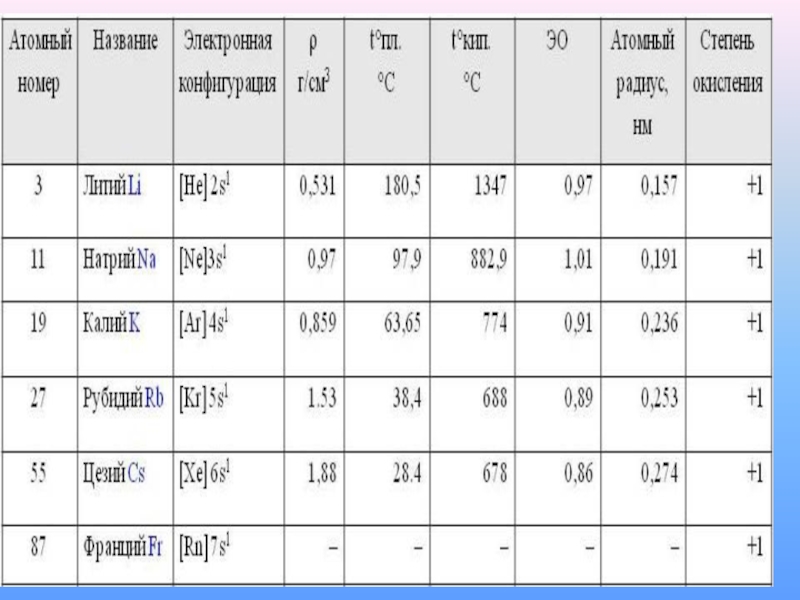
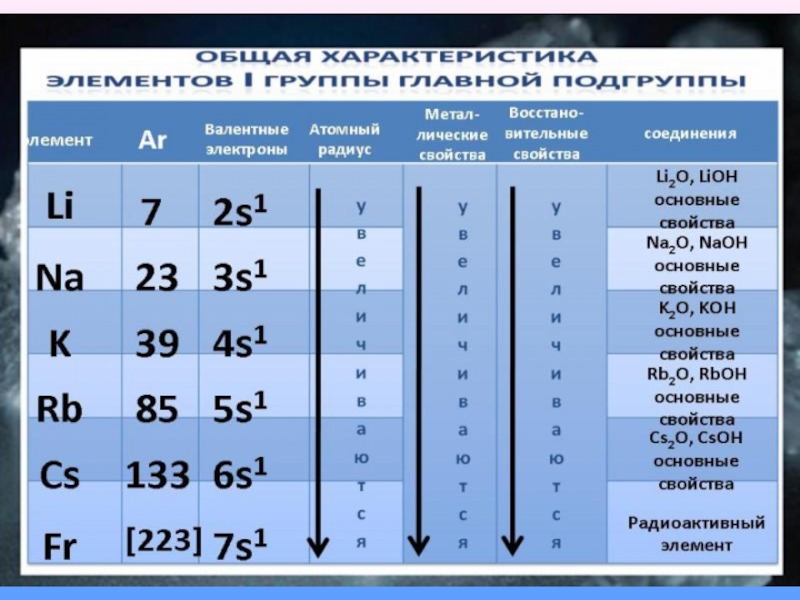
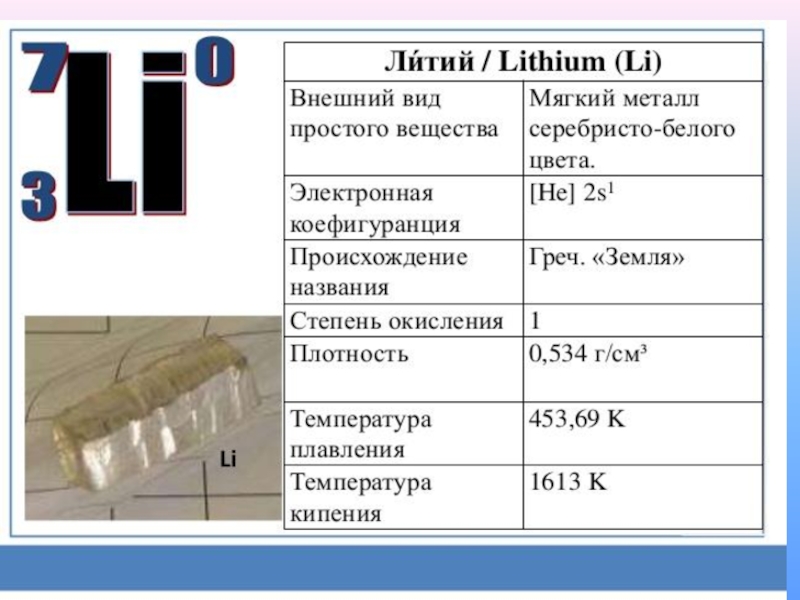
- 5. Щелочными металлами называются химические элементы-металлы IA группы Периодической системы Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
- 6. Щелочные металлы
- 7. Слайд 7
- 8. Слайд 8
- 9. ЗапомниС увеличением порядкового номера атомный радиус увеличивается,
- 10. Слайд 10
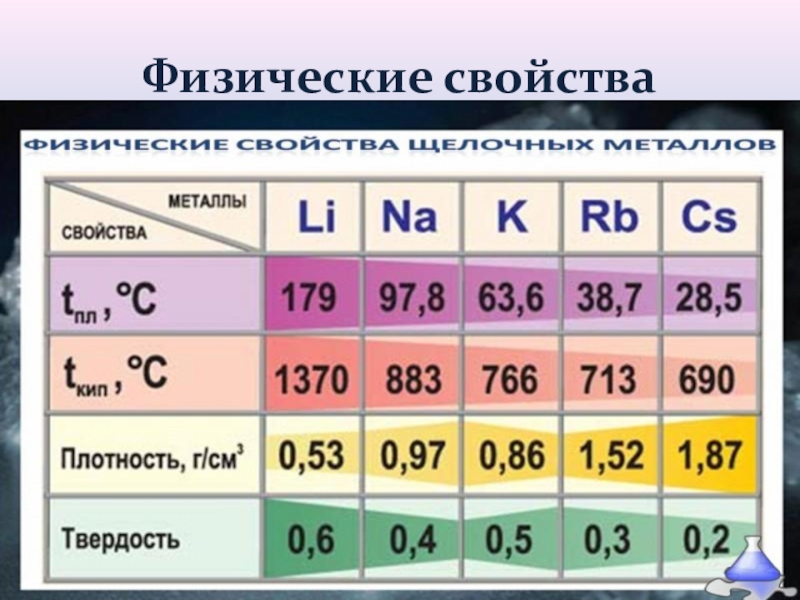
- 11. Физические свойства
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Нахождение в природе Na-2,64% (по массе), K-2,5% (по
- 19. Li Li2O • Al2O3 • 4SiO2 – сподумен
- 20. Na NaCl – поваренная соль (каменная соль), галит
- 21. Слайд 21
- 22. NaNO3 – чилийская селитра
- 23. Na3AlF6 - криолит
- 24. Na2B4O7· 10H2O - бура
- 25. K KCl • NaCl – сильвинит
- 26. KCl • MgCl2 • 6H2O – карналлит
- 27. K2O • Al2O3 • 6SiO2 – полевой шпат (ортоклаз)
- 28. Химические свойстваТипичные металлы, очень сильные восстановители. В
- 29. Реакция с кислородом: 4Li + O2 → 2Li2O(оксид лития)2Na + O2 → Na2O2 (пероксид натрия)K + O2 → KO2 (надпероксид калия)
- 30. В реакциях с другими неметаллами образуются бинарные
- 31. Опыт 12 Li + 2 H2O = 2 LiOH + H22 Na + 2
- 32. Реакция с кислотами:2Na + 2HCl → 2NaCl + H2
- 33. Качественная реакция на катионы щелочных металлов
- 34. Слайд 34
- 35. Получение ЭЛЕКТРОМЕТАЛЛУРГИЯЭлектролиз расплавов.Например:
- 36. Получение натрияНатрий можно получить, прокаливая соду с
- 37. Получение Лития получают электролизом расплава хлорида лития, который
- 38. КалийКалий получают, пропуская пары натрия через расплав
- 39. Рубидий и цезий получают восстановлением их хлоридов
- 40. Слайд 40
- 41. Слайд 41
- 42. Закрепление1. В какой группе периодической системы находятся
- 43. Закрепление4. Каким методом английский химик Гемфри Дэви
- 44. Отгадайте ребусы, расположите представленные металлы в порядке возрастания относительной атомной массы.
- 45. ОтветОтвет: 1 литий; 2 натрий, 3 калий, 4 рубидий.
- 46. Где спрятался натрий.Ответ: 5.
- 47. Соотнесите перевод названия металла с арабского и
- 48. ответ Li – 6 – камень; Na
- 49. Домашнее заданиеПараграф 43Задание 4 ,тестыНапишите уравнения реакций, позволяющих осуществить следующие превращения:
- 50. Спасибо за урок!
Методы урока: проблемные, поисково-исследовательские, самостоятельная работа учащихся. Цели урока Образовательные: на основе атомного строения металлов, физических и химических свойств, показать черты сходства и различия щелочных металлов; проследить межпредметные связи химии с биологией, физикой, медициной, используя области
Слайд 2Методы урока:
проблемные, поисково-исследовательские, самостоятельная работа учащихся.
Цели урока
Образовательные: на
основе атомного строения металлов, физических и химических свойств, показать черты сходства и различия щелочных металлов;
проследить межпредметные связи химии с биологией, физикой, медициной, используя области применения основных соединений щелочных металлов;
раскрыть значение и роль щелочных металлов в жизни человека.
проследить межпредметные связи химии с биологией, физикой, медициной, используя области применения основных соединений щелочных металлов;
раскрыть значение и роль щелочных металлов в жизни человека.
Слайд 3Загадки
Первый слог – предлог известный.
Слог второй трудней найти:
Часть его составит цифра,
К
ней добавьте букву Й.
Чтобы целое узнать,
Нужно Вам металл назвать.
Ответ : Натрий
Ответ : Натрий
Слайд 4Угадай !
Соединения этого металла способствуют быстрому росту животных и регулирует сердечную
деятельность. Назовите металл.
Ответ: кальций.
Что объединяет эти металлы ?
Ответ: кальций.
Что объединяет эти металлы ?
Слайд 5Щелочными металлами
называются химические элементы-металлы IA группы Периодической системы Д. И. Менделеева:
литий Li,
натрий Na,
калий K,
рубидий Rb,
цезий Cs и
франций Fr.
Слайд 9Запомни
С увеличением порядкового номера атомный радиус увеличивается, способность отдавать валентные электроны
увеличивается и восстановительная активность увеличивается: Цезий
Рубидий
Рубидий
Литий
Натрий
Калий
Слайд 18Нахождение в природе
Na-2,64% (по массе),
K-2,5% (по массе),
Li, Rb, Cs -
значительно меньше,
Fr- искусственно полученный элемент
Fr- искусственно полученный элемент
сильвинит.
галит (каменная соль).
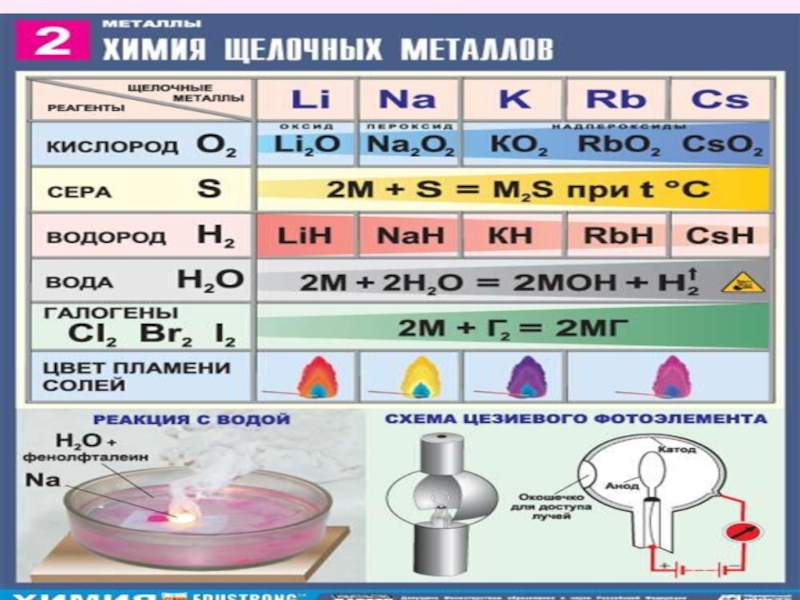
Слайд 28Химические свойства
Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень
окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла.
Слайд 29Реакция с кислородом:
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2 (пероксид натрия)
K
+ O2 → KO2 (надпероксид калия)
Слайд 30В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl
(галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
Слайд 31Опыт 1
2 Li + 2 H2O = 2 LiOH + H2
2 Na + 2 H2O = 2 NaOH + H2
2 K + 2 H2O = 2
KOH + H2
Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь - гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь - гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
Слайд 33 Качественная реакция на катионы щелочных металлов — окрашивание пламени в
следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
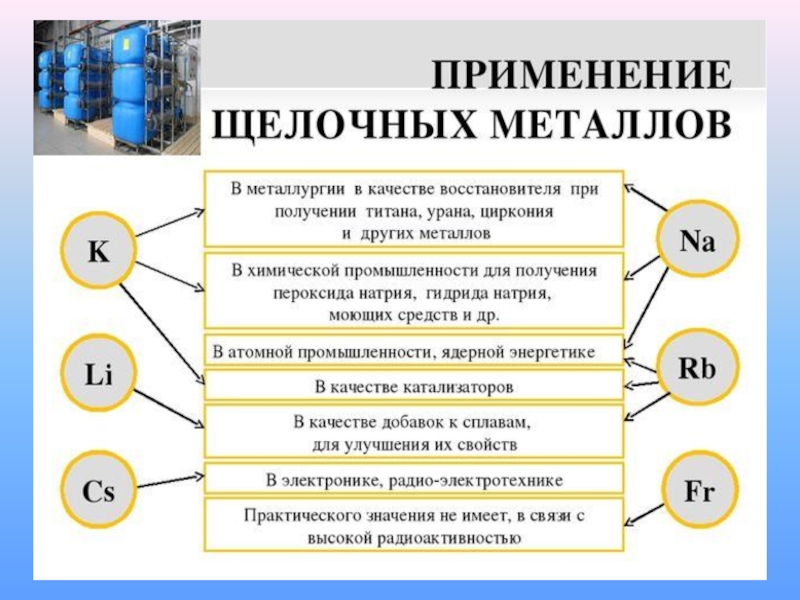
Слайд 35Получение
ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электролиз расплавов.
Например:
t
NaCl = Na+ + Cl-
расплав
K Na+ + ē = Na0 2
A 2Cl- - 2ē = Cl2↑ 1
эл-лиз
2NaСl → 2Na + Cl2↑
NaCl = Na+ + Cl-
расплав
K Na+ + ē = Na0 2
A 2Cl- - 2ē = Cl2↑ 1
эл-лиз
2NaСl → 2Na + Cl2↑
Слайд 36Получение натрия
Натрий можно получить, прокаливая соду с углем в закрытых тиглях,
пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO.
Na2CO3 + 2C = 2Na + 3CO.
Слайд 37Получение
Лития
получают электролизом расплава хлорида лития, который образуется при переработке сподумена. Переработка
сподумена – процесс довольно сложный, включает стадии получения алюмината лития, гидроксида лития и хлорида лития:
2LiCl 2Li + Cl2.
Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4.
2LiCl 2Li + Cl2.
Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4.
Слайд 38Калий
Калий получают, пропуская пары натрия через расплав хлорида калия при 800°С,
выделяющие пары калия конденсируют:
KCl + Na = K + NaCl
или при взаимодействии между расплавленным гидроксидом калия и жидким натрием при 440°С:
KOH + Na = K + NaOH.
KCl + Na = K + NaCl
или при взаимодействии между расплавленным гидроксидом калия и жидким натрием при 440°С:
KOH + Na = K + NaOH.
Слайд 39Рубидий и цезий
получают восстановлением их хлоридов кальцием при 700–800 °С:
2RbCl +
Ca = 2Rb + CaCl2,
в качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2.
в качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2.
Слайд 42Закрепление
1. В какой группе периодической системы находятся щелочные металлы?
Ответ: в первой;
2. Этот
металл был открыт в 1817 году при исследовании минерала петалита. Назовите металл и кто его открыл?
Ответ: металл – литий, учёный Арфведсен;
3. Какой металл первоначально называли легион?
Ответ: литий;
Ответ: металл – литий, учёный Арфведсен;
3. Какой металл первоначально называли легион?
Ответ: литий;
Слайд 43Закрепление
4. Каким методом английский химик Гемфри Дэви впервые получил щелочной металл,
названный им “потассий”?
Ответ: электролиз.
5. В какой цвет окрашивают пламя ионы щелочного металла калия?
Ответ: фиолетовый.
Ответ: электролиз.
5. В какой цвет окрашивают пламя ионы щелочного металла калия?
Ответ: фиолетовый.
Слайд 44 Отгадайте ребусы, расположите представленные металлы в порядке возрастания относительной атомной
массы.
Слайд 47Соотнесите перевод названия металла с арабского и латинского с соответствую-щим металлом:
Li
– 1 – небесно-голубой;
Na – 2 – тёмно-красный;
K – 3 – тяжёлый;
Rb – 4 – алкали;
Cs – 5 – сода;
Ca – 6 – камень;
Ba – 7 – известь.
Слайд 48ответ
Li – 6 – камень;
Na – 5 – сода;
K – 4
– алкали;
Rb – 2 – тёмно-красный;
Cs – 1 – небесно-голубой;
Ca – 7 – известь;
Ba – 3 – тяжёлый.