- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 9 класс на тему Сущность процесса электролитической диссоциации
Содержание
- 1. Презентация по химии 9 класс на тему Сущность процесса электролитической диссоциации
- 2. ЦЕЛЬСформировать понятие о процессе электролитической диссоциации; продолжить формировать знания об электролитах и неэлектролитах;
- 3. ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫЗнать понятия: «электролиты», «неэлектролиты», «катион», «анион»,
- 4. ПРОВЕРКА РАННЕЕ ИЗУЧЕННОГО1. Куда сместится равновесие при
- 5. Фарадей Майкл22. IX.1791 – 25.VIII. 1867Английский физик
- 6. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД)В 1887 году шведский
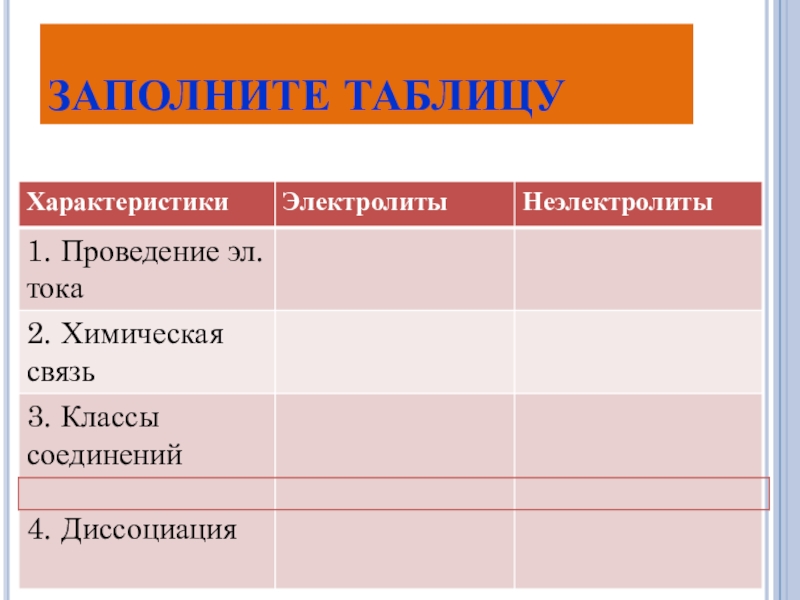
- 7. ЗАПОЛНИТЕ ТАБЛИЦУ
- 8. Слайд 8
- 9. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 1 ПОЛОЖЕНИЕВсе вещества
- 10. Процесс распада электролита на ионы называется электролитической диссоциацией.Химический словарь
- 11. 2 ПОЛОЖЕНИЕПри растворении в воде электролиты диссоциируют
- 12. ИОНЫ - это положительно или
- 13. ЧЕМ ОТЛИЧАЕТСЯ МЕТАЛЛИЧЕСКИЙ НАТРИЙ ОТ ИОНА НАТРИЯ?Атом
- 14. Na0легко отдает электроны, взаимодействует с водой
- 15. ИОНЫ – ЗАРЯЖЕННЫЕ ЧАСТИЦЫ простые
- 16. 3 ПОЛОЖЕНИЕПричиной диссоциации электролита является его взаимодействие
- 17. Нагревание усиливает колебания ионов в узлах кристаллической
- 18. МЕХАНИЗМ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮОриентация
- 19. СУЩНОСТЬ ПРОЦЕССА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ
- 20. + -+ -+
- 21. РЕФЛЕКСИЯЯ умею определять ….. и …..Я умею
- 22. ДОМАШНЕЕ ЗАДАНИЕ§6 прочитать, выучить основные определения.Выполнить письменно зад. 3,4 ст 25
Слайд 2ЦЕЛЬ
Сформировать понятие о процессе электролитической диссоциации; продолжить формировать знания об электролитах
Слайд 3ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ
Знать понятия: «электролиты», «неэлектролиты», «катион», «анион», «электролитическая диссоциация»;
Уметь: составлять реакции
Понимать: взаимосвязь строения и свойства веществ.
Слайд 4ПРОВЕРКА РАННЕЕ ИЗУЧЕННОГО
1. Куда сместится равновесие при понижении температуры.
2. При повышении
3. При повышении температуры.
4. При использовании катализатора.
5. При повышении концентрации продукта реакции.
Слайд 5Фарадей Майкл
22. IX.1791 – 25.VIII. 1867
Английский физик и химик.
В первой
об электролитах и неэлектролитах.
Слайд 6ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД)
В 1887 году шведский учёный
С. Аррениус для объяснения
особенностей
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными.
Сванте Аррениус
Слайд 8
Электролиты – Неэлектролиты –
проводят эл.ток в растворах не проводят эл. ток в растворах
Тип химической связи: Тип химической связи:
ионная, ковалентная неполярная и
сильнополярная слабополярная
К ним относятся вещества: К ним относятся вещества:
соли простые вещества
кислоты оксиды неметаллов
основания органические вещества
Слайд 9
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
1 ПОЛОЖЕНИЕ
Все вещества по их способности проводить электрический ток
К электролитам относятся все растворимые соли, кислоты, основания (щелочи)
К неэлектролитам относятся все нерастворимые соли, основания, кислоты, простые вещества, оксиды и органические вещества
При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы
Слайд 10Процесс распада электролита на ионы называется электролитической диссоциацией.
Химический словарь
Слайд 112 ПОЛОЖЕНИЕ
При растворении в воде электролиты диссоциируют (распадаются) на положительные и
Ионы – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких элементов в результате отдачи или присоединения электронов
В переводе с греческого «ион» - «странствующий»
Слайд 12 ИОНЫ - это положительно или отрицательно заряженные частицы, в
Химический СЛОВАРЬ
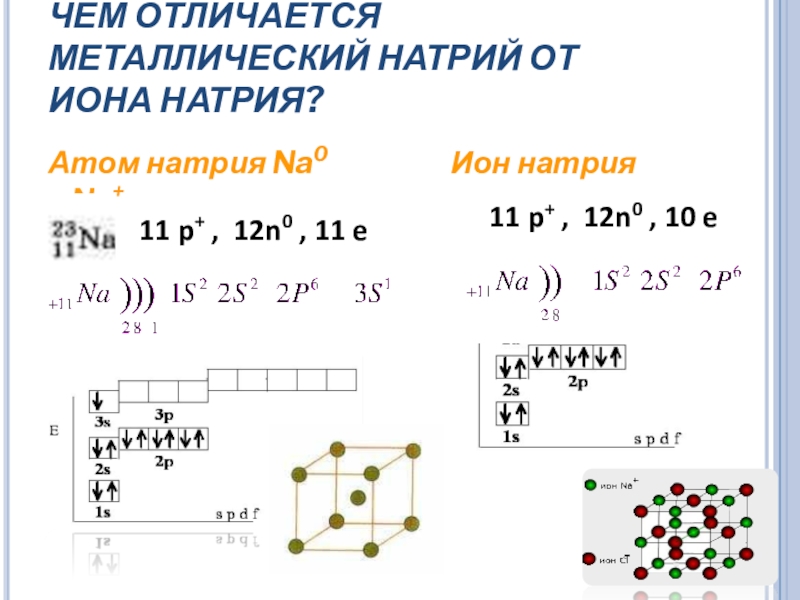
Слайд 13ЧЕМ ОТЛИЧАЕТСЯ МЕТАЛЛИЧЕСКИЙ НАТРИЙ ОТ ИОНА НАТРИЯ?
Атом натрия Na0
11 p+ , 12n0 , 10 e
11 p+ , 12n0 , 11 e
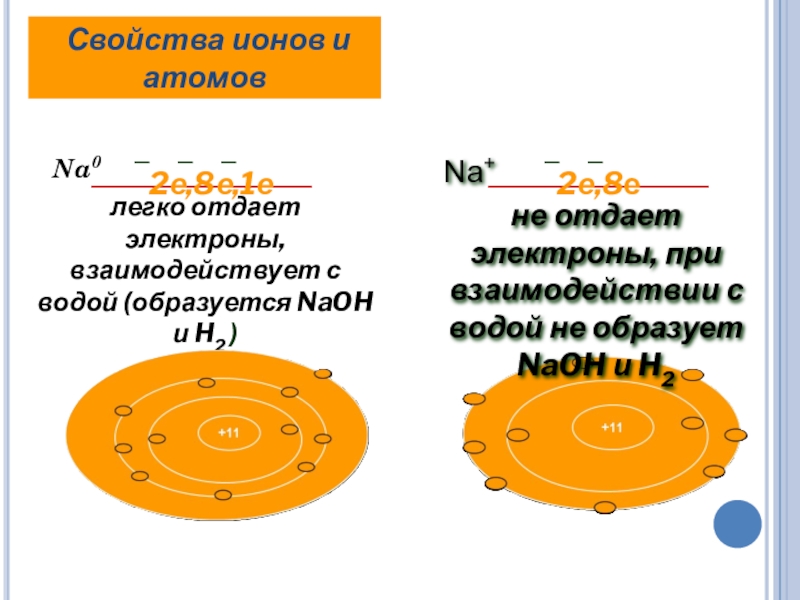
Слайд 14 Na0
легко отдает электроны, взаимодействует с водой (образуется NaOH и H2
Свойства ионов и атомов
Na+
не отдает электроны, при взаимодействии с водой не образует NaOH и H2
─ ─ ─
2е,8е,1е
─ ─
2е,8е
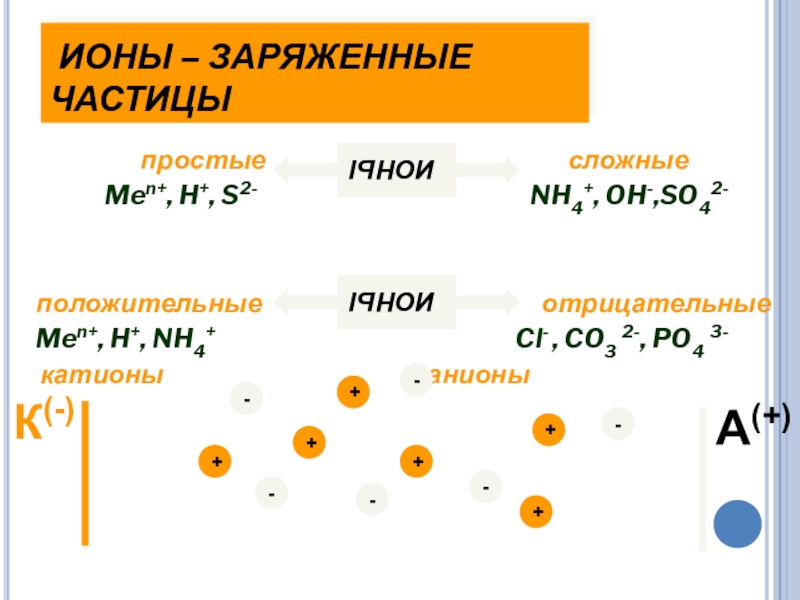
Слайд 15 ИОНЫ – ЗАРЯЖЕННЫЕ ЧАСТИЦЫ
простые
Men+, H+, S2- NH4+, OH-,SO42-
положительные отрицательные
Men+, H+, NH4+ Cl- , CO3 2-, PO4 3-
катионы анионы
ИОНЫ
ИОНЫ
К(-)
А(+)
-
-
-
-
-
-
+
+
+
+
+
+
Слайд 163 ПОЛОЖЕНИЕ
Причиной диссоциации электролита является его взаимодействие с молекулами воды и
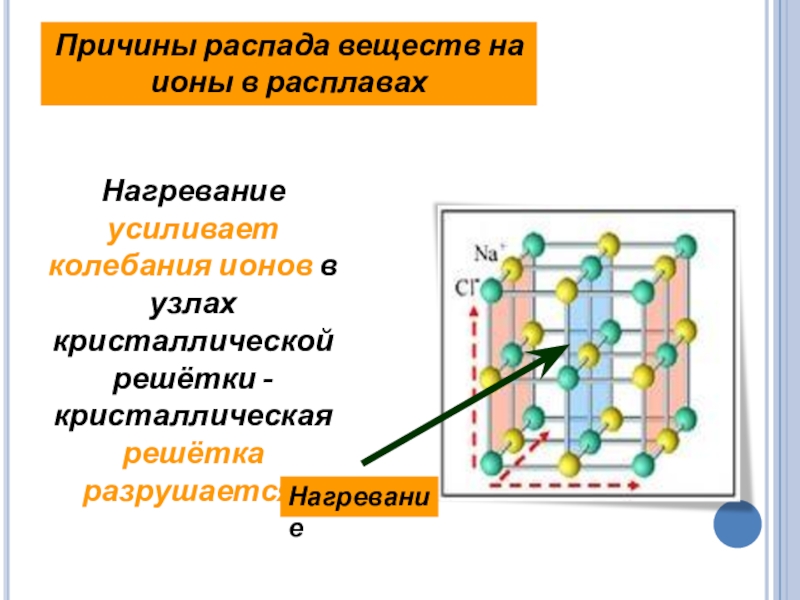
Слайд 17Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается.
Причины
Нагревание
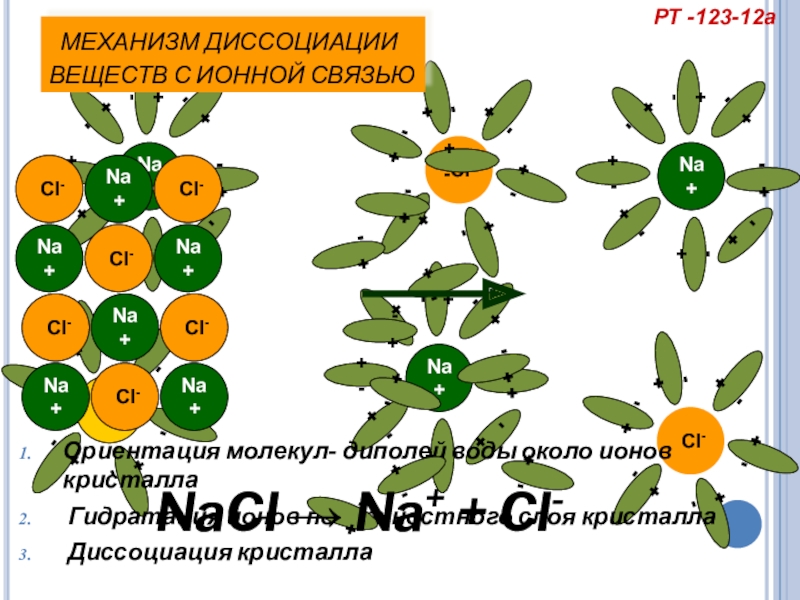
Слайд 18 МЕХАНИЗМ ДИССОЦИАЦИИ
ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ
Ориентация молекул- диполей воды около ионов
Гидратация ионов поверхностного слоя кристалла
Диссоциация кристалла
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
NaCl → Na+ + Cl-
РТ -123-12а
Слайд 19СУЩНОСТЬ ПРОЦЕССА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ
ориентация молекул воды
гидратация (взаимодействие) молекул воды с молекулами электролита
ионизация молекул электролита (превращение ковалентной полярной связи в ионную)
диссоциация (распад) молекул электролита на гидратированные ионы
Слайд 20+ -
+ -
+ -
+
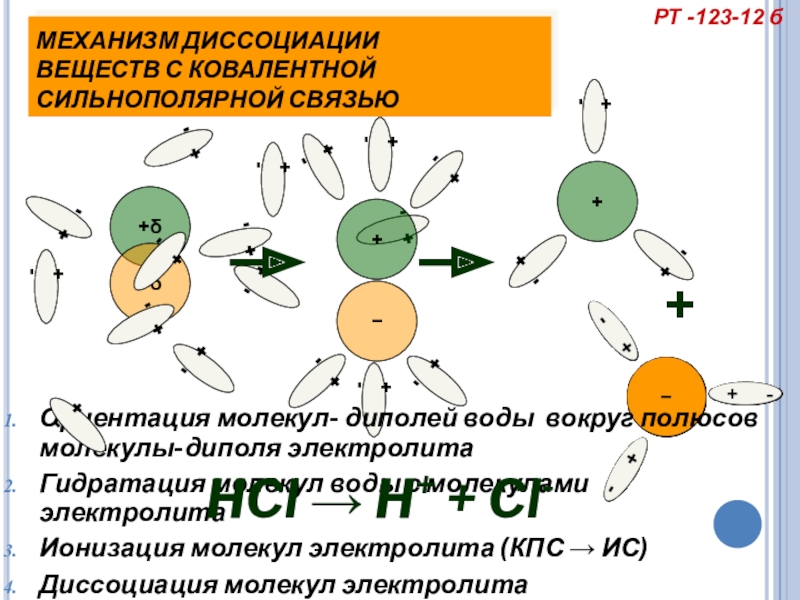
МЕХАНИЗМ ДИССОЦИАЦИИ
ВЕЩЕСТВ С КОВАЛЕНТНОЙ СИЛЬНОПОЛЯРНОЙ СВЯЗЬЮ
Ориентация молекул- диполей воды вокруг полюсов молекулы-диполя электролита
Гидратация молекул воды с молекулами электролита
Ионизация молекул электролита (КПС → ИС)
Диссоциация молекул электролита
+δ
−δ
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+
−
+
HCl → H+ + Cl-
РТ -123-12 б
Слайд 21РЕФЛЕКСИЯ
Я умею определять ….. и …..
Я умею записывать строение … и
Я знаю, что электролиты …. …… …., а неэлектролиты ……..