- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 9 класс на тему Оксид серы VI. Серная кислота
Содержание
- 1. Презентация по химии 9 класс на тему Оксид серы VI. Серная кислота
- 2. Домашнее заданиеДаноm(HCl)=2 кгW (прим)= 10%V (H2S)-?РешениеFeS+ 2HCl=
- 3. Актуализация знаний. В трех сосудах без надписей
- 4. В 1 -водород
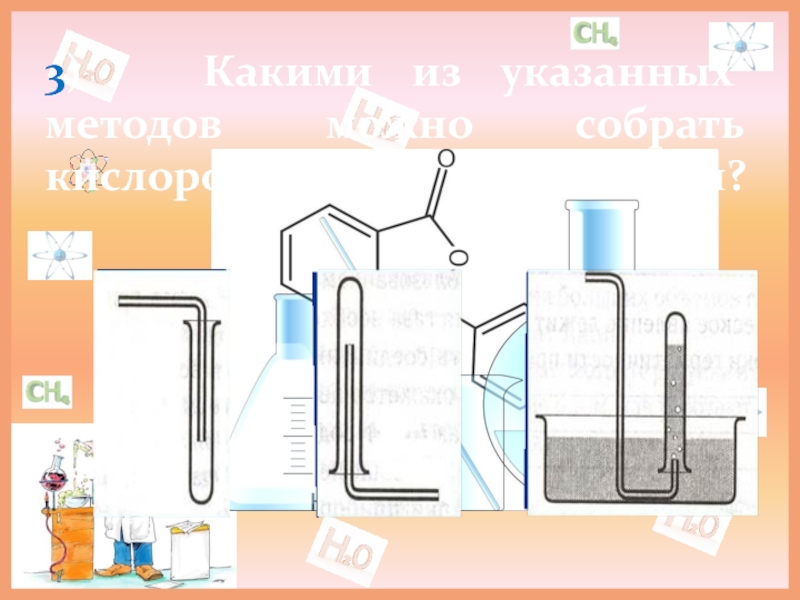
- 5. 3) Какими из указанных методов можно собрать кислород в лаборатории?
- 6. 4) Во сколько раз газ хлора,
- 7. 7.Выберите пару веществ с каждым, из которых
- 8. Физические свойства c.75
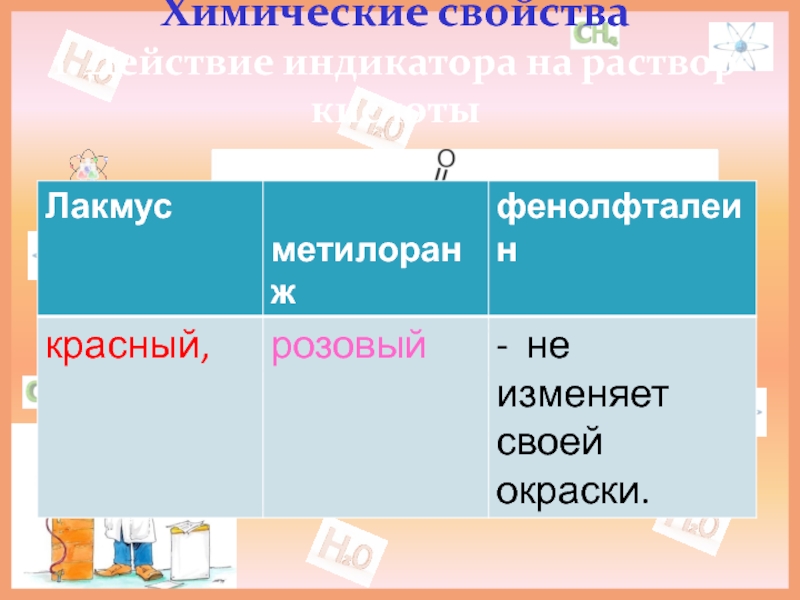
- 9. Химические свойства 1. Действие индикатора на раствор кислоты
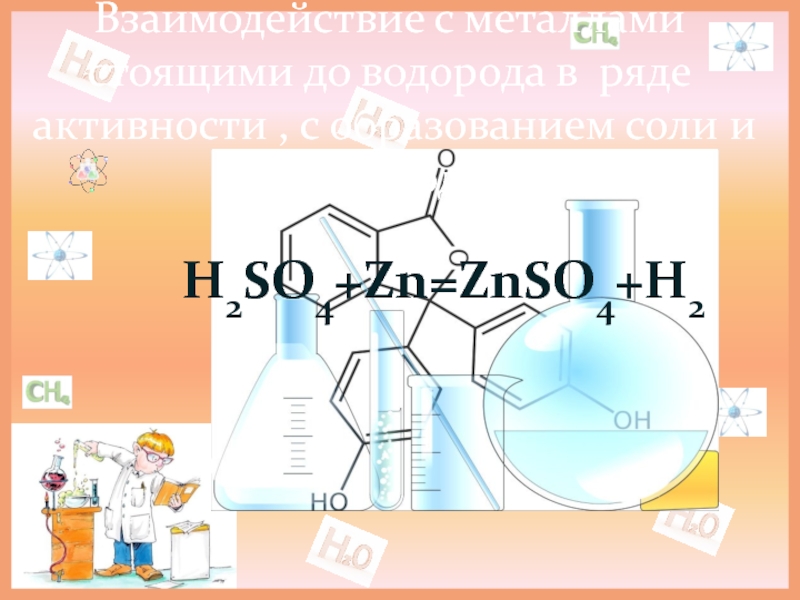
- 10. Взаимодействие с металлами стоящими до водорода в
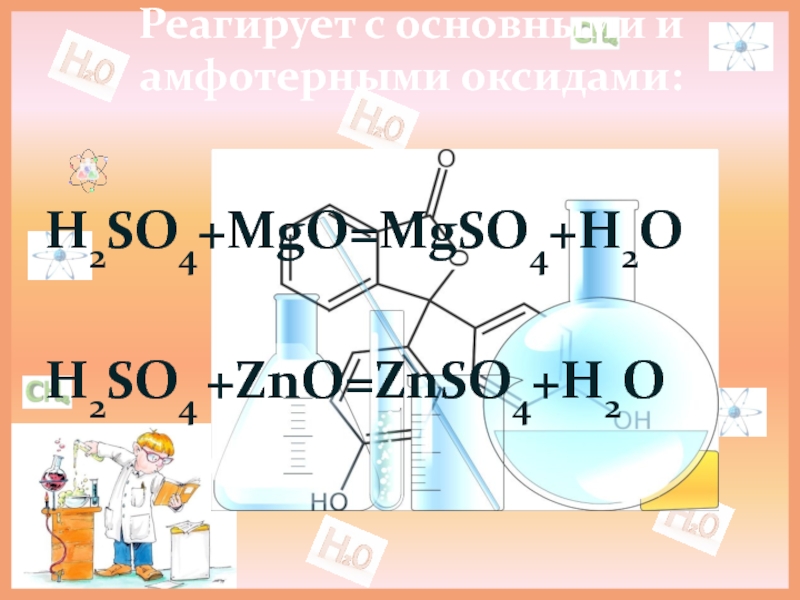
- 11. Реагирует с основными и амфотерными оксидами: H2SO4+MgO=MgSO4+H2OH2SO4 +ZnO=ZnSO4+H2O
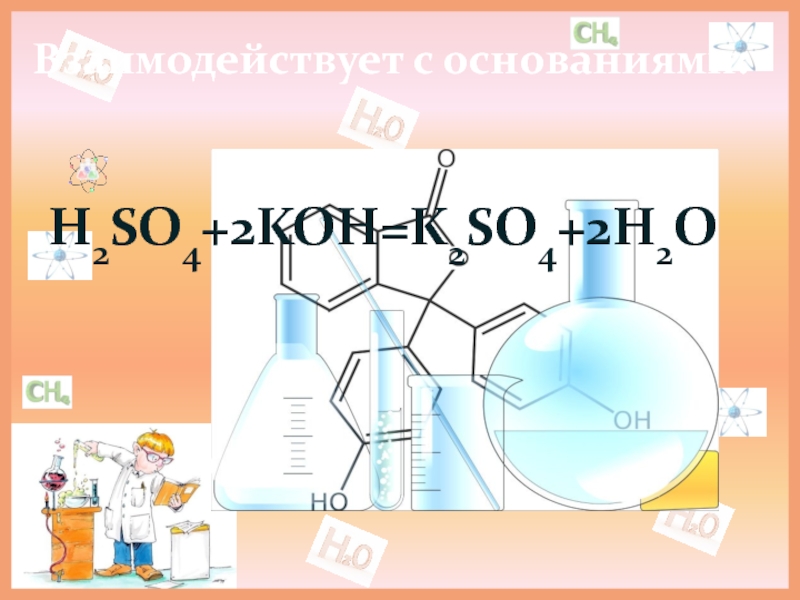
- 12. Взаимодействует с основаниями: H2SO4+2KOH=K2SO4+2H2O
- 13. Если кислота взята в избытке, то образуется кислая соль: H2SO4+NaOH=NaHSO4+H2O
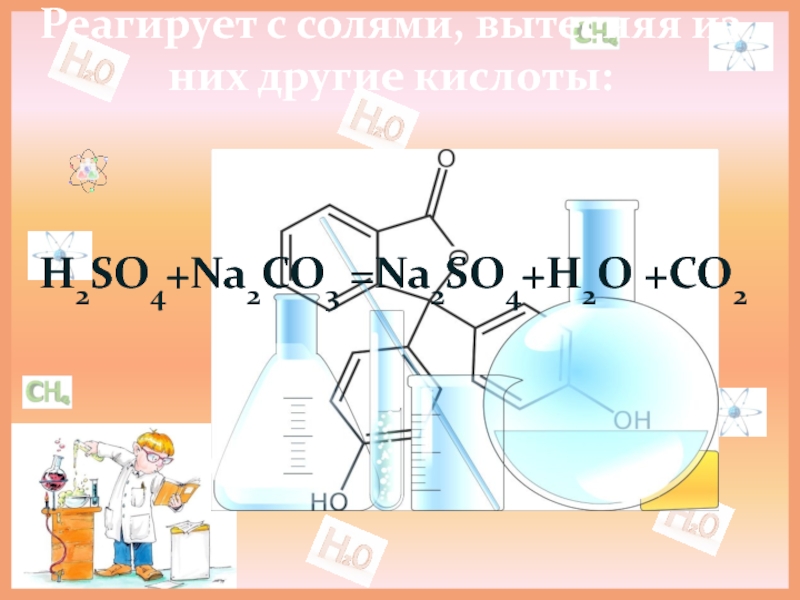
- 14. Реагирует с солями, вытесняя из них другие кислоты: H2SO4+Na2CO3 =Na2SO4+H2O +CO2
- 15. Слайд 15
- 16. Концентрированная серная кислота энергично реагирует с водой с образованием гидратов: H2SO4+nH2O=H2SO4·nH2O+Q
- 17. Характерной реакцией на серную кислоту и её
- 18. Применение серной кислотыв производстве минеральных удобрений; как
- 19. Домашнее задание: п.21 зад.2,3 а), 5 с.78
- 20. Рефлексия«Ассоциация»- каждый говорит по очереди про серную кислоту не повторяясь.
Слайд 2Домашнее задание
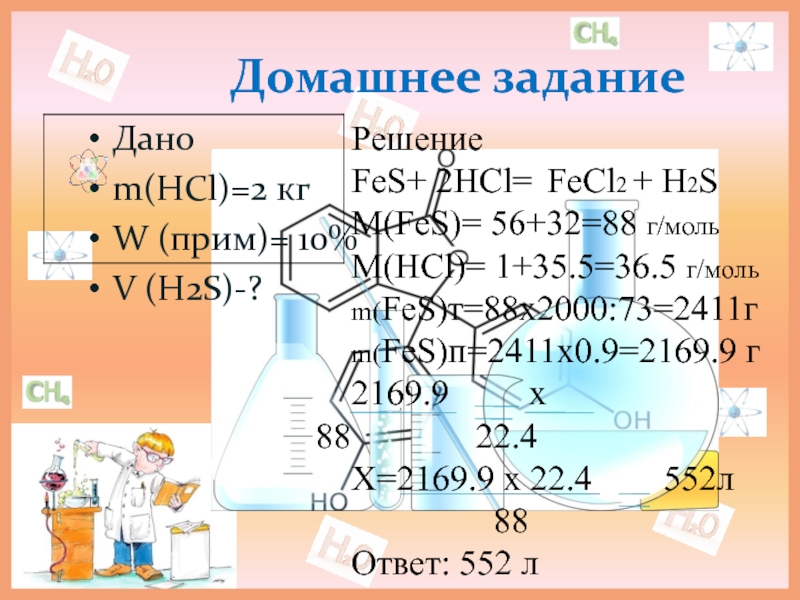
Дано
m(HCl)=2 кг
W (прим)= 10%
V (H2S)-?
Решение
FeS+ 2HCl= FeCl2 + H2S
M(FeS)= 56+32=88
М(HCl)= 1+35.5=36.5 г/моль
m(FeS)т=88х2000:73=2411г
m(FeS)п=2411х0.9=2169.9 г
2169.9 х
22.4
Х=2169.9 х 22.4 552л
88
Ответ: 552 л
Слайд 3Актуализация знаний
. В трех сосудах без надписей находятся : СО2, О2
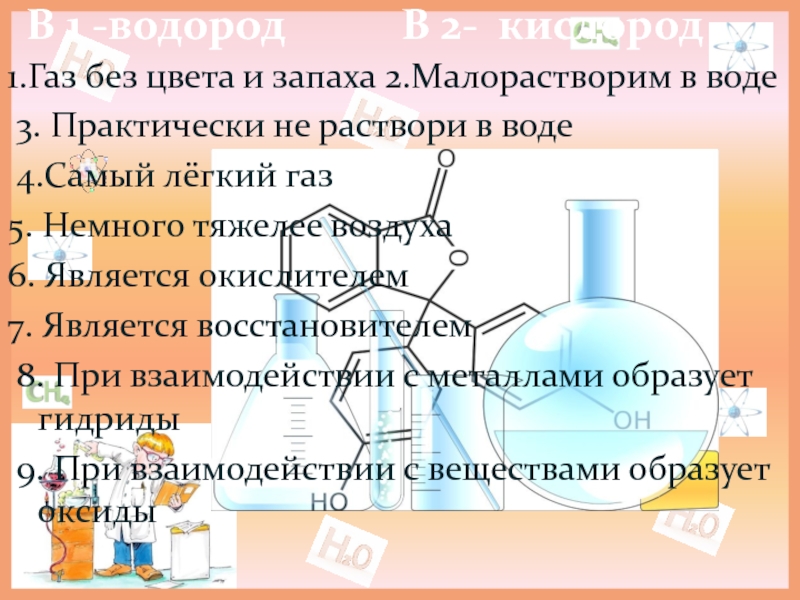
Слайд 4В 1 -водород В 2- кислород
1.Газ без цвета и запаха 2.Малорастворим в воде
3. Практически не раствори в воде
4.Самый лёгкий газ
5. Немного тяжелее воздуха
6. Является окислителем
7. Является восстановителем
8. При взаимодействии с металлами образует гидриды
9. При взаимодействии с веществами образует оксиды
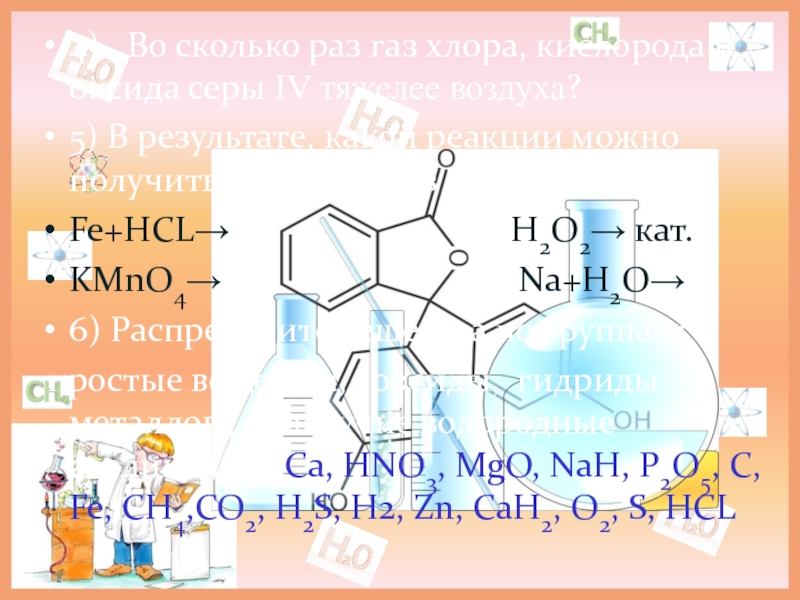
Слайд 64) Во сколько раз газ хлора, кислорода и оксида серы
5) В результате, какой реакции можно получить водород, а из какой кислород?
Fe+HCL→ H2О2→ кат.
KMnO4→ Nа+H2O→
6) Распределите вещества по группам:
простые вещества, оксиды, гидриды металлов , летучие водородные соединения : Са, HNO3, MgO, NаH, P2O5, C, Fe, CH4,CO2, H2S, H2, Zn, CаH2, O2, S, HCL
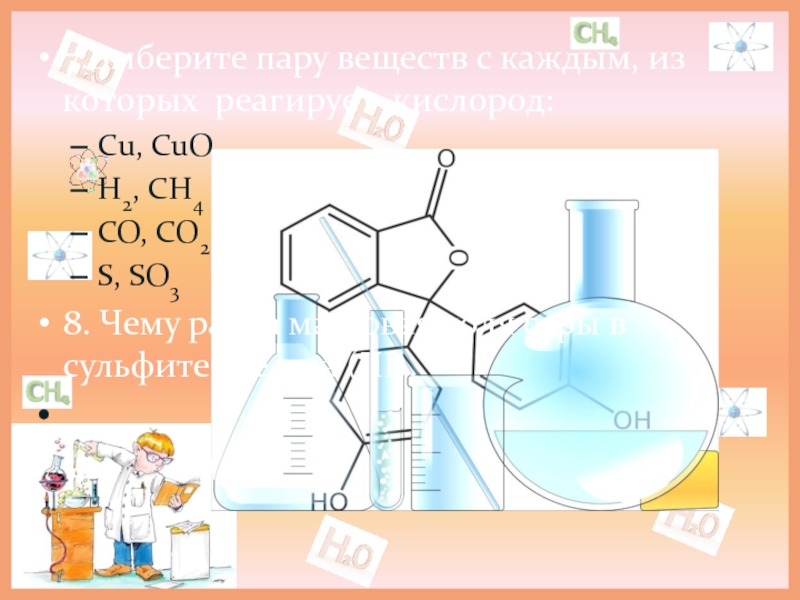
Слайд 77.Выберите пару веществ с каждым, из которых реагирует кислород:
Сu, CuO
H2, CH4
CO,
S, SO3
8. Чему равна массовая доля серы в сульфите железа (III).
Слайд 10Взаимодействие с металлами стоящими до водорода в ряде активности , с
H2SO4+Zn=ZnSO4+H2
Слайд 16
Концентрированная серная кислота энергично реагирует с водой с образованием гидратов:
H2SO4+nH2O=H2SO4·nH2O+Q
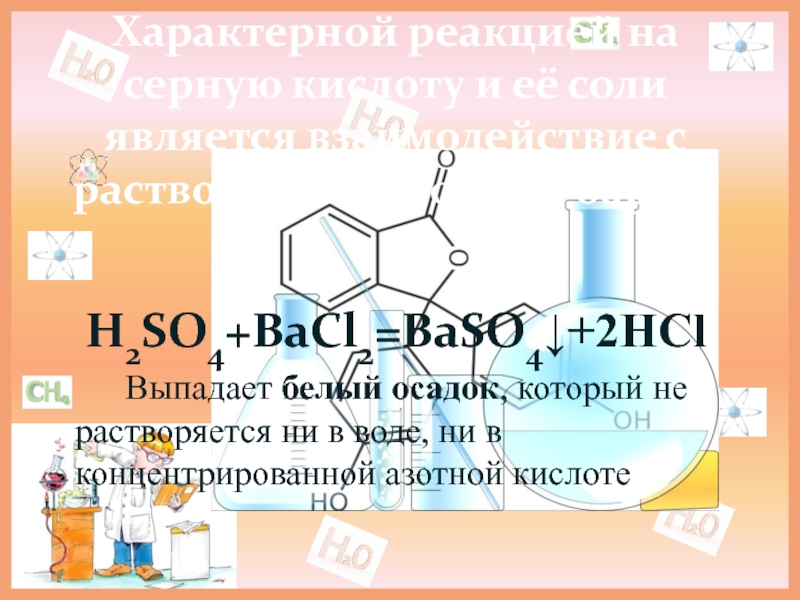
Слайд 17Характерной реакцией на серную кислоту и её соли является взаимодействие с
H2SO4+BaCl2=BaSO4↓+2HCl
Выпадает белый осадок, который не растворяется ни в воде, ни в концентрированной азотной кислоте
Слайд 18Применение серной кислоты
в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
в промышленном органическом синтезе.
Слайд 19Домашнее задание:
п.21 зад.2,3 а), 5 с.78
1) написать уравнения реакций H2SO4
2) написать уравнения реакций взаимодействия концентрированной серной кислоты с Na и Ag, расставить коэффициенты методом электронного баланса;
3) по приведенному сокращенному ионному уравнению
Ba+2 + SO42- = BaSO4
восстановите полное ионное и молекулярное уравнения;
4) учебник, параграф 23, стр. 136-140 (до «Производство серной кислоты»).