- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 8 класс Окислительно-восстановительные реакции
Содержание
- 1. Презентация по химии 8 класс Окислительно-восстановительные реакции
- 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИЦель:Усвоить понятия: окисление, восстановление, окислитель, восстановитель.Научиться составлять уравнения методом электронного баланса.
- 3. ХИМИЧЕСКИЕ РЕАКЦИИ(по изменению степени окисления элементов, образующих
- 4. ХИМИЧЕСКИЕ РЕАКЦИИ, В РЕЗУЛЬТАТЕ КОТОРЫХ ПРОИСХОДИТ ИЗМЕНЕНИЕ
- 5. ВОССТАНОВЛЕНИЕ – ПРОЦЕСС ПРИСОЕДИНЕНИЯ ЭЛЕКТРОНОВ АТОМАМИ, ИОНАМИ
- 6. Cl0 + 1e → Cl-1атом
- 7. ОКИСЛЕНИЕ- ПРОЦЕСС ОТДАЧИ ЭЛЕКТРОНОВ АТОМАМИ, ИОНАМИ ИЛИ
- 8. Al0 – 3e → Al+3
- 9. ПОВТОРЕНИЕ: ОПРЕДЕЛЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В
- 10. ЗАДАНИЕ: РАССТАВИТЬ СТЕПЕНИ ОКИСЛЕНИЯ ВСЕХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
- 11. ЗАДАНИЕ: РАССТАВИТЬ СТЕПЕНИ ОКИСЛЕНИЯ ВСЕХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
- 12. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ РЕАКЦИЯ 0
- 13. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЯ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСАРасставить
- 14. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА1. Над символом каждого элемента
- 15. Слайд 15
- 16. 4. Сравните число отданных и принятых электронов.
- 17. 5. Перенесите основные коэффициенты в уравнение реакции.
- 18. СОСТАВИТЬ УРАВНЕНИЕ РЕАКЦИИ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСАCu +
Слайд 2ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель:
Усвоить понятия: окисление, восстановление, окислитель, восстановитель.
Научиться составлять уравнения методом электронного
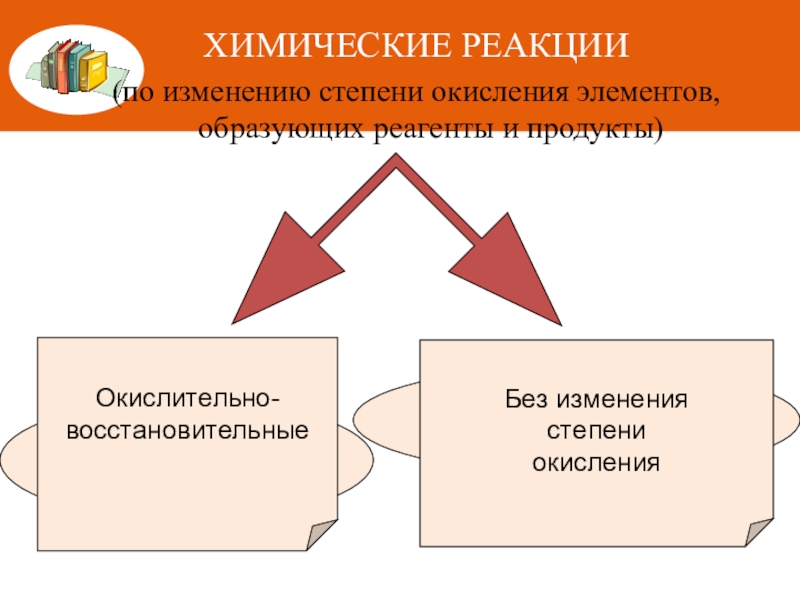
Слайд 3ХИМИЧЕСКИЕ РЕАКЦИИ
(по изменению степени окисления элементов, образующих реагенты и продукты)
+1
AgNO3 + HCl = AgCl + HNO3
+1 -1 0 +2 -1 0
2HCl + Zn = ZnCl2 + H2
Окислительно-
восстановительные
Без изменения
степени
окисления
Слайд 4
ХИМИЧЕСКИЕ РЕАКЦИИ,
В РЕЗУЛЬТАТЕ КОТОРЫХ
ПРОИСХОДИТ ИЗМЕНЕНИЕ
СТЕПЕНЕЙ ОКИСЛЕНИЯ
АТОМОВ ХИМИЧЕСКИХ
ЭЛЕМЕНТОВ ИЛИ ИОНОВ,
ОБРАЗУЮЩИХ
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
НАЗЫВАЮТСЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫМИ
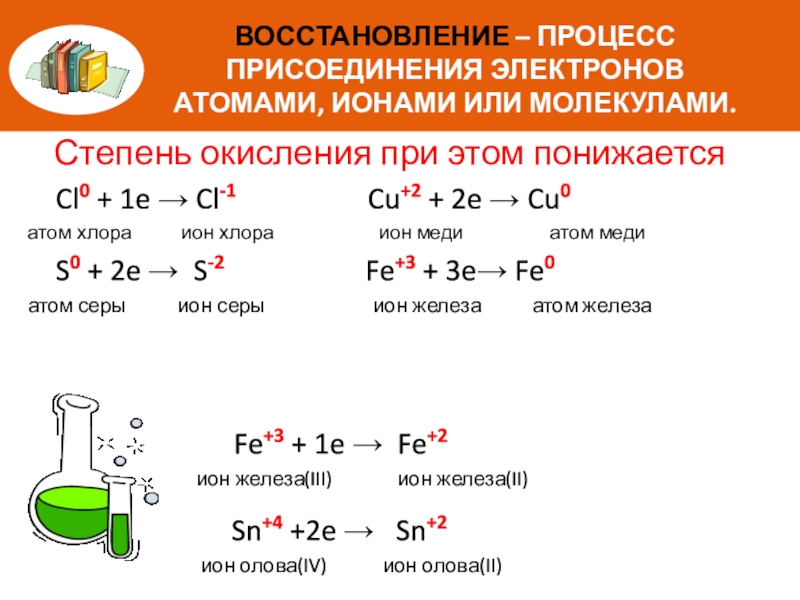
Слайд 5ВОССТАНОВЛЕНИЕ – ПРОЦЕСС ПРИСОЕДИНЕНИЯ ЭЛЕКТРОНОВ АТОМАМИ, ИОНАМИ ИЛИ МОЛЕКУЛАМИ.
Степень окисления при
Cl0 + 1e → Cl-1 Cu+2 + 2e → Cu0
атом хлора ион хлора ион меди атом меди
S0 + 2e → S-2 Fe+3 + 3e→ Fe0
атом серы ион серы ион железа атом железа
Fe+3 + 1e → Fe+2
ион железа(III) ион железа(II)
Sn+4 +2e → Sn+2
ион олова(IV) ион олова(II)
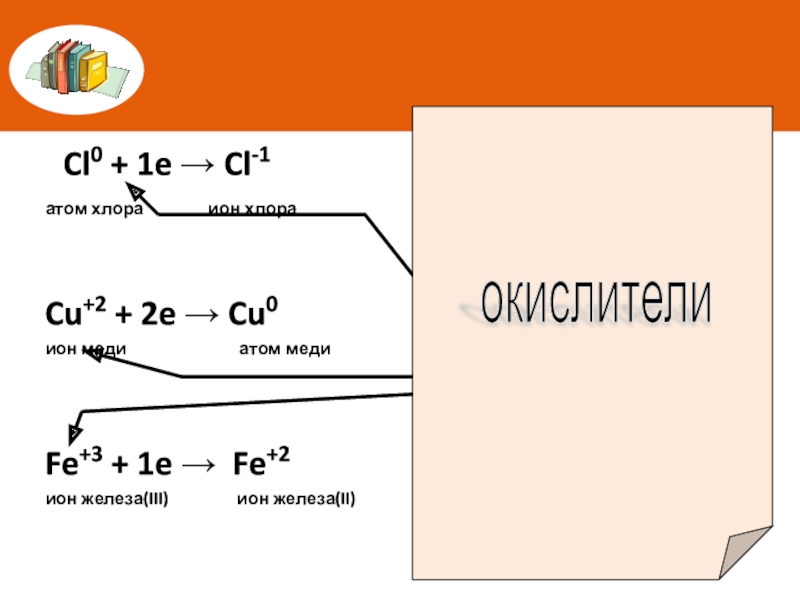
Слайд 6 Cl0 + 1e → Cl-1
атом хлора
Cu+2 + 2e → Cu0
ион меди атом меди
Fe+3 + 1e → Fe+2
ион железа(III) ион железа(II)
Атомы, ионы или молекулы, принимающие электроны, называют окислителями
окислители
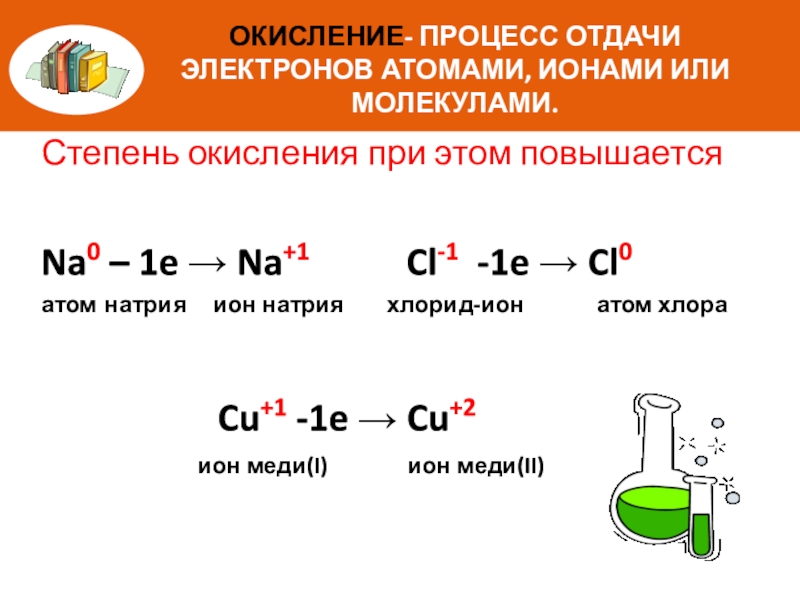
Слайд 7ОКИСЛЕНИЕ- ПРОЦЕСС ОТДАЧИ ЭЛЕКТРОНОВ АТОМАМИ, ИОНАМИ ИЛИ МОЛЕКУЛАМИ.
Степень окисления при этом
Na0 – 1e → Na+1 Cl-1 -1e → Cl0
атом натрия ион натрия хлорид-ион атом хлора
Cu+1 -1e → Cu+2
ион меди(I) ион меди(II)
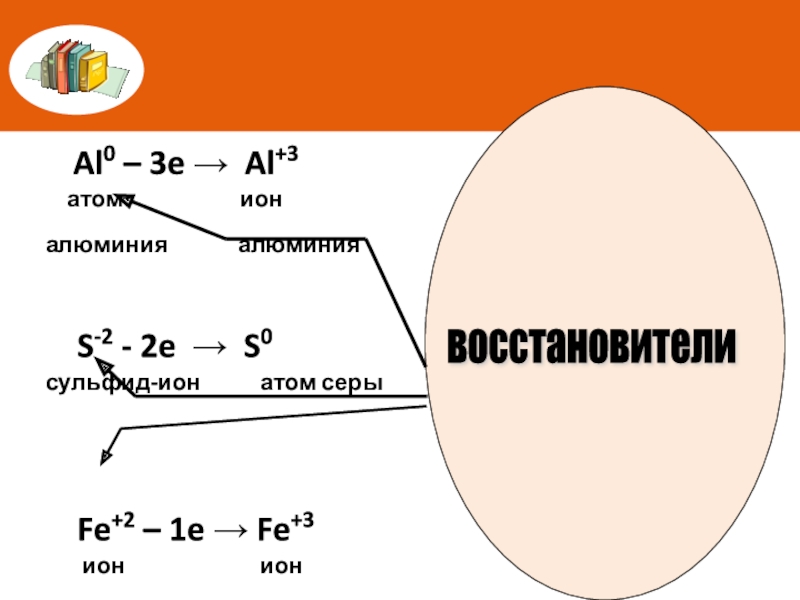
Слайд 8 Al0 – 3e → Al+3
атом
алюминия алюминия
S-2 - 2e → S0
сульфид-ион атом серы
Fe+2 – 1e → Fe+3
ион ион
железа(II) железа(III)
Атомы, ионы или молекулы, отдающие электроны, называют восстановителями
восстановители
Слайд 9ПОВТОРЕНИЕ: ОПРЕДЕЛЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В ФОРМУЛЕ ВЕЩЕСТВА.
Правила:
Отрицательная
Высшая положительная степень окисления = № группы.
Сумма степеней окисления всех атомов одной молекулы = 0
Слайд 10ЗАДАНИЕ: РАССТАВИТЬ СТЕПЕНИ ОКИСЛЕНИЯ ВСЕХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
CuSO4
Fe2(SO4)3 Mg(NO3)3 SO3 N2O5 CrCl3
Ca3(PO4)2 H2SiO3 Zn(OH)3 BaSO4
Al2(SO4)3 CuO H3PO4 SO3 SO2 CuCl2
Слайд 11ЗАДАНИЕ: РАССТАВИТЬ СТЕПЕНИ ОКИСЛЕНИЯ ВСЕХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
+2
CuSO4 Al(OH)3 H2SO4 Fe2O3 CO2
+3 +6 -2 +2 +5 -2 +6 -2 +5 -2 +6 -
Fe2(SO4)3 Mg(NO3)3 SO3 N2O5 CrCl3
+2 +5 -2 + +4 -2 +2 -2 + +2 +6 -2
Ca3(PO4)2 H2SiO3 Zn(OH)3 BaSO4
+3 +6 -2 +2 -2 + +5 -2 +6 -2 +4 -2 +2 -
Al2(SO4)3 CuO H3PO4 SO3 SO2 CuCl2
Слайд 12ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ РЕАКЦИЯ
0 0
Mg + Cl2 = Mg Cl2
0 _ +2
Mg – 2e = Mg окисление
0 _ -1
Cl2 + 2e = 2Cl восстановление
Mg – восстановитель; Cl2 - окислитель
Слайд 13АЛГОРИТМ
СОСТАВЛЕНИЯ УРАВНЕНИЯ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
Расставить степени окисления каждого элемента
Подчеркнуть элементы,
Составить уравнения окисления и восстановления
Выписать количество отданных и принятых электронов
Найти наименьшее кратное от количества отданных и принятых электронов
Разделить наименьшее кратное на количество отданных и принятых электронов – получатся коэффициенты
Перенести коэффициенты в уравнение, продолжить расстановку коэффициентов обычным способом
Слайд 14МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
1. Над символом каждого элемента напишите его степень окисления
0 -1 +5 -2 -1 +6 -2 +4 -2 +1 -2
S + HNO3 → H2SO4 + NO2 + H2O
Слайд 15 0 -1 +5
2. Найдите элемент, атомы которого понижают СО. Определите число принятых атомом электронов.
+5 +4
N + 1e → N
3. Найдите элемент, атомы которого повышают СО. Определите число отданных атомом электронов.
0 +6
S – 6e → S
Слайд 164. Сравните число отданных и принятых электронов. Если они не равны,
+5 +4
N + 1e → N 6 (восстановление)
0 +6
S – 6e → S 1(окисление)
окислитель
восстановитель
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Слайд 17
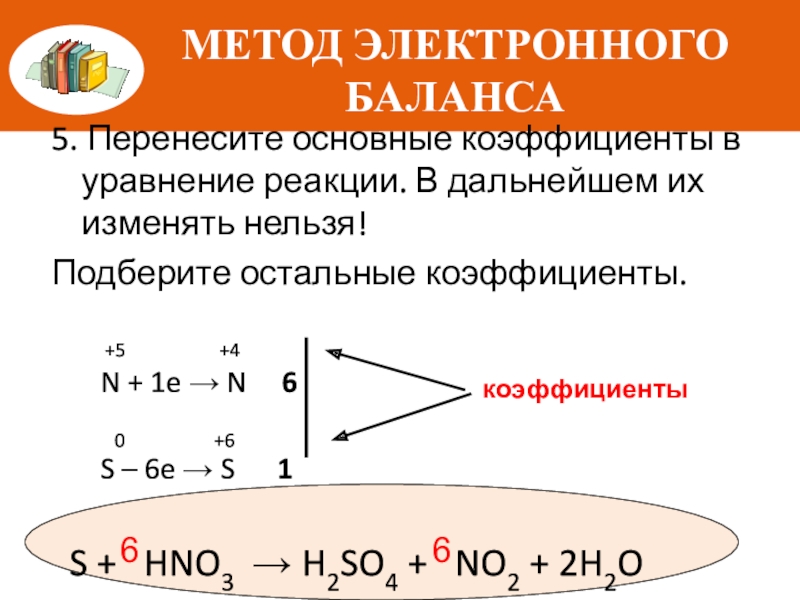
5. Перенесите основные коэффициенты в уравнение реакции. В дальнейшем их изменять
Подберите остальные коэффициенты.
+5 +4
N + 1e → N 6
0 +6
S – 6e → S 1
S + HNO3 → H2SO4 + NO2 + 2H2O
коэффициенты
6
6
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Слайд 18СОСТАВИТЬ УРАВНЕНИЕ РЕАКЦИИ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
Cu + H2SO4(k) ? CuSO4 +
K + HNO3(p) ? KNO3 + NH4NO3 + H2O
Zn + H2SO4(k) ? ZnSO4 + S + H2O
Mg(NO3)2 ? MgO + NO2 + H2O