МБОУ Богоявленская СШ
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 11 класс Различные агрегатные состояния веществ
Содержание
- 1. Презентация по химии 11 класс Различные агрегатные состояния веществ
- 2. Агрегатные состояния веществаГазообразноеЖидкоеТвёрдое.
- 3. Слайд 3
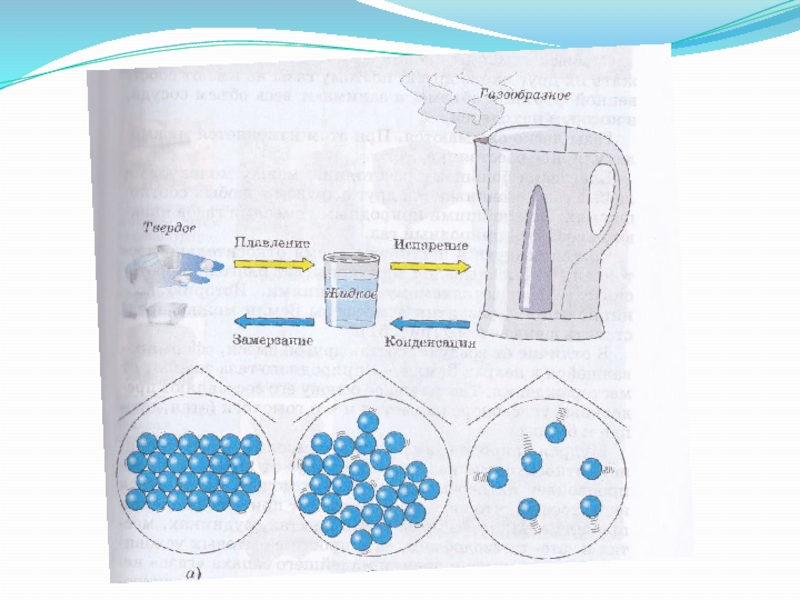
- 4. жидкостьгазтвердое тело
- 5. В газовой фазе расстояние между молекулами
- 6. Молярный объемЕсли взять:1 моль азотаN2(28г)1 моль кислорода
- 7. Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул
- 8. Какой объём при нормальных условиях занимают 2
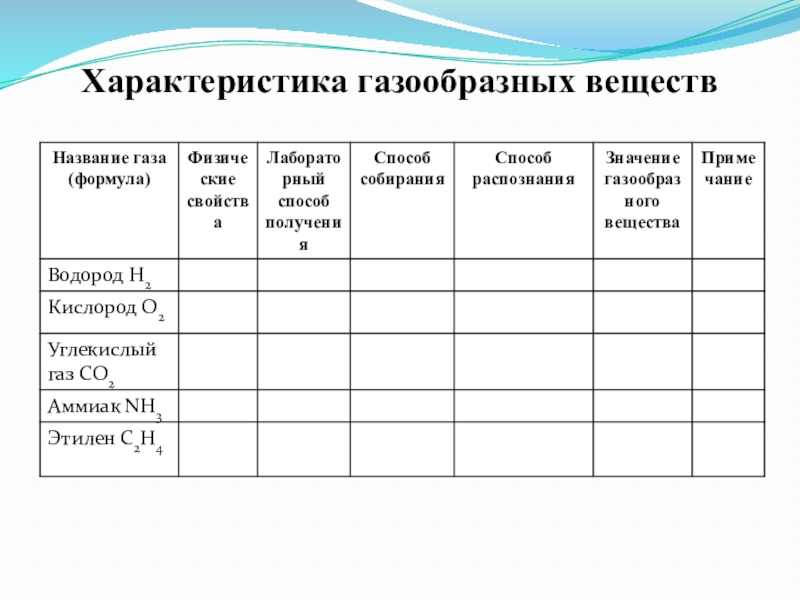
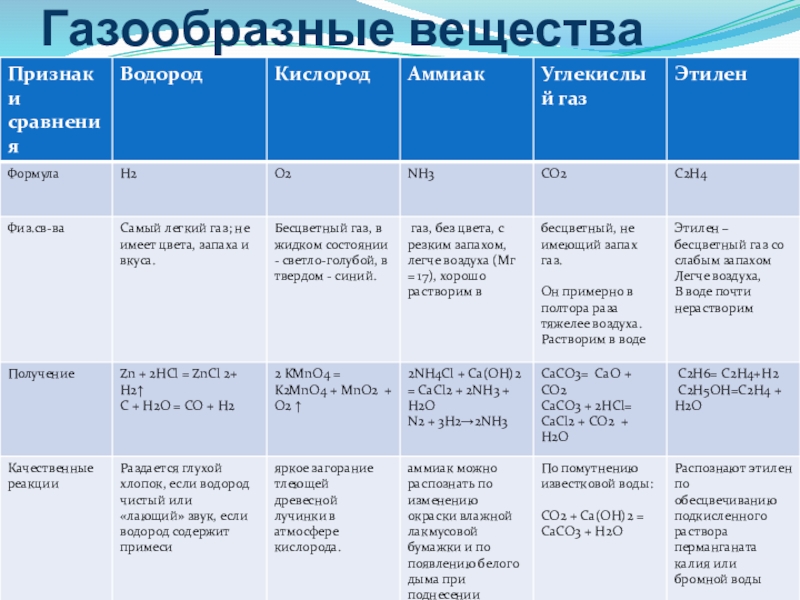
- 9. Характеристика газообразных веществ
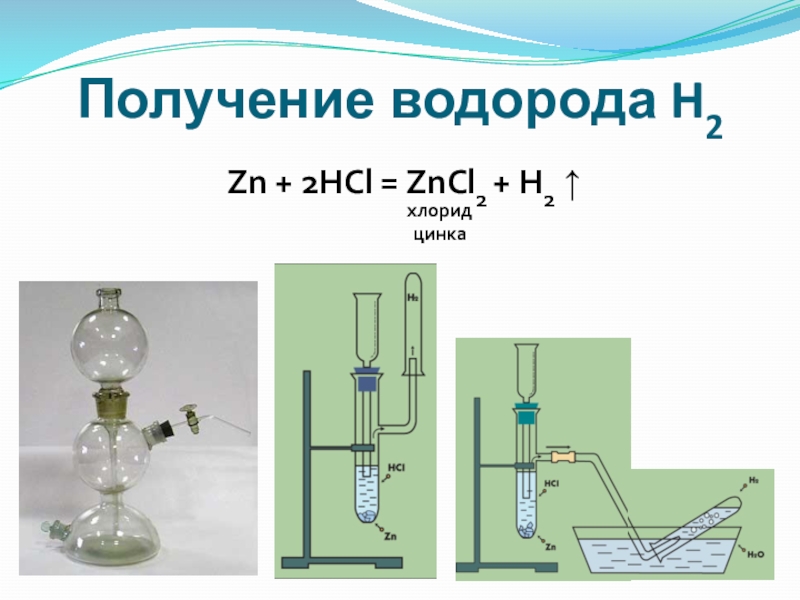
- 10. Получение водорода H2Zn + 2HCl = ZnCl2 + H2 ↑хлоридцинка
- 11. Характерный звук взрыва небольшого количества водорода:небольшой хлопок
- 12. Применение водородаНаполнение метеорологических зондов.Топливо в ракетной технике.Сварка
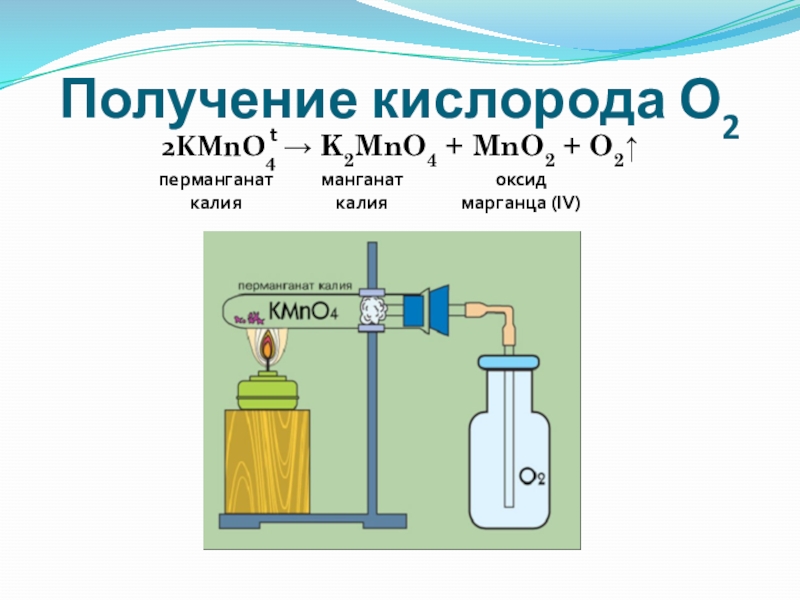
- 13. Получение кислорода О22KMnO4 → K2MnO4 + MnO2 + O2↑tманганаткалияоксид марганца (IV)перманганаткалия
- 14. Вспыхивание внесенной в сосуд с кислородом тлеющей лучинки.Качественная реакция на кислород
- 15. Применение кислородаСварка и резка металлов.В медицине.Как окислитель ракетного топлива.
- 16. CaCO3 + 2HCl = CaCl2 + CO2↑ + H2OПолучение углекислого газа СО2карбонаткальцияхлоридкальция
- 17. Применение углекислого газаИзготовление газированных напитков.Тушение огня. Хладагент («сухой лед»).
- 18. Помутнение известковой воды при пропускании через нее
- 19. Ca(OH)2 + 2NH4Cl = CaCl2 + 2H2O + 2NH3↑Получение аммиака NH3гидроксид кальцияхлоридаммонияхлоридкальцияt
- 20. Посинение влажной лакмусовой бумажки.Образование «дыма» при поднесении
- 21. Применение аммиакаПроизводство HNO3, удобрений, взрывчатых веществ, красителей, соды.Хладагент.Растворитель.
- 22. Этилен получают дегидратацией спиртов:C2H5OH
- 23. Обесцвечивание бромной (йодной) воды.Обесцвечивание раствора перманганата калия KMnO4.Качественные реакции на этилен
- 24. В овоще-хранилищах Производство полиэтиленаПроизводство растворителейПроизводство уксусной кислоты5,6. Производство спиртовПрименение этилена
- 25. Газообразные вещества
- 26. Жидкое состояние вещества
- 27. Особенности жидкого состояния вещества.1.Молекулы находятся непосредственно
- 28. Вода в природе.Важнейшим жидким веществом является вода,
- 29. Чем уникальна вода?Физические свойства воды обусловлены строением
- 30. Вода имеет аномально высокую температуру плавления и
- 31. Ещё одна аномалия воды:Лёд благодаря водо-родным связям
- 32. Бывает ли вода «жесткой»?Жесткость природных вод может
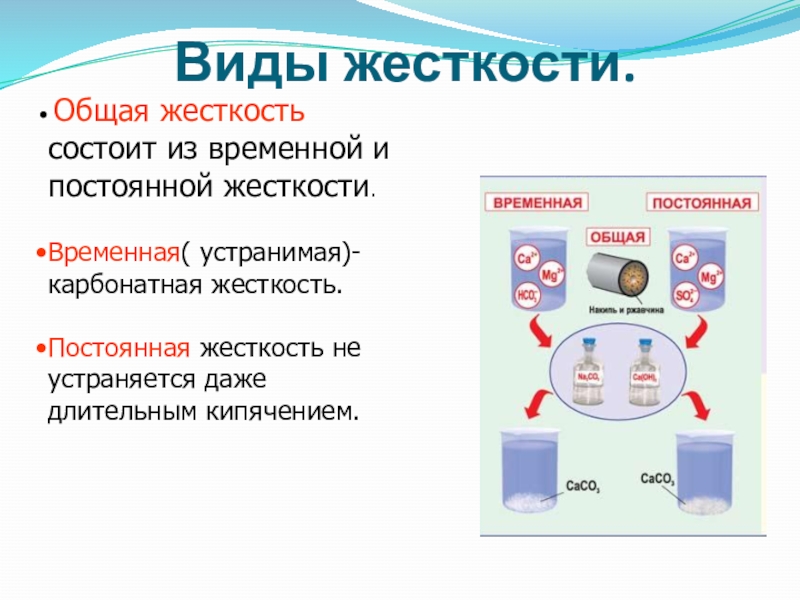
- 33. Виды жесткости. Общая жесткость состоит из временной
- 34. ВИДЫ ЖЕСТКОСТИ.КАРБОНАТНАЯ жесткость зависит от содержания
- 35. Что такое «жесткая» вода?Жесткая вода- это накипь
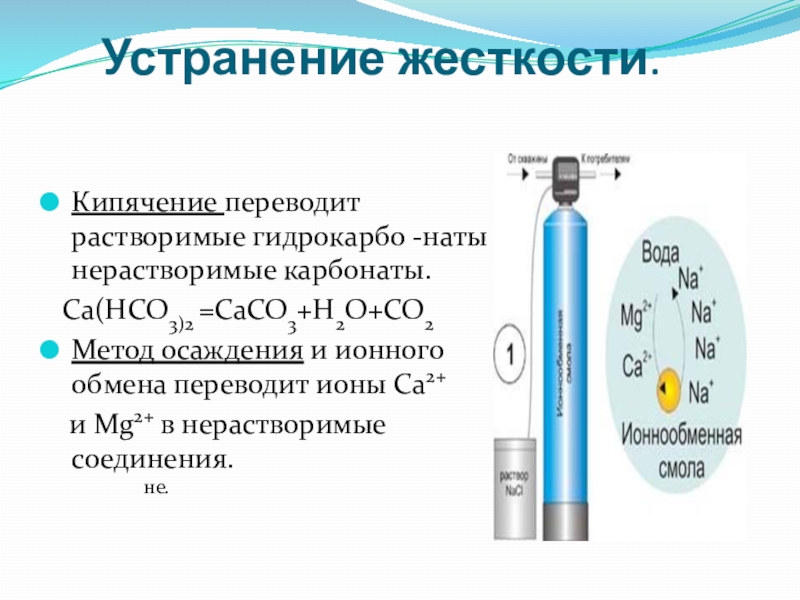
- 36. Устранение жесткости.Кипячение переводит растворимые гидрокарбо -наты в
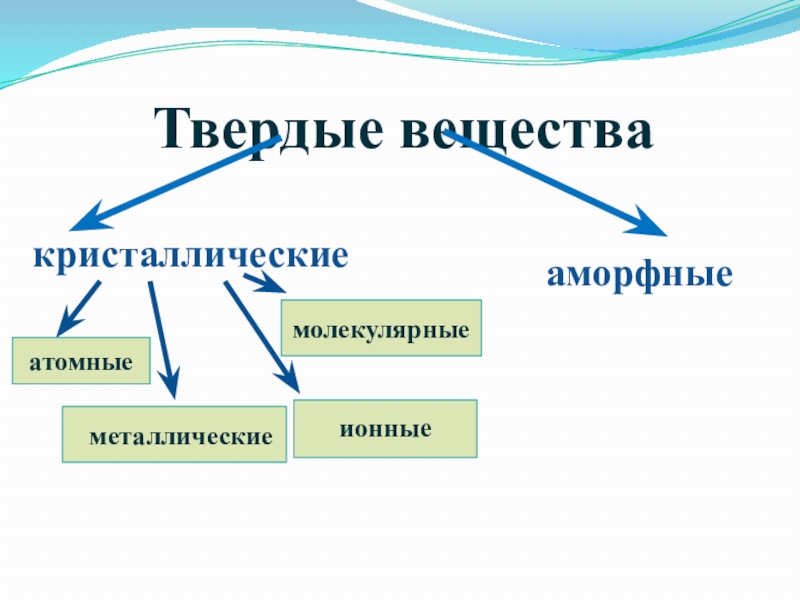
- 37. Твердые вещества
- 38. жидкостьгазтвердое тело
- 39. ~
- 40. Твердые вещества
- 41. Кристаллические вещества
- 42. Сохранение формы и объема.Наличие постоянной температуры плавления.Упорядоченное внутреннее строение.Кристаллические веществаОбщие свойства:
- 43. ковкостьпластичностьэлектропроводностьтеплопроводностьметаллический блескалюминийМеталлическая кристаллическая решетка
- 44. NaClИонная кристаллическая решетка
- 45. малая твердостьнизкая t плавлениялетучестьМолекулярная кристаллическая решеткасеранафталинсахар
- 46. твердыепрочныетугоплавкиепрактически нерастворимыеАтомной кристаллической решеткойалмазгорный хрустальSiO2 C
- 47. Аморфные веществаАморфные вещества (от греческого amorphos –
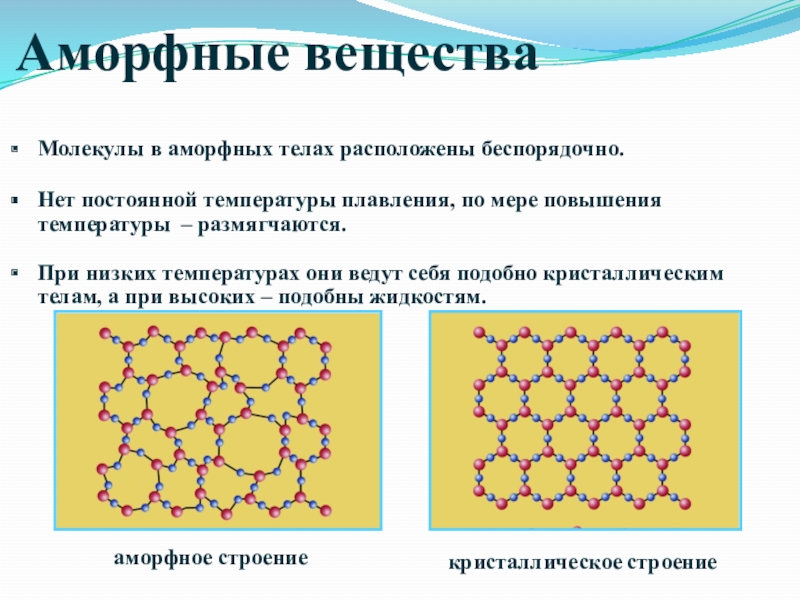
- 48. Аморфные веществаМолекулы в аморфных телах расположены беспорядочно.Нет
- 49. Аморфные вещества
- 50. Аморфные вещества
- 51. Аморфные вещества
- 52. Аморфные вещества
- 53. Аморфные веществаянтарьхалцедонопал
- 54. Аморфные веществасмолаканифоль сосновая
- 55. Аморфные веществасера пластическаясера кристаллическаяАморфное состояние веществ неустойчиво,
- 56. Аморфные вещества=Застывший твердый мед засахаривается так же,
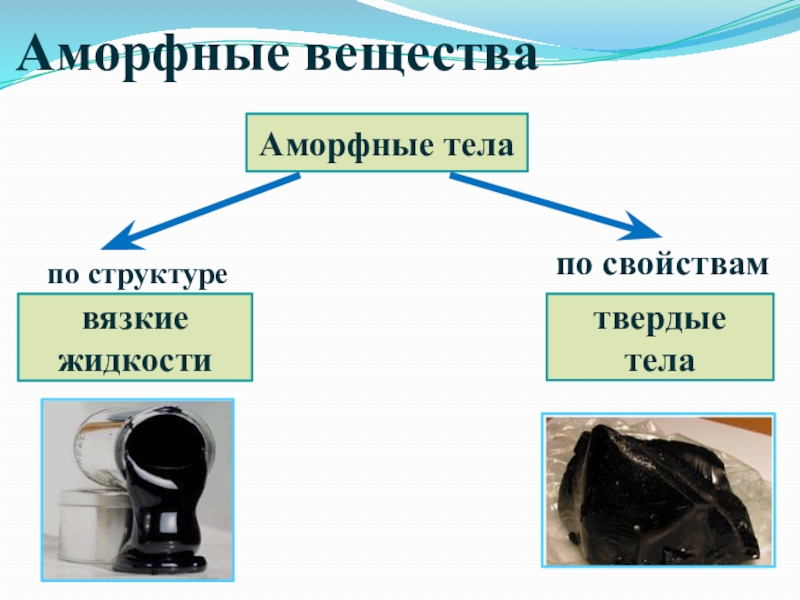
- 57. Аморфные веществаАморфные телавязкиежидкоститвердые телапо структурепо свойствам
- 58. полимерыПОЛИКАРБОНАТ
- 59. полимерыПОЛИСТИРОЛ
- 60. полимерыПОЛИПРОПИЛЕН
- 61. Домашнее задание §8, 9, 10подготовка к практической работе № 1 (стр. 217-218)
- 62. До новых встреч!
Слайд 1Вещества в различном агрегатном состоянии: газообразном, жидком, твердом
Подготовила учитель биологии и
Слайд 5 В газовой фазе расстояние между молекулами
или атомами во
превышает размеры самих частиц.
Газы не имеют собственного объёма и формы.
Газы легко сжимаются.
02
Слайд 6Молярный объем
Если взять:
1 моль азотаN2(28г)
1 моль кислорода О2 (32 г)
1 моль
1 моль водяных паров Н2О (18 г) при одинаковых условиях, например нормальных (0º С и давление 760 мм рт. ст., или 101,3 кПа)то окажется, что один моль любого из газов займет один и тот же объем, равный 22.4 л.
Слайд 7Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое
Слайд 8Какой объём при нормальных условиях занимают 2 моль любого газа?
Д
n(газа)=2 моль
_______________
Найти: V
Решение:
V= V m·n=22,4л/моль·2 моль=44,8л
Ответ:2 моль любого газа при н. у. занимают объём 44,8 л
Слайд 11Характерный звук взрыва небольшого количества водорода:
небольшой хлопок – в сосуде чистый
«лающий» звук – водород содержал примесь воздуха
Качественная реакция на водород
Слайд 12Применение водорода
Наполнение метеорологических зондов.
Топливо в ракетной технике.
Сварка и резка металлов.
Получение особо
Производство соляной кислоты и аммиака.
Слайд 13Получение кислорода О2
2KMnO4 → K2MnO4 + MnO2 + O2↑
t
манганат
калия
оксид
марганца (IV)
перманганат
калия
Слайд 17Применение углекислого газа
Изготовление газированных напитков.
Тушение огня.
Хладагент («сухой лед»).
Слайд 18Помутнение известковой воды при пропускании через нее СО2
Са(ОН)2 + СО2 =
2) Затухание пламени в углекислом газе.
Качественные реакции на углекислый газ
гидроксид
кальция
карбонат
кальция
Слайд 19Ca(OH)2 + 2NH4Cl = CaCl2 + 2H2O + 2NH3↑
Получение аммиака NH3
гидроксид
кальция
хлорид
аммония
хлорид
кальция
t
Слайд 20
Посинение влажной лакмусовой бумажки.
Образование «дыма» при поднесении концентрированного раствора соляной кислоты
Качественные реакции на аммиак
Слайд 21Применение аммиака
Производство HNO3, удобрений, взрывчатых веществ, красителей, соды.
Хладагент.
Растворитель.
Слайд 22
Этилен получают дегидратацией спиртов:
C2H5OH
Получение этилена С2Н4
этанол
этилен
H2SO4 (конц.), t
Слайд 23
Обесцвечивание бромной (йодной) воды.
Обесцвечивание раствора перманганата калия KMnO4.
Качественные реакции на этилен
Слайд 24В овоще-хранилищах
Производство полиэтилена
Производство растворителей
Производство уксусной кислоты
5,6. Производство спиртов
Применение этилена
Слайд 27Особенности жидкого
состояния вещества.
1.Молекулы находятся непосредственно друг возле
друга, поэтому жидкости
отличие от газов;
2. Текучи,т.е. не имеют формы , а принимают форму сосуда, в котором находятся;
3.В состоянии невесомости принимают форму шара
или круглой капли.
Слайд 28Вода в природе.
Важнейшим жидким веществом является вода, которая покрывает 2/3 поверхности
Слайд 29Чем уникальна вода?
Физические свойства воды обусловлены строением её молекул, а также
Молекулы воды имеют угловую форму, величина угла НОН равна 104 0. Это приводит к появлению в молекуле 2 полюсов. Электронная плотность смещается к атому кислорода. Полярность молекулы воды делает её универсальным растворителем.
Слайд 30Вода имеет аномально высокую температуру плавления и кипения.
Сравните молекулярные массы воды
6 А группы с их температурами кипения.
Н2О – М(Н2О) = 18 г/ моль
+100 0 Жидкость !
Н2S- M(H2S) = 34 г/ моль
-50 0 Газ
Н2Se- M (H2Se)= 81г/ моль
- 420 Газ
Н2Те- М(Н2Те) = 130 г/ моль
0 0 Газ
Вывод: В группах с увеличением молекулярной массы соединений увеличиваются температуры кипения и плавления веществ.
Причина аномально высокой температуры кипения воды наличие межмолекулярных водородных связей.
Слайд 31Ещё одна аномалия воды:
Лёд благодаря водо-
родным связям имеет ячеистое строение и
Слайд 32Бывает ли вода «жесткой»?
Жесткость природных вод может меняться в зависимости от
Природная вода, содержащая в растворе большое количество солей кальция и магния называется жесткой водой.
Содержание солей кальция и магния в воде зависит и от состава почвы в водоносных слоях.
Слайд 33Виды жесткости.
Общая жесткость состоит из временной и постоянной жесткости.
Временная( устранимая)-
Постоянная жесткость не устраняется даже длительным кипячением.
Слайд 34ВИДЫ ЖЕСТКОСТИ.
КАРБОНАТНАЯ жесткость зависит от
содержания в воде гидрокарбонатов
Некарбонатная жесткость вызвана присутствием в воде других солей, например сульфатов кальция и магния
СаSO4, MgSO4
Кислые соли- продукт неполного замещения атомов водорода в кислоте.
Слайд 35Что такое «жесткая» вода?
Жесткая вода- это накипь на деталях бытовой техники
В жесткой воде плохо
разваривается мясо.
В жесткой воде не мылится мыло.
Слайд 36Устранение жесткости.
Кипячение переводит растворимые гидрокарбо -наты в нерастворимые карбонаты.
Са(НСО3)2 =СаСО3+Н2О+СО2
Метод
и Мg2+ в нерастворимые соединения.
не.
Слайд 42Сохранение формы и объема.
Наличие постоянной температуры плавления.
Упорядоченное внутреннее строение.
Кристаллические вещества
Общие свойства:
Слайд 43ковкость
пластичность
электропроводность
теплопроводность
металлический блеск
алюминий
Металлическая
кристаллическая решетка
Слайд 45малая твердость
низкая t плавления
летучесть
Молекулярная
кристаллическая решетка
сера
нафталин
сахар
Слайд 46твердые
прочные
тугоплавкие
практически нерастворимые
Атомной
кристаллической решеткой
алмаз
горный
хрусталь
SiO2
C
Слайд 47Аморфные вещества
Аморфные вещества (от греческого amorphos – бесформенный, a – отрицательная
Слайд 48Аморфные вещества
Молекулы в аморфных телах расположены беспорядочно.
Нет постоянной температуры плавления, по
При низких температурах они ведут себя подобно кристаллическим телам, а при высоких – подобны жидкостям.
кристаллическое строение
аморфное строение
Слайд 55Аморфные вещества
сера пластическая
сера кристаллическая
Аморфное состояние веществ неустойчиво, и рано или поздно
Переход аморфных тел в кристаллические
Слайд 56Аморфные вещества
=
Застывший твердый мед засахаривается так же, как
засахаривается при длительном
Переход аморфных тел в кристаллические