г. Горловка Школа № 68
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 11 класс Общие химические свойства металлов
Содержание
- 1. Презентация по химии 11 класс Общие химические свойства металлов
- 2. ЗагадкиПервый слог – предлог известный, Слог второй
- 3. ОтветНатрий(Хлорид натрия)(Угольная и сернистая кислота)(Химическая реакция)Если все объединим получим тему урока
- 4. Тема урокаОбщие химические свойства металлов
- 5. Цель урока: сформировать понятие об общих химических
- 6. Проверка домашнего заданияА1Электронная формула атома магния:1)1s22s2
- 7. ТестыА 4 . В каком ряду химические
- 8. ТестыА9 В каком ряду химические элементы расположены
- 9. Ответы1Б ;2 Б; 3В;4-2;5-3;6-3;7-4; 8-2;9-2;10-1
- 10. ИнтересноНазовите семь чудес света и укажите, какую роль играли металлы в их создании
- 11. Проверь себяВ эпоху античности семью чудесами света
- 12. Слайд 12
- 13. Новая темаПочему щелочные и щелочноземельные металлы хранят
- 14. Запомни!В химических реакциях металлы выступают в роли восстановителей и
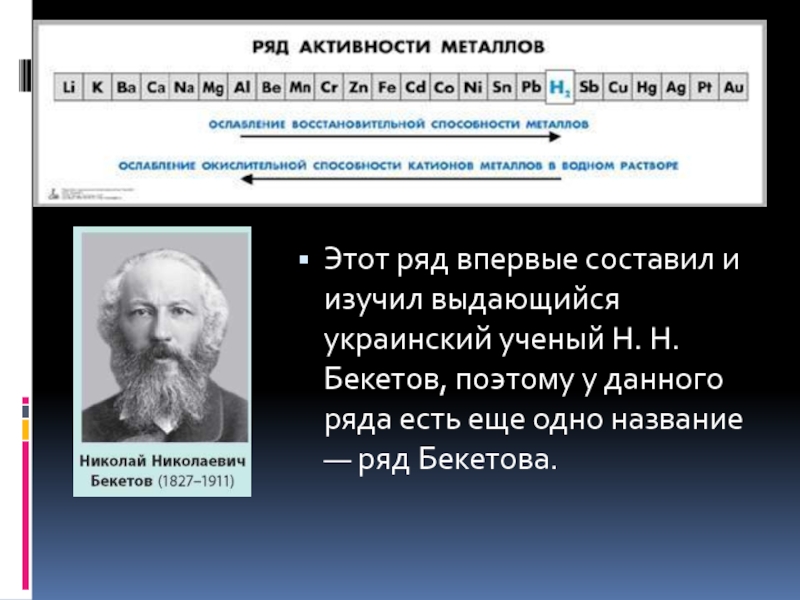
- 15. Этот ряд впервые составил и изучил выдающийся украинский
- 16. Щелочные металлы
- 17. Слайд 17
- 18. Взаимодействие с простыми веществами-неметаллами 1. Металлы взаимодействуют с
- 19. Щелочные металлы: 2. В реакциях щелочных металлов
- 20. Опыт 12 Li + 2 H2O = 2 LiOH + H22 Na + 2
- 21. Щелочные металлы3. Реакция щелочных металлов с кислотами(проводят
- 22. 6. Качественная реакция на катионы щелочных металлов
- 23. Слайд 23
- 24. Щелочноземельные металлыРеакция с кислородом.Все металлы образуют оксиды RO,
- 25. Слайд 25
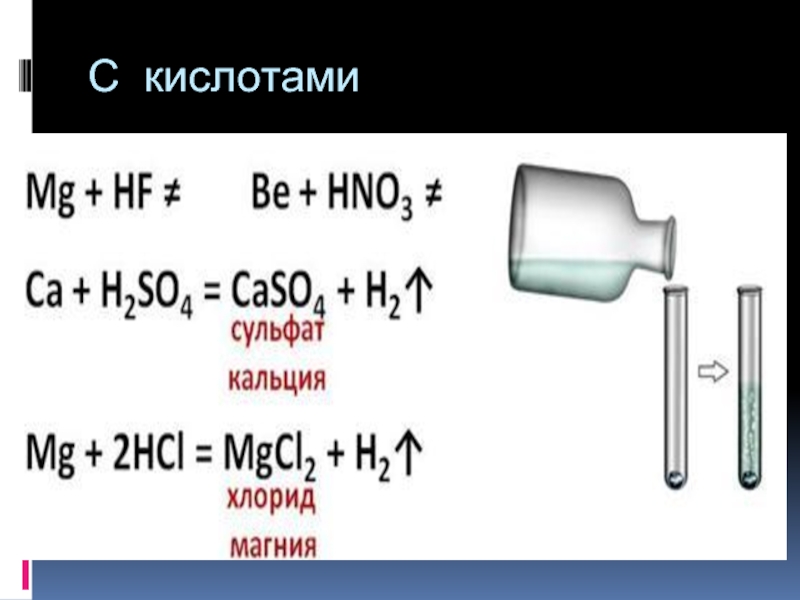
- 26. С водой
- 27. С кислотами
- 28. Слайд 28
- 29. Алюминий
- 30. Взаимодействие с водой
- 31. Слайд 31
- 32. Железо
- 33. Реакция железа с кислотами
- 34. ЗаданиеНапишите три уравнения реакций железа с разбавленной
- 35. Проверь себя
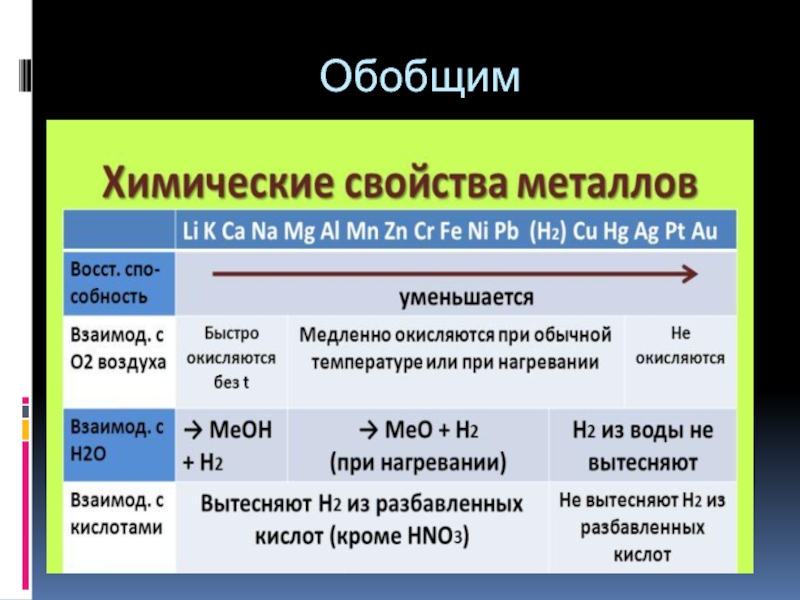
- 36. Обобщим
- 37. Обобщим
- 38. Задание 2Методом электронного баланса определите коэффициенты в
- 39. Проверь себя
- 40. Задание 3Можно ли получить водород при взаимодействии
- 41. Задание 4Как можно получить из пирита FeS2 железо и серную кислоту? Запишите уравнения реакций.
- 42. Проверь себя
- 43. Домашнее заданиеПараграф 27 изучить Выполнить №3,4,5 стр.131
ЗагадкиПервый слог – предлог известный, Слог второй трудней найти: Часть его составит цифра, К ней добавьте букву «Й». Чтобы целое узнать, Надо вам металл назвать.Порознь каждый ядовит, вместе будет — аппетит.Кислота тепла боится, быстро в воду
Слайд 2Загадки
Первый слог – предлог известный,
Слог второй трудней найти:
Часть его составит цифра,
К
ней добавьте букву «Й».
Чтобы целое узнать,
Надо вам металл назвать.
Порознь каждый ядовит, вместе будет — аппетит.
Кислота тепла боится, быстро в воду превратится.
«Она идет», «она прошла», Никто ни скажет, что пришла.
Порознь каждый ядовит, вместе будет — аппетит.
Кислота тепла боится, быстро в воду превратится.
«Она идет», «она прошла», Никто ни скажет, что пришла.
Слайд 3Ответ
Натрий
(Хлорид натрия)
(Угольная и сернистая кислота)
(Химическая реакция)
Если все объединим получим тему урока
Слайд 5Цель урока:
сформировать понятие об общих химических свойствах металлов и их восстановительных
способностях.
Задачи:
Образовательные:
сформировать понятие об общих химических свойствах металлов;
проверить знания о строении металлов и их физических свойствах.
Развивающие:
совершенствовать умения записывать уравнения химических реакций; применять знания и практические умения, работая по инструкции, с соблюдением правил Техники безопасности;
развивать познавательную активность учащихся, вырабатывать умение анализировать, делать выводы;
создать условия для развития познавательного интереса к предмету
устанавливать межпредметные связи.
Воспитательные:
воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды тяжелыми металлами), ответственное отношение к собственному здоровью (в связи с необходимостью или вредом поступления в организм некоторых металлов);
воспитывать коммуникативные компетенции, умение высказывать собственное мнение, сотрудничать в группе.
Задачи:
Образовательные:
сформировать понятие об общих химических свойствах металлов;
проверить знания о строении металлов и их физических свойствах.
Развивающие:
совершенствовать умения записывать уравнения химических реакций; применять знания и практические умения, работая по инструкции, с соблюдением правил Техники безопасности;
развивать познавательную активность учащихся, вырабатывать умение анализировать, делать выводы;
создать условия для развития познавательного интереса к предмету
устанавливать межпредметные связи.
Воспитательные:
воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды тяжелыми металлами), ответственное отношение к собственному здоровью (в связи с необходимостью или вредом поступления в организм некоторых металлов);
воспитывать коммуникативные компетенции, умение высказывать собственное мнение, сотрудничать в группе.
Слайд 6Проверка домашнего задания
А1
Электронная формула атома магния:
1)1s22s2
2) 1s22s2 2p63s2
3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
А2Электронная формула внешнего энергетического уровня атомов элементов главной подгруппы II группы Периодической системы: А.ns1. В.ns2 np1. Б. ns2. Г. ns2 np2.
А3
Металл, обладающий самой высокой электропроводностью, - это
железо 2) медь
3) серебро 4) алюминий
3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
А2Электронная формула внешнего энергетического уровня атомов элементов главной подгруппы II группы Периодической системы: А.ns1. В.ns2 np1. Б. ns2. Г. ns2 np2.
А3
Металл, обладающий самой высокой электропроводностью, - это
железо 2) медь
3) серебро 4) алюминий
Слайд 7Тесты
А 4 . В каком ряду химические элементы расположены в порядке
увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
А 5 . Металл, обладающий самой высокой электропроводностью, - это
1) железо 2) медь 3) серебро 4) алюминий
А 6 . Самый тугоплавкий металл – это:
хром 2) медь 3) вольфрам 4) железо
А7
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) K, Ca, Be
А8 Самый легкоплавкий металл – это:
1) цезий 2) ртуть 3) алюминий 4) железо
Составьте уравнения химических реакций согласно схеме:
Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
А 5 . Металл, обладающий самой высокой электропроводностью, - это
1) железо 2) медь 3) серебро 4) алюминий
А 6 . Самый тугоплавкий металл – это:
хром 2) медь 3) вольфрам 4) железо
А7
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) K, Ca, Be
А8 Самый легкоплавкий металл – это:
1) цезий 2) ртуть 3) алюминий 4) железо
Составьте уравнения химических реакций согласно схеме:
Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2
Слайд 8Тесты
А9 В каком ряду химические элементы расположены в порядке увеличения их
атомного радиуса?
Na, Mg, Al 2) Al, Mg, Na
3) K, Na, Li 4) Mg, Be, Ca
А10 Металл, обладающий самой высокой пластичностью, - это:
1) золото 2) медь
3) серебро 4) алюминий
Составьте уравнения химических реакций согласно схеме:
Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2
Na, Mg, Al 2) Al, Mg, Na
3) K, Na, Li 4) Mg, Be, Ca
А10 Металл, обладающий самой высокой пластичностью, - это:
1) золото 2) медь
3) серебро 4) алюминий
Составьте уравнения химических реакций согласно схеме:
Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2
Слайд 11Проверь себя
В эпоху античности семью чудесами света считали египетские пирамиды, висячие
сады Вавилона, статую Колосса Родосского, Храм Артемиды в Эфесе, статую олимпийского бога Юпитера, мавзолей в Галикариасе, Александрийский маяк.
В создании египетских пирамид играла немалую роль медь, т.к. для сооружения пирамиды использовались инструменты, изготовленные из меди.
Гигантская статуя Колосса Родосского была полностью изготовлена из бронзы.
Статуя Юпитера была частично сделана из золота: из благородного металла был изготовлен плащ Юпитера.
В создании египетских пирамид играла немалую роль медь, т.к. для сооружения пирамиды использовались инструменты, изготовленные из меди.
Гигантская статуя Колосса Родосского была полностью изготовлена из бронзы.
Статуя Юпитера была частично сделана из золота: из благородного металла был изготовлен плащ Юпитера.
Слайд 13Новая тема
Почему щелочные и щелочноземельные металлы хранят под керосином? Почему литий,
в отличие от натрия и калия, хранят в вазелине?
Щелочные и щелочноземельные металлы очень активны и реагируют практически со всем, с чем соприкасаются.
Например, на воздухе эти металлы легко окисляются. Если эти металлы хранить под слоем керосина, к которому они инертны, то можно уберечь от ненужных взаимодействий. Литий — самый легкий из металлов. Он легче керосина и в отличие от других металлов всплывает в нем, поэтому его хранят в вазелине.
Щелочные и щелочноземельные металлы очень активны и реагируют практически со всем, с чем соприкасаются.
Например, на воздухе эти металлы легко окисляются. Если эти металлы хранить под слоем керосина, к которому они инертны, то можно уберечь от ненужных взаимодействий. Литий — самый легкий из металлов. Он легче керосина и в отличие от других металлов всплывает в нем, поэтому его хранят в вазелине.
Слайд 14Запомни!
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь
из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.
Слайд 15Этот ряд впервые составил и изучил выдающийся украинский ученый Н. Н. Бекетов, поэтому
у данного ряда есть еще одно название — ряд Бекетова.
Слайд 18Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
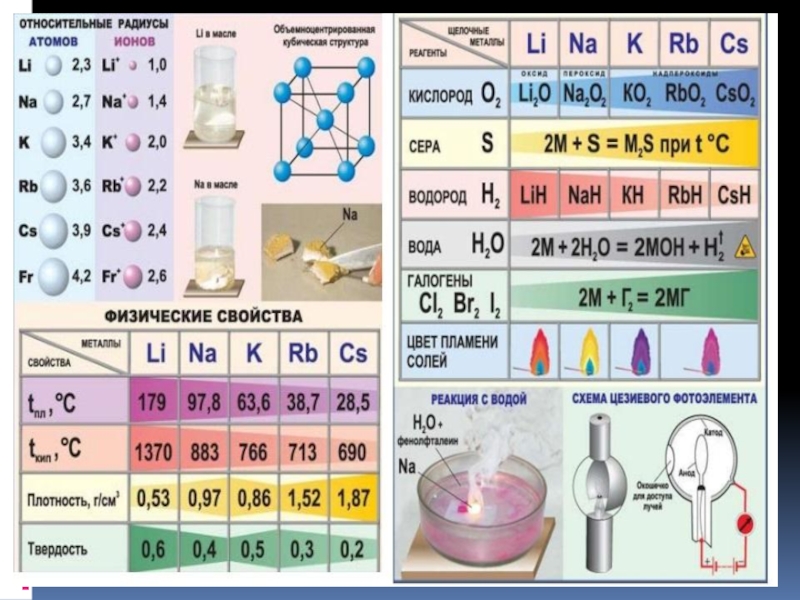
Реакция щелочных металлов с кислородом:
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
Слайд 19Щелочные металлы:
2. В реакциях щелочных металлов с другими неметаллами образуются бинарные
соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
Слайд 20Опыт 1
2 Li + 2 H2O = 2 LiOH + H2
2 Na + 2 H2O = 2 NaOH + H2
2 K + 2 H2O = 2
KOH + H2
Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь - гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь - гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
Слайд 21Щелочные металлы
3. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция
с водой):
2Na + 2HCl → 2NaCl + H2
4. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
5. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
2Na + 2HCl → 2NaCl + H2
4. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
5. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
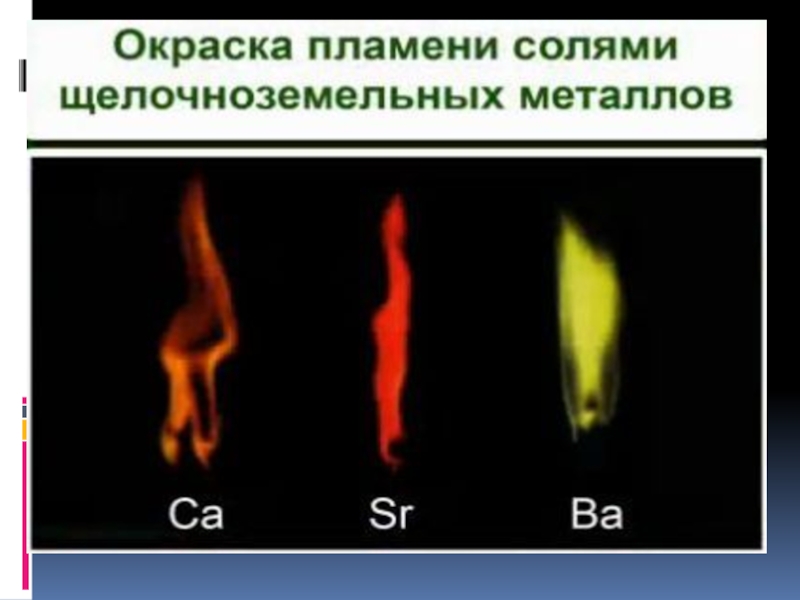
Слайд 226. Качественная реакция на катионы щелочных металлов — окрашивание пламени в
следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Слайд 24Щелочноземельные металлы
Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
Ba +
O2 ® BaO2
В атмосфере кислорода магний вспыхивает ослепительным белым пламенем.При горении магния выделяются ультрафиолетовые лучи.
Продукт горения магния – белый порошкообразный оксид.
2Mg + O2= 2MgO
В атмосфере кислорода магний вспыхивает ослепительным белым пламенем.При горении магния выделяются ультрафиолетовые лучи.
Продукт горения магния – белый порошкообразный оксид.
2Mg + O2= 2MgO
Слайд 34Задание
Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых
продуктом восстановления кислоты будет соответственно N2, NO, NH4NO3. Для расстановки коэффициентов в уравнениях химических реакций используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях.
Слайд 38Задание 2
Методом электронного баланса определите коэффициенты в уравнении реакции, схема которого:
Какой ион проявляет в этой реакции окислительные свойства?
Слайд 40Задание 3
Можно ли получить водород при взаимодействии свинца с раствором серной
кислоты?
Ответ
По правилу, которое гласит, что металлы, стоящие в ряду напряжения левее водорода, вытесняют его из растворов кислот, водород при реакции свинца с раствором серной кислоты должен получиться. Но данное правило соблюдается, если в реакции металла с кислотой образуется растворимая соль, a PbSO4 — нерастворимая соль. Поэтому в случае свинца и серной кислоты правило не действует и, следовательно, водород нельзя получить при взаимодействии свинца с раствором серной кислоты.
Ответ
По правилу, которое гласит, что металлы, стоящие в ряду напряжения левее водорода, вытесняют его из растворов кислот, водород при реакции свинца с раствором серной кислоты должен получиться. Но данное правило соблюдается, если в реакции металла с кислотой образуется растворимая соль, a PbSO4 — нерастворимая соль. Поэтому в случае свинца и серной кислоты правило не действует и, следовательно, водород нельзя получить при взаимодействии свинца с раствором серной кислоты.
Слайд 41Задание 4
Как можно получить из пирита FeS2 железо и серную кислоту?
Запишите уравнения реакций.