и расширить знания химии об атоме, химическом элементе, изотопах, простых и сложных веществах.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 11 класс. 1 урок
Содержание
- 1. Презентация по химии 11 класс. 1 урок
- 2. Что изучает химия?Химия- это наука о веществах,
- 3. Структурные единицы вещества: Атом – наименьшая элекронейтральная частица химического
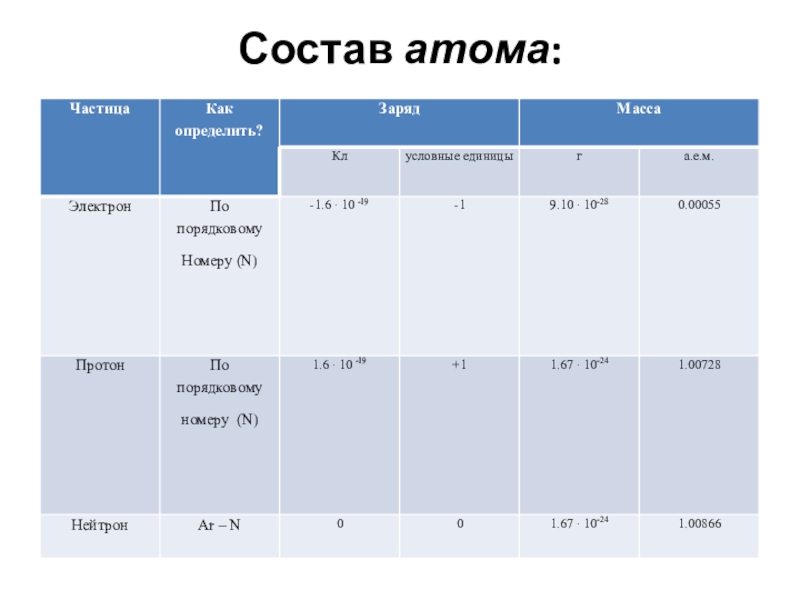
- 4. Состав атома:
- 5. Состав атомного ядра: В состав ядра входят элементарные частицы
- 6. Изотопы – разновидность атомов одного и того же
- 7. Почему у изотопов разная масса?Изотопы имеют разную
- 8. Почему атомные массы в таблице дробные?В таблице
- 9. Относительная атомная и молекулярные массы :Массы атомов
- 10. Что такое моль? Число атомов и
- 11. Основные формулы: M = Mr = ρ ∙ Vm (ρ – плотность; Vm – объём при н.у.)
- 12. Готовимся к ЕГЭ
- 13. Задачи для самостоятельного решения №1. Вычислите число
- 14. Домашнее заданиеВспомнить все законы химии и записать их.Параграфы.
Что изучает химия?Химия- это наука о веществах, их свойствах и превращениях.Вещества делятся на….Простые вещества – это…Сложные вещества делятся на…Оксиды- это..Кислоты – это..Основания- это..Соли – это…
Слайд 2Что изучает химия?
Химия- это наука о веществах, их свойствах и превращениях.
Вещества
делятся на….
Простые вещества – это…
Сложные вещества делятся на…
Оксиды- это..
Кислоты – это..
Основания- это..
Соли – это…
Простые вещества – это…
Сложные вещества делятся на…
Оксиды- это..
Кислоты – это..
Основания- это..
Соли – это…
Слайд 3Структурные единицы вещества:
Атом – наименьшая элекронейтральная частица химического элемента и простого вещества, обладающая
всеми его химическими свойствами и далее физически и химически неделимая.
Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически неделимая, но делимая химически.
Химический элемент – это вид атомов с определённым зарядом ядра.
Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически неделимая, но делимая химически.
Химический элемент – это вид атомов с определённым зарядом ядра.
Слайд 5Состав атомного ядра:
В состав ядра входят элементарные частицы (нуклоны) – протоны (11p) и нейтроны (10n).
Т.к. практически
вся масса атома сосредоточена в ядре и mp ≈mn ≈ 1 а.е.м, то округлённое значение Ar химического элемента равно общему числу нуклонов в ядре.
A = N + Z
(А – массовое число, округлённое значение Аr; N – число нейтронов в ядре; Z – заряд ядра, равный числу протонов)
Общее число электронов в электронной оболочке атома Nē равно числу протонов в ядре и порядковому номеру химического элемента
№(х.э.) = Nē = Z
A = N + Z
(А – массовое число, округлённое значение Аr; N – число нейтронов в ядре; Z – заряд ядра, равный числу протонов)
Общее число электронов в электронной оболочке атома Nē равно числу протонов в ядре и порядковому номеру химического элемента
№(х.э.) = Nē = Z
Слайд 6Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг
от друга только своей массой.
Обозначение изотопов: слева от символа элемента указывают массовое число (вверху) и порядковый номер элемента (внизу)
Напишите изотопы протия, дейтерия, трития.
Слайд 7Почему у изотопов разная масса?
Изотопы имеют разную массу из-за различного числа
нейтронов в их ядрах.
В природе химические элементы существуют в виде смесей изотопов.
Изотопный состав одного и того же химического элемента выражают ватомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Например:
ωат (3517Cl) = 0,754
ωат (3717Cl) = 0,246
В природе химические элементы существуют в виде смесей изотопов.
Изотопный состав одного и того же химического элемента выражают ватомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Например:
ωат (3517Cl) = 0,754
ωат (3717Cl) = 0,246
Слайд 8Почему атомные массы в таблице дробные?
В таблице Менделеева приведены средние значения
относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Arср = ωат.(1) ∙ Ar(1) + … + ωат.(n) ∙ Ar(n)
Например:
Arср (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
Arср = ωат.(1) ∙ Ar(1) + … + ωат.(n) ∙ Ar(n)
Например:
Arср (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
Слайд 9Относительная атомная и молекулярные массы :
Массы атомов и молекул очень малы.
В настоящее время в физике и химии принята единая система измерения.
1 а.е.м. = m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-27 кг = 1,66057 ∙ 10-24 г.
Абсолютные массы некоторых атомов:
m(C) = 1,99268 ∙ 10-23 г
m(H) = 1,67375 ∙ 10-24 г
m(O) = 2,656812 ∙ 10-23 г
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С.
Мr – показывает, во сколько раз данная молекула тяжелее 1/12 части атома 12С.
12. Связь между абсолютной и относительной массами атома или молекулы: m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг m(молекулы) = Mr ∙ 1,66 ∙ 10 -27 кг
1 а.е.м. = m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-27 кг = 1,66057 ∙ 10-24 г.
Абсолютные массы некоторых атомов:
m(C) = 1,99268 ∙ 10-23 г
m(H) = 1,67375 ∙ 10-24 г
m(O) = 2,656812 ∙ 10-23 г
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С.
Мr – показывает, во сколько раз данная молекула тяжелее 1/12 части атома 12С.
12. Связь между абсолютной и относительной массами атома или молекулы: m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг m(молекулы) = Mr ∙ 1,66 ∙ 10 -27 кг
Слайд 10Что такое моль?
Число атомов и молекул в обычных образцах
веществ очень велико, поэтому при характеристике количества вещества используют единицу измерения – моль.
Моль (ν) – единица количества вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов содержится в 12 г изотопа 12C
Масса 1 атома 12C равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12C равно:
NA = 12 г / 12 ∙ 1,66057 ∙ 10-24 г = 6,0221 ∙ 1023
Физическая величина NA называется постоянной Авогадро(число Авогадро) и имеет размерность [NA] = моль-1.
Моль (ν) – единица количества вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов содержится в 12 г изотопа 12C
Масса 1 атома 12C равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12C равно:
NA = 12 г / 12 ∙ 1,66057 ∙ 10-24 г = 6,0221 ∙ 1023
Физическая величина NA называется постоянной Авогадро(число Авогадро) и имеет размерность [NA] = моль-1.
Слайд 12Готовимся к ЕГЭ
Двухэлементные вещества –
это:
1)этанол;2)бензол; 3)кремнезем; 4)калийная селитра.
1)сухой лед; 2)сахароза; 3)бертолетова соль; 4) поваренная соль
Вещества, молекулы которых состоят из четырех атомов, - это
1)аммиак; 2) ацетилен; 3) силан; 4) сероводород
Правильные химические понятия в следующих наборах: 1) атомы гелия, кислорода, железа; 2) молекулы хлорида натрия, воздуха и аргона; 3) молекулы азота, аммиака и уксусной кислоты; 4) оксиды А12О3 состоят из молекул А12 и О3
1)этанол;2)бензол; 3)кремнезем; 4)калийная селитра.
1)сухой лед; 2)сахароза; 3)бертолетова соль; 4) поваренная соль
Вещества, молекулы которых состоят из четырех атомов, - это
1)аммиак; 2) ацетилен; 3) силан; 4) сероводород
Правильные химические понятия в следующих наборах: 1) атомы гелия, кислорода, железа; 2) молекулы хлорида натрия, воздуха и аргона; 3) молекулы азота, аммиака и уксусной кислоты; 4) оксиды А12О3 состоят из молекул А12 и О3
Слайд 13Задачи для самостоятельного решения
№1. Вычислите число атомов азота в 100г карбоната
аммония, содержащего 10% неазотистых примесей.
№2. При нормальных условиях 12 л газовой смеси, состоящей из аммиака и углекислого газа, имеют массу 18 г. Сколько литров каждого из газов содержит смесь?
№3. При действии избытка соляной кислоты на 8,24 г смеси оксида марганца (IV) с неизвестным оксидом МО2, который не реагирует с соляной кислотой, получено 1,344 л газа при н.у. Входе другого опыта установлено, что мольное отношение оксида марганца (IV) к неизвестному оксиду равно 3:1. Установите формулу неизвестного оксида и вычислите его массовую долю в смеси.
№2. При нормальных условиях 12 л газовой смеси, состоящей из аммиака и углекислого газа, имеют массу 18 г. Сколько литров каждого из газов содержит смесь?
№3. При действии избытка соляной кислоты на 8,24 г смеси оксида марганца (IV) с неизвестным оксидом МО2, который не реагирует с соляной кислотой, получено 1,344 л газа при н.у. Входе другого опыта установлено, что мольное отношение оксида марганца (IV) к неизвестному оксиду равно 3:1. Установите формулу неизвестного оксида и вычислите его массовую долю в смеси.