- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 10 класса на тему Жесткая и мягкая вода
Содержание
- 1. Презентация по химии 10 класса на тему Жесткая и мягкая вода
- 2. Цель обучения:понимать действие жесткой воды и как избавиться от жесткости
- 3. Цели урока:Все учащиеся должны: - знать какими
- 4. Стартер Посмотрите на рисунки, предложенные вам.Что объединяет
- 5. Работа в группах: Гипотеза: одинаковы ли все
- 6. Инструкция 1Определение жесткости в разных образцах водыОборудование
- 7. Насколько «жестка» жесткая вода? Жёсткость
- 8. Жесткость воды
- 9. Слайд 9
- 10. Инструкция 2Способы устранения жесткости водыОборудование и реактивы:
- 11. Взаимооценивание:
- 12. Способы нереагентного устранения жесткости водыКатионирование (ионообменная смола)Вымораживание льдаПерегонка (конденсация)Мембранный (обратный осмос)МагнитныйЭлектромагнитныйКомбинированный
- 13. Гипотеза:Польза или вред?Обсудите в группах преимущества и
- 14. Индивидуальная работа учащихсяТри химических элемента «А», «Б»,
- 15. Индивидуальная работа учащихсяХлорид кальция → сульфат кальция
- 16. Подведение итогов урока:1) знать какими ионами обусловлена
- 17. Домашнее заданиеИзвестковую воду разделили на две порции.
Цель обучения:понимать действие жесткой воды и как избавиться от жесткости
Слайд 3Цели урока:
Все учащиеся должны:
- знать какими ионами обусловлена постоянная и
временная жесткость воды
- знать методы устранения постоянной и временной жесткости
Большинство учащихся должны:
- планировать эксперимент по устранению временной, постоянной и общей жесткости воды
- делать выводы о влиянии жесткой воды на повседневную жизнь и промышленность
Некоторые учащиеся должны:
- анализировать результаты, полученные в эксперименте и делать соответствующие выводы
- знать методы устранения постоянной и временной жесткости
Большинство учащихся должны:
- планировать эксперимент по устранению временной, постоянной и общей жесткости воды
- делать выводы о влиянии жесткой воды на повседневную жизнь и промышленность
Некоторые учащиеся должны:
- анализировать результаты, полученные в эксперименте и делать соответствующие выводы
Слайд 4Стартер
Посмотрите на рисунки, предложенные вам.
Что объединяет все эти рисунки?
Какая вода
показана на рисунках?
Какая вода чистая?
Какие вещества содержатся в составе всех остальных вод?
От чего зависит наличие тех или иных ионов?
Какая вода чистая?
Какие вещества содержатся в составе всех остальных вод?
От чего зависит наличие тех или иных ионов?
Слайд 5Работа в группах:
Гипотеза: одинаковы ли все образцы воды?
Эксперимент 1: Определение
жесткости в разных образцах воды
грунтовая,
речная,
водопроводная,
водопроводная кипяченая
дистиллированная
грунтовая,
речная,
водопроводная,
водопроводная кипяченая
дистиллированная
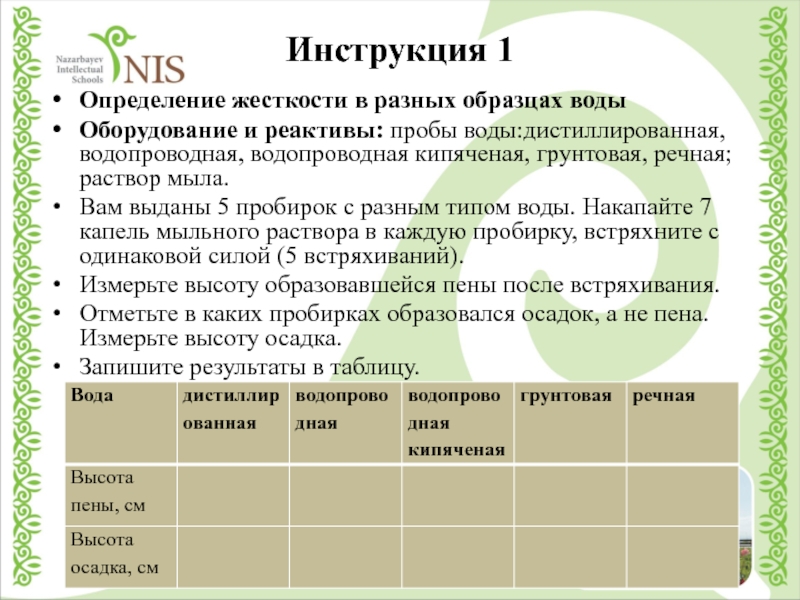
Слайд 6Инструкция 1
Определение жесткости в разных образцах воды
Оборудование и реактивы: пробы воды:дистиллированная,водопроводная,
водопроводная кипяченая, грунтовая, речная; раствор мыла.
Вам выданы 5 пробирок с разным типом воды. Накапайте 7 капель мыльного раствора в каждую пробирку, встряхните с одинаковой силой (5 встряхиваний).
Измерьте высоту образовавшейся пены после встряхивания.
Отметьте в каких пробирках образовался осадок, а не пена. Измерьте высоту осадка.
Запишите результаты в таблицу.
Вам выданы 5 пробирок с разным типом воды. Накапайте 7 капель мыльного раствора в каждую пробирку, встряхните с одинаковой силой (5 встряхиваний).
Измерьте высоту образовавшейся пены после встряхивания.
Отметьте в каких пробирках образовался осадок, а не пена. Измерьте высоту осадка.
Запишите результаты в таблицу.
Слайд 7 Насколько «жестка» жесткая вода?
Жёсткость воды – это ее свойство,
связанное с содержанием растворимых в ней соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде. Накипь на стенках нагревательных котлов, отложения солей на бытовой технике, и т.д. - все это показатели жесткой воды. Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки. В настоящее время известна взаимосвязь жесткости воды и образования камней в почках. Жесткость питьевой воды по действующим стандартам должна быть не выше 7 мг-экв/л. Существует два типа жесткости: временная и постоянная. При большом содержании ионов магния, вода горьковата на вкус и оказывает послабляющее действие на кишечник. Различают карбонатную и некарбонатную жесткость. Карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. При кипячении гидрокарбонаты разрушаются с образованием осадков малорастворимых карбонатов CaCO3, жесткость уменьшается, поэтому карбонатную жесткость называют временной. При кипячении ионы Mg2+ и Ca2+ осаждаются в виде карбонатов. Жесткость, сохраняющаяся после кипячения воды, называется постоянной или некарбонатной. Она обусловлена растворенными в воде кальциевыми и магниевыми солями сильных кислот (сульфатами и хлоридами).
Слайд 9 Работа
в группах
Гипотеза:
Как можно избавиться от жесткости воды?
Эксперимент 2: Способы реагентного и термического устранения жесткости воды
Критерии оценивания:
записывает действия и наблюдения в таблицу результатов
правильно записывает сбалансированные уравнения четырех процессов
правильно формулирует вывод
(взаимооценивание)
Слайд 10Инструкция 2
Способы устранения жесткости воды
Оборудование и реактивы:
- пробы воды: мягкая
вода, вода с временной жесткостью, вода с постоянной жесткостью, гидроксид кальция, карбонат натрия, фосфат калия
- горелка, спички, пробирки, штатив для пробирок
Вскипятите все три образца воды (3-4 мин). Что наблюдаете?
Во все три образца воды добавьте 4-5 капель раствора гидроксида кальция. Что наблюдаете?
Во все три образца воды добавьте 4-5 капель раствора карбоната натрия (соды). Что наблюдаете?
Во все три образца воды добавьте 4-5 капель раствора фосфата калия. Что наблюдаете?
Занесите полученные результаты в таблицу.
Напишите уравнения всех протекающих реакций.
Сделайте соответствующие выводы.
- горелка, спички, пробирки, штатив для пробирок
Вскипятите все три образца воды (3-4 мин). Что наблюдаете?
Во все три образца воды добавьте 4-5 капель раствора гидроксида кальция. Что наблюдаете?
Во все три образца воды добавьте 4-5 капель раствора карбоната натрия (соды). Что наблюдаете?
Во все три образца воды добавьте 4-5 капель раствора фосфата калия. Что наблюдаете?
Занесите полученные результаты в таблицу.
Напишите уравнения всех протекающих реакций.
Сделайте соответствующие выводы.
Слайд 11Взаимооценивание:
t
Ca(HCO3)2
→ CaCO3↓ + H2O + CO2 или
Mg(HCO3)2 → MgCO3↓ + H2O + CO2
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl или
MgCl2 + Na2CO3 →MgCO3↓ + 2NaCl
3CaCl2 + 2K3PO4 → Ca3(PO4)2↓+ 6KCl или
3MgCl2 + 2K3PO4 →Mg3(PO4)2↓+ 6KCl
Mg(HCO3)2 → MgCO3↓ + H2O + CO2
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl или
MgCl2 + Na2CO3 →MgCO3↓ + 2NaCl
3CaCl2 + 2K3PO4 → Ca3(PO4)2↓+ 6KCl или
3MgCl2 + 2K3PO4 →Mg3(PO4)2↓+ 6KCl
Слайд 12Способы нереагентного устранения жесткости воды
Катионирование (ионообменная смола)
Вымораживание льда
Перегонка (конденсация)
Мембранный (обратный осмос)
Магнитный
Электромагнитный
Комбинированный
Слайд 13Гипотеза:
Польза или вред?
Обсудите в группах преимущества и недостатки жесткой воды, изобразив
в комиксах.
1 группа: преимущества жесткой воды
2 группа: недостатки жесткой воды
3 группа: эксперты
1 группа: преимущества жесткой воды
2 группа: недостатки жесткой воды
3 группа: эксперты
Слайд 14Индивидуальная работа учащихся
Три химических элемента «А», «Б», «В» образуют различные соединения.
Вещество «АВ» — растворяется в воде, окрашивая лакмус в синий цвет. Соединение, в состав которого входят все три химических элемента, не растворяется в воде, но образует растворимое вещество если на него действовать водой и соединение «Б» с «В». Какие химические элементы условно обозначены буквами? О каких соединениях и реакциях идет речь? Составьте уравнения химических реакций.
Слайд 15Индивидуальная работа учащихся
Хлорид кальция → сульфат кальция → сульфид кальция →
сульфат кальция → гидроксид кальция → оксид кальция → гидрокарбонат кальция.
Слайд 16Подведение итогов урока:
1) знать какими ионами обусловлена постоянная и временная жесткость
воды
2) знать методы устранения постоянной и временной жесткости
3) уметь планировать эксперимент по устранению временной и постоянной жесткости воды
4) делать выводы о влиянии жесткой воды на повседневную жизнь и промышленность
5) анализировать результаты, полученные в эксперименте и делать соответствующие выводы
2) знать методы устранения постоянной и временной жесткости
3) уметь планировать эксперимент по устранению временной и постоянной жесткости воды
4) делать выводы о влиянии жесткой воды на повседневную жизнь и промышленность
5) анализировать результаты, полученные в эксперименте и делать соответствующие выводы
Слайд 17Домашнее задание
Известковую воду разделили на две порции. Через одну пропускали оксид
углерода (IV) до тех пор, пока сначала появившийся осадок не растворился, затем обе порции слили. Предположите, что можно наблюдать при этом. Запишите уравнения всех происходящих реакций и отметьте их признаки. Назовите полученные вещества.
2. Как в быту частично смягчают жесткую воду: а) не применяя химических реактивов, б) используя домашние средства?
3. Если оксид кальция на долгое время оставить на воздухе, его масса изменится. Как? Почему?
4. В каком направлении сместится равновесие химической реакции СаСО3 + Н2О + СО2= Са(НСО3) + Q, если: а) понизить температуру, б) повысить давление, в) увеличить концентрацию оксида углерода (IV)?
5. Горы Крымского полуострова в основном состоят из известняка. Объясните причину большого числа пещер в этих горах.
6. Назовите две-три соли щелочноземельных металлов, хорошо и плохо растворимых в воде. Какие из них могут обусловливать жесткость воды?
2. Как в быту частично смягчают жесткую воду: а) не применяя химических реактивов, б) используя домашние средства?
3. Если оксид кальция на долгое время оставить на воздухе, его масса изменится. Как? Почему?
4. В каком направлении сместится равновесие химической реакции СаСО3 + Н2О + СО2= Са(НСО3) + Q, если: а) понизить температуру, б) повысить давление, в) увеличить концентрацию оксида углерода (IV)?
5. Горы Крымского полуострова в основном состоят из известняка. Объясните причину большого числа пещер в этих горах.
6. Назовите две-три соли щелочноземельных металлов, хорошо и плохо растворимых в воде. Какие из них могут обусловливать жесткость воды?