- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по аналитической химии на тему: Аналитическая химия. Первая аналитическая группа катионов
Содержание
- 1. Презентация по аналитической химии на тему: Аналитическая химия. Первая аналитическая группа катионов
- 2. Аналитическая химия - это наука о способах
- 3. Аналитическая реакция - это химическая реакция, при
- 4. Цветные реакции - это реакции, приводящие к
- 5. Осадочные реакции - реакции выделения или растворения
- 6. Газовыделительные реакции - обнаружение веществ по характеру
- 7. Микрокристаллоскопические реакции - реакции образования осадков, состоящих
- 8. Образование соединений, люминесцирующих в растворахИногда в качественном
- 9. Аналитические реакции могут быть:специфическими;селективными;групповыми.Групповая - реакция, при
- 10. Чаще применяют!!В аналитической химии чаще применяются селективные,
- 11. Кислотно-основная классификация катионов по группам
- 12. Ионы можно открывать непосредственно в отдельных порциях
- 13. Аналитические реакции катионов первой группы по кислотно-основной
- 14. Аналитические реакции катиона Na+Реакция с цинкуранилацетатом Катионы
- 15. Аналитические реакции катиона K+Реакция с гексанитрокобальтатом (III)
- 16. Аналитические реакции катиона NH4+Реакция разложения солей аммония
- 17. Анализ смеси катионов 1 аналитической группыСмесь представляет
- 18. 2. Определяют катион NH4Отдельную пробу образца обрабатывают
- 19. 3. Открытие катиона КПолученный осадок растворяют в
- 20. Какой катион мы забыли? Почему?
Слайд 2Аналитическая химия - это наука о способах идентификации химических соединений, о
Химический анализ - это получение опытным путем данных о составе и свойствах объектов.
Качественный анализ идентификация (обнаружение) атомов, молекул или ионов в анализируемом объекте.
Слайд 3Аналитическая реакция - это химическая реакция, при которой анализируемое вещество при
К аналитическим признакам реакции относятся: образование окрашенных соединений, выделение или растворение осадков, образование газов, кристаллов характерной формы, соединений, люминесцирующих в растворах, окрашивание пламени газовой горелки в соответствующий цвет.
Слайд 4Цветные реакции - это реакции, приводящие к образованию окрашенных соединений. Ионы
[Cu(H2O)n]2+ +4NH3=[Cu(NH3)4]2+ +nH2О
Слайд 5Осадочные реакции - реакции выделения или растворения осадков. Осадки, выпадающие при
HCl + АgNO3 = АgCl I + НNO3
Образовавшийся осадок АgCl нерастворим в азотной кислоте. Данная реакция в качественном анализе используется как для определения хлорид-ионов Сl-, так и для определения катионов серебра Ag+.
Слайд 6Газовыделительные реакции - обнаружение веществ по характеру выделяющихся газов.
Например, реакция
СaCO3+2HCl = CaCl2 + H2O + CO2t
При этом выделяется диоксид углерода CO2, появление которого можно зафиксировать по шипению пузырьков газа, изменению цвета влажной индикаторной бумаги или помутнению известковой воды - раствора Са(ОН)2.
Слайд 7Микрокристаллоскопические реакции - реакции образования осадков, состоящих из кристаллов характерной формы,
Ионы калия при реакции в нейтральных или уксуснокислых растворах с раствором гексанитрокупратом (II) натрия и свинца Na2Pb[Cu(NO2)6] образуют характерные черные кубические кристаллы К2Pb[Cu(NO2)6]:
2К+ + Na2Pb[Cu(NO2)6] = К2Pb[Cu(NO2)6] + 2Na+
Слайд 8Образование соединений, люминесцирующих в растворах
Иногда в качественном анализе используются аналитические реакции,
Например, при реакции катиона Li+ с 8-оксихинолином наблюдается излучение голубого цвета.
Слайд 9Аналитические реакции могут быть:
специфическими;
селективными;
групповыми.
Групповая - реакция, при которой с реагентом в
Специфическая - реакция, при которой в данных условиях с реагентами взаимодействует и дает сигнал только один компонент.
Например, реакция обнаружения иона аммония NH4+ действием щелочи при нагревании, NH4+ + ОН- = NH3t + H2O
Слайд 10Чаще применяют!!
В аналитической химии чаще применяются селективные, или избирательные реакции, в
Степень селективности реакции тем больше, чем меньше число ионов, с которыми реагент дает положительный эффект.
Слайд 12Ионы можно открывать непосредственно в отдельных порциях исследуемого раствора (порядок открывания
Если ионы мешают определению друг друга, то используют последовательность проведения реакций (ионы из смеси выделяются целыми группами, пользуясь тем, что к действию некоторых реактивов группы ионов относятся одинаково) – систематический анализ.
Виды анализа
Слайд 13Аналитические реакции катионов первой группы по кислотно-основной классификации: Li+, Na+, K+,
Аналитические реакции катиона Li
Окрашивание пламени газовой горелки. Летучие соли лития LiNO3)окрашивают пламя газовой горелки в карминово-красный цвет.
Слайд 14Аналитические реакции катиона Na+
Реакция с цинкуранилацетатом
Катионы натрия
дают с цинкуранилацетатом Zn(UO2)3(CH3COO)8
NaZn(UO2)3(CH3COO)9∙9H2O,
нерастворимый в уксусной кислоте:
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COO- + 9H2O = NaZn(UO2)3(CH3COO)99H2O↓
Окрашивание пламени газовой горелки cоединениями натрия
Соли и другие соединения натрия окрашивают пламя газовой горелки в желтый цвет.
Слайд 15Аналитические реакции катиона K+
Реакция с гексанитрокобальтатом (III) натрия
Катионы калия в
2K+ + Na3[Co(NO2)6 ] = NaK2[Co(NO2)6 ]↓+ 2Na+
Окрашивание пламени газовой горелки. Соли и другие соединения калия при внесении их в пламя газовой горелки окрашивают его в фиолетовый цвет.
Слайд 16Аналитические реакции катиона NH4+
Реакция разложения солей аммония щелочами
Соли аммония в
NH4+ + OH = NH3↑ + H2O
Выделяющийся аммиак обнаруживают с помощью влажной универсальной индикаторной бумаги (синеет в парах аммиака).
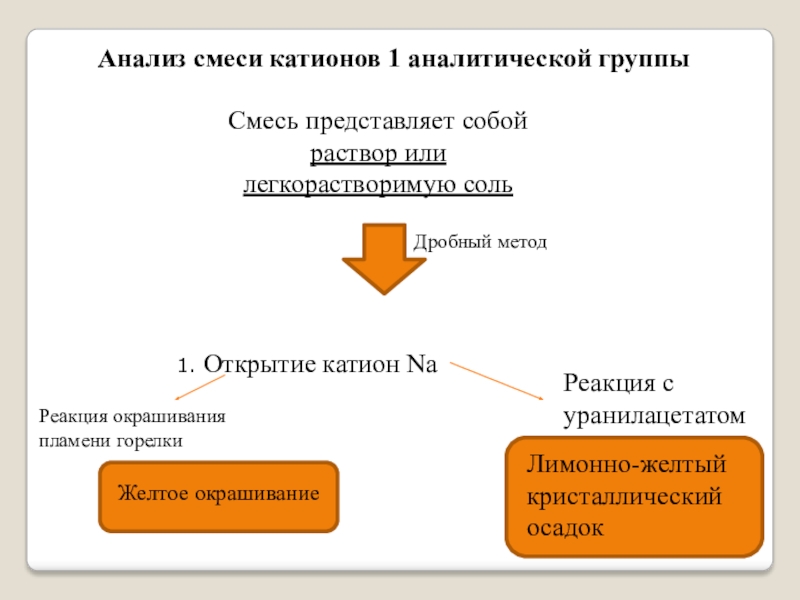
Слайд 17Анализ смеси катионов 1 аналитической группы
Смесь представляет собой раствор или легкорастворимую
1. Открытие катион Na
Реакция окрашивания пламени горелки
Реакция с уранилацетатом
Лимонно-желтый кристаллический осадок
Дробный метод
Желтое окрашивание
Слайд 182. Определяют катион NH4
Отдельную пробу образца обрабатывают концентрированным раствором щелочи →
Чувствительная реакция – реактив Несслера
После подтверждения наличия катиона аммония в растворе необходимо его удалить, т.к. он мешает открытию катиона K
NH4C1 + 2K2[HgI4] + 4КОН → [NH2Hg2O]I↓ + 7KI + КС1 + ЗН2О,
NH4++ 2HgI42– + 4OH– → [NH2Hg2O]I↓ + 7I– + ЗН2О.
Упаривают раствор, затем прокаливают
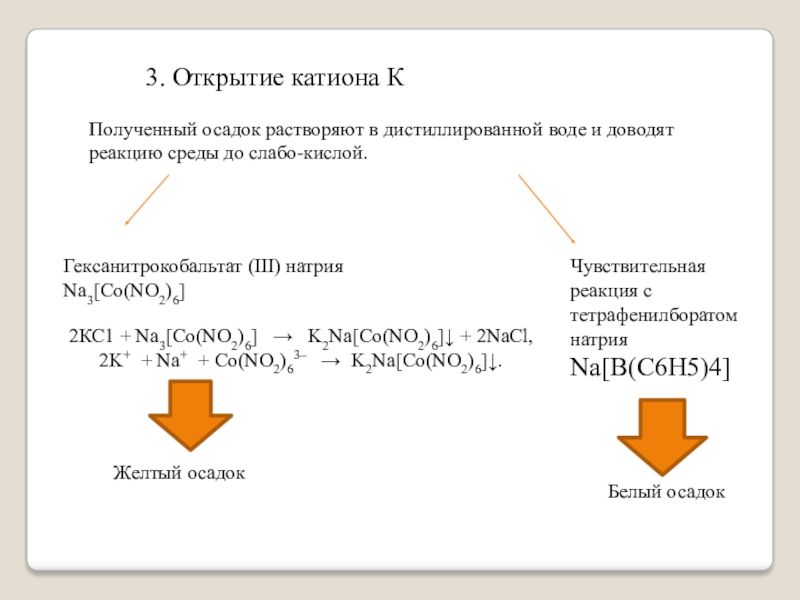
Слайд 193. Открытие катиона К
Полученный осадок растворяют в дистиллированной воде и доводят
Гексанитрокобальтат (III) натрия Na3[Co(NO2)6]
Чувствительная реакция с тетрафенилборатом натрия Na[B(C6H5)4]
2КС1 + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaCl,
2K+ + Na+ + Co(NO2)63– → K2Na[Co(NO2)6]↓.
Желтый осадок
Белый осадок