с. Нижние Бузули
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Периодический закон. Подготовка к ЕГЭ
Содержание
- 1. Презентация Периодический закон. Подготовка к ЕГЭ
- 2. Периодический закон Свойства химических элементов
- 3. Слайд 3
- 4. Периодическая таблица химических элементов
- 5. Строение атомаАтом состоит из положительно заряженного ядра
- 6. Виды электронов. Электронная формула Электроны
- 7. Электронная формула
- 8. Изменение свойств элементов в малых периодах Изменение
- 9. Причины изменения свойств элементов
- 10. Изменение свойств элементов в больших периодах
- 11. Изменение свойств элементов в главных подгруппах В группе
- 12. Слайд 12
- 13. Задания ЕГЭ . Изменение свойств элементов в
- 14. Задания ЕГЭ . Изменение свойств элементов в
- 15. Задания ЕГЭ . Изменение свойств элементов в
- 16. Задания ЕГЭ . Изменение свойств элементов в
- 17. Задания ЕГЭ . Изменение свойств элементов в
- 18. Задания ЕГЭ . Изменение свойств элементов в
- 19. Задания ЕГЭ . Изменение свойств элементов в
- 20. Задания ЕГЭ . Изменение свойств элементов в
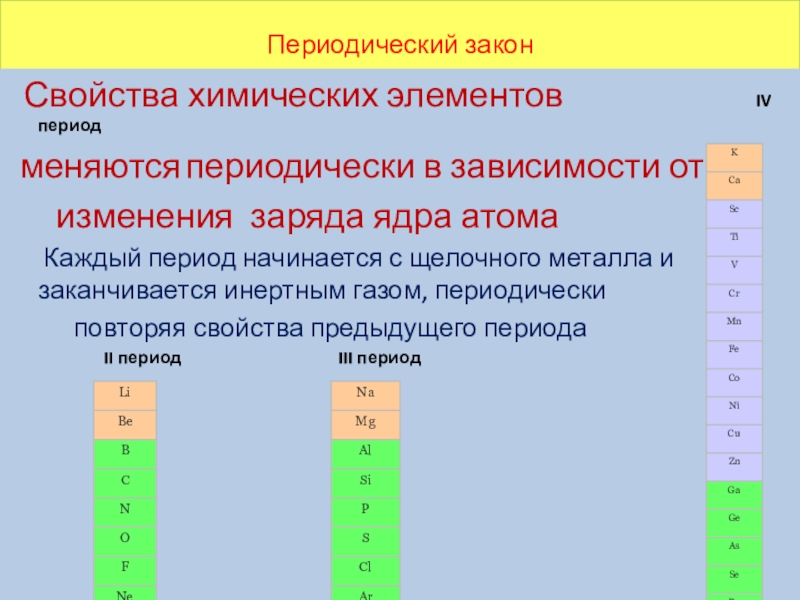
Периодический закон Свойства химических элементов IV период меняются периодически в зависимости от изменения заряда ядра атома Каждый период начинается с щелочного
Слайд 1Электронное строение атома. Периодический закон Составила: Гальцева Л.В. учитель химии 1 категории
Слайд 2Периодический закон
Свойства химических элементов
IV период
меняются периодически в зависимости от
изменения заряда ядра атома
Каждый период начинается с щелочного металла и заканчивается инертным газом, периодически
повторяя свойства предыдущего периода
II период III период
меняются периодически в зависимости от
изменения заряда ядра атома
Каждый период начинается с щелочного металла и заканчивается инертным газом, периодически
повторяя свойства предыдущего периода
II период III период
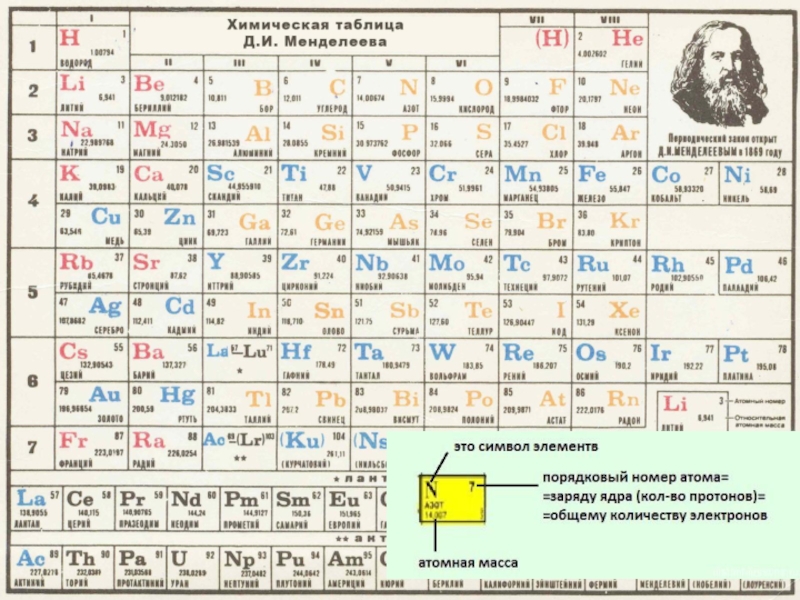
Слайд 4Периодическая таблица химических элементов
Ряды элементов, в пределах
которых свойства изменяются последовательно, как, например, ряд из восьми элементов от лития до неона или от натрия до аргона, Менделеев назвал периодами. Если напишем эти два периода один под другим так, чтобы под литием находился натрий, а под неоном — аргон, то получим следующее расположение элементов:
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
При таком расположении в вертикальные столбцы попадают элементы, сходные по своим свойствам и обладающие одинаковой валентностью.
Таблица состоит из:
1. Горизонтальных рядов периодов(их7).
Состоят из малых(1-3 )и больших(4-7)
2)Вертикальных столбцов –это группы (их 8). Группа состоит из главной подгруппы(А),начинается сверху с1 периода
(закройте карандашом 4главную подгруппу : C, S i,Ge, Sn, Pb )
и побочную(Б)начинается ниже с больших периодов,
( закройте карандашом 4 побочную подгруппу: Ti, Z r, Hf, Rf)
Менделеев составил таблицу, названную им периодической системой элементов .
Надо знать электронное строение атома, чтобы понять периодичность закона.
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
При таком расположении в вертикальные столбцы попадают элементы, сходные по своим свойствам и обладающие одинаковой валентностью.
Таблица состоит из:
1. Горизонтальных рядов периодов(их7).
Состоят из малых(1-3 )и больших(4-7)
2)Вертикальных столбцов –это группы (их 8). Группа состоит из главной подгруппы(А),начинается сверху с1 периода
(закройте карандашом 4главную подгруппу : C, S i,Ge, Sn, Pb )
и побочную(Б)начинается ниже с больших периодов,
( закройте карандашом 4 побочную подгруппу: Ti, Z r, Hf, Rf)
Менделеев составил таблицу, названную им периодической системой элементов .
Надо знать электронное строение атома, чтобы понять периодичность закона.
Слайд 5Строение атома
Атом состоит из положительно заряженного ядра (заряд равен числу порядкового
номера в периодической таблице) и вращающихся по орбиталям отрицательно заряженных электронов. Число электронов равно числу заряда ядра(«+» на «-»= 0) поэтому атом нейтрален
Li 1)Число энергетических уровней равно числу номера периода
2) На внешнем энергетическом уровне у элементов главных
подгрупп число электронов равно номеру группы (это валентные
электроны)
3)Заполнение энергетических уровней идет в порядке 2,8, 18,32
Например строение атома калия №19. Находится в 4 периоде- з значит -4 энергетических слоя.
В 1 главной подгруппе , значит 1 валентный электрон на внешнем слое
другие примеры
-Составьте электронные схемы элементов №13, №40, №52.
Li 1)Число энергетических уровней равно числу номера периода
2) На внешнем энергетическом уровне у элементов главных
подгрупп число электронов равно номеру группы (это валентные
электроны)
3)Заполнение энергетических уровней идет в порядке 2,8, 18,32
Например строение атома калия №19. Находится в 4 периоде- з значит -4 энергетических слоя.
В 1 главной подгруппе , значит 1 валентный электрон на внешнем слое
другие примеры
-Составьте электронные схемы элементов №13, №40, №52.
3
Слайд 6Виды электронов. Электронная формула
Электроны представляют собой электронные облака,
находящиеся на определенном энергетическом слое, который может расслаиваться на подуровни, на которых вращаются s,p,d,f электроны .
Заполнение уровней электронами всегда начинается с s- электронов, потом –p—d—f
2 6 10 14 Электронная схема
s p d f
Электронная формула
Графическое изображение
Заполнение уровней электронами всегда начинается с s- электронов, потом –p—d—f
2 6 10 14 Электронная схема
s p d f
Электронная формула
Графическое изображение
Слайд 8Изменение свойств элементов в малых периодах
Изменение свойств элементов с возрастанием
порядковых номеров:
1.Заряд атомных ядер увеличивается
2.Число энергетических уровней сохраняется
3.Радиус атома уменьшается (за счет увеличения электронов на внешнем энергетическом уровне)
4.Количество валентных электронов на внешнем энергетическом уровне увеличивается, у элементов главных подгрупп оно равно номеру группы.
5.Электроотрицательность увеличивается, а значит усиливаются неметаллические свойства элементов
1.Заряд атомных ядер увеличивается
2.Число энергетических уровней сохраняется
3.Радиус атома уменьшается (за счет увеличения электронов на внешнем энергетическом уровне)
4.Количество валентных электронов на внешнем энергетическом уровне увеличивается, у элементов главных подгрупп оно равно номеру группы.
5.Электроотрицательность увеличивается, а значит усиливаются неметаллические свойства элементов
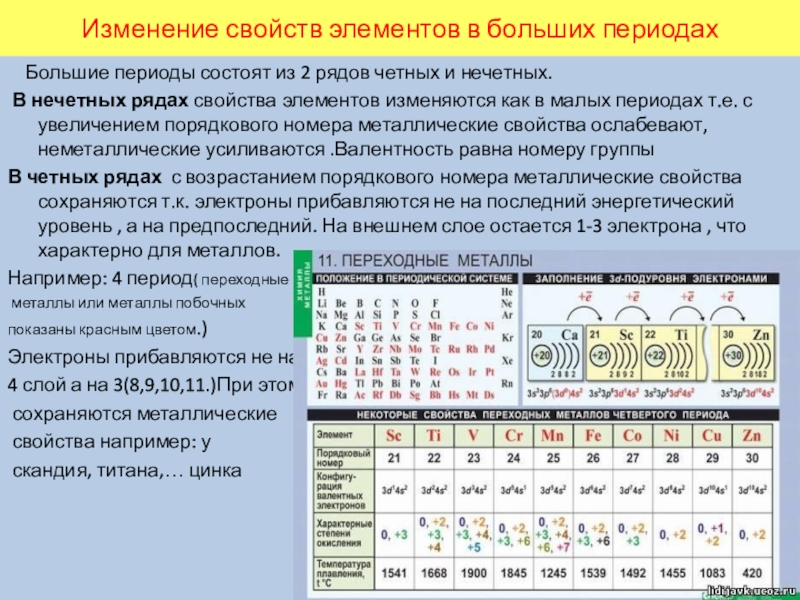
Слайд 10Изменение свойств элементов в больших периодах
Большие периоды состоят из
2 рядов четных и нечетных.
В нечетных рядах свойства элементов изменяются как в малых периодах т.е. с увеличением порядкового номера металлические свойства ослабевают, неметаллические усиливаются .Валентность равна номеру группы
В четных рядах с возрастанием порядкового номера металлические свойства сохраняются т.к. электроны прибавляются не на последний энергетический уровень , а на предпоследний. На внешнем слое остается 1-3 электрона , что характерно для металлов.
Например: 4 период( переходные
металлы или металлы побочных
показаны красным цветом.)
Электроны прибавляются не на
4 слой а на 3(8,9,10,11.)При этом
сохраняются металлические
свойства например: у
скандия, титана,… цинка
В нечетных рядах свойства элементов изменяются как в малых периодах т.е. с увеличением порядкового номера металлические свойства ослабевают, неметаллические усиливаются .Валентность равна номеру группы
В четных рядах с возрастанием порядкового номера металлические свойства сохраняются т.к. электроны прибавляются не на последний энергетический уровень , а на предпоследний. На внешнем слое остается 1-3 электрона , что характерно для металлов.
Например: 4 период( переходные
металлы или металлы побочных
показаны красным цветом.)
Электроны прибавляются не на
4 слой а на 3(8,9,10,11.)При этом
сохраняются металлические
свойства например: у
скандия, титана,… цинка
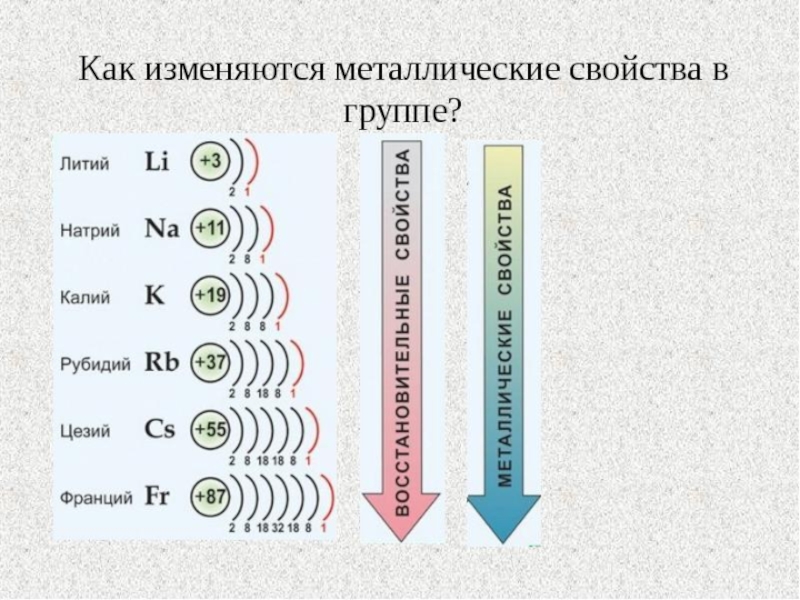
Слайд 11Изменение свойств элементов в главных подгруппах
В группе с ростом порядкового номера
элементов (сверху вниз)
1) увеличивается число энергетических уровней, увеличивается радиус атома
2) усиление металлических свойств сверху вниз(неметаллических снизу вверх) т.к.радиус атома возрастает, связь ядра с последними электронами ослабевает, они легко отсоединяются, что характерно для металлов 3) сохраняется постоянно число электронов на внешнем уровне, значит и валентность
У франция ярче всего выражены металлические свойства
2) усиление металлических свойств сверху вниз(неметаллических снизу вверх) т.к.радиус атома возрастает, связь ядра с последними электронами ослабевает, они легко отсоединяются, что характерно для металлов 3) сохраняется постоянно число электронов на внешнем уровне, значит и валентность
У франция ярче всего выражены металлические свойства
Слайд 13Задания ЕГЭ . Изменение свойств элементов в периодической таблице
1.При увеличении
порядкового номера элемента, неметаллические свойства в группе :
1)усиливаются 2)ослабевают 3)не изменяются 4)изменяютсяпериодически
2.Восстановительные свойства металлов(т.е. металлические свойства) в главной подгруппе с увеличением порядкового номера:
1)убывают 2)не изменяются 3)усиливаются 4)сначала возрастают, затем убывают
3. В ряду Na →Mg →Al →Si
1)увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4.В ряду элементов азот — кислород — фтор возрастает
1)валентность по водороду
2)число энергетических уровней
3)число внешних электронов
4)число неспаренных электронов
5. В ряду химических элементов бор — углерод — азот возрастает
1)способность атома отдавать электроны
2)высшая степень окисления
3)низшая степень окисления
4)радиус атома
1)усиливаются 2)ослабевают 3)не изменяются 4)изменяютсяпериодически
2.Восстановительные свойства металлов(т.е. металлические свойства) в главной подгруппе с увеличением порядкового номера:
1)убывают 2)не изменяются 3)усиливаются 4)сначала возрастают, затем убывают
3. В ряду Na →Mg →Al →Si
1)увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4.В ряду элементов азот — кислород — фтор возрастает
1)валентность по водороду
2)число энергетических уровней
3)число внешних электронов
4)число неспаренных электронов
5. В ряду химических элементов бор — углерод — азот возрастает
1)способность атома отдавать электроны
2)высшая степень окисления
3)низшая степень окисления
4)радиус атома
Слайд 14Задания ЕГЭ . Изменение свойств элементов в периодической таблице
6 Одинаковую
электронную конфигурацию имеют частицы
+7 0 +3 -1
Сl и Аг 3)С Г и F-
- 1 0 + 0
2) Сl и Аг 4)Na+ и Аг
7. Верны ли следующие суждения об алюминии?
А. Атом алюминия в основном состоянии содержит 3 неспаренных электрона.
Б. Алюминий образует амфотерный оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
8.Электронная конфигурация ls22s22p4 соответствует частице
1) О2- 3) с2+
2) 02+ 4) С2-
9.Электронная конфигурация ls22s2 соответствует частице
1) С4~ 3) С2+
2) С4+ 4) С2'
+7 0 +3 -1
Сl и Аг 3)С Г и F-
- 1 0 + 0
2) Сl и Аг 4)Na+ и Аг
7. Верны ли следующие суждения об алюминии?
А. Атом алюминия в основном состоянии содержит 3 неспаренных электрона.
Б. Алюминий образует амфотерный оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
8.Электронная конфигурация ls22s22p4 соответствует частице
1) О2- 3) с2+
2) 02+ 4) С2-
9.Электронная конфигурация ls22s2 соответствует частице
1) С4~ 3) С2+
2) С4+ 4) С2'
Слайд 15Задания ЕГЭ . Изменение свойств элементов в периодической таблице
10. Кислотные
свойства в ряду высших гидроксидов серы — хлора — иода
1) возрастают
2) ослабевают
3) сначала возрастают, затем ослабевают
4) сначала ослабевают, затем возрастают
11. Электронная конфигурация ls22s22p63s23p6 отвечает
1) атому аргона и атому хлора
2) атому аргона и атому калия
3) сульфид-иону и катиону лития
4) атому аргона и хлорид-иону
12. Кислотные свойства в ряду высших оксидов алюминия — кремния — углерода
1) возрастают
2) ослабевают
3) сначала возрастают, затем ослабевают
4) сначала ослабевают, затем возрастают
13. Электронная конфигурация ls22s22p2 соответствует частице
1)О2- 3) С2+
2) 02+ 4) С2~
1) возрастают
2) ослабевают
3) сначала возрастают, затем ослабевают
4) сначала ослабевают, затем возрастают
11. Электронная конфигурация ls22s22p63s23p6 отвечает
1) атому аргона и атому хлора
2) атому аргона и атому калия
3) сульфид-иону и катиону лития
4) атому аргона и хлорид-иону
12. Кислотные свойства в ряду высших оксидов алюминия — кремния — углерода
1) возрастают
2) ослабевают
3) сначала возрастают, затем ослабевают
4) сначала ослабевают, затем возрастают
13. Электронная конфигурация ls22s22p2 соответствует частице
1)О2- 3) С2+
2) 02+ 4) С2~
Слайд 16Задания ЕГЭ . Изменение свойств элементов в периодической таблице
14. Атомы химических
элементов четвертого периодаимеют одинаковое число:
1) электронов на внешнем энергетическом уровне;
2) нейтронов;
3) энергетических уровней;
4) протонов.
15.Строение атомов элементов IIа группы сходно по:
1) числу электронов в атоме;
2) числу электронов на внешнем слое;
3) числу энергетических уровней на электронной оболочке;
4) радиусам атомов.
16. Наименьший радиус имеет атом:
1)фтора; 2) бериллия; 3) бария; 4) кремния
17. Атому с наибольшим радиусом соответствует электронная конфигурация:
1) 1s22s 22p63s23p1;
2) 1s22s22p4;
3) 1s22s22p63s23p5;
4) 1s22s22p2.
18. Элемент, имеющий электронную конфигурацию 1s22s22p63s23p64s2, в периодической системе находится в:
1) 3-м периоде, VIIIб группе;
2) 4-м периоде, IIа группе;
3) 4-м периоде, IIв группе;
4) 3-м периоде, VIIIа группе.
1) электронов на внешнем энергетическом уровне;
2) нейтронов;
3) энергетических уровней;
4) протонов.
15.Строение атомов элементов IIа группы сходно по:
1) числу электронов в атоме;
2) числу электронов на внешнем слое;
3) числу энергетических уровней на электронной оболочке;
4) радиусам атомов.
16. Наименьший радиус имеет атом:
1)фтора; 2) бериллия; 3) бария; 4) кремния
17. Атому с наибольшим радиусом соответствует электронная конфигурация:
1) 1s22s 22p63s23p1;
2) 1s22s22p4;
3) 1s22s22p63s23p5;
4) 1s22s22p2.
18. Элемент, имеющий электронную конфигурацию 1s22s22p63s23p64s2, в периодической системе находится в:
1) 3-м периоде, VIIIб группе;
2) 4-м периоде, IIа группе;
3) 4-м периоде, IIв группе;
4) 3-м периоде, VIIIа группе.
Слайд 17Задания ЕГЭ . Изменение свойств элементов в периодической таблице
19. Сходную конфигурацию
внешнего энергетического уровня имеют элементы хлор и:
1)марганец; 2) сера; 3) аргон; 4) бром.
20. В порядке усиления неметаллических свойств простых веществ образующие их элементы расположены в ряду:
1) C, Si, Ge; 2) Se, S, O; 3) F, O, N; 4) Se, As, Ge.
21. Легче всего присоединяют электроны атомы:
1)хлора; 2) серы; 3) селена; 4) брома.
22. Оксид и соответствующий ему гидроксид с наиболее выраженными основными свойствами образует:
1)стронций; 2) кальций; 3) индий; 4) алюминий.
23. Летучие водородные соединения состава ЭН3 образуют:
1) Be, Ca, Sr; 2) P, As, Sb; 3) Ga, Al, B; 4) Fe, S, Sc.
24. У соединений элементов 3-го периода слева направо возрастают:
1) основные свойства высших гидроксидов;
2) восстановительные свойства водородных соединений;
3) кислотные свойства высших гидроксидов;
4) основные свойства высших оксидов.
25. Устойчивость водородных соединений элементов VIа группы с ростом заряда ядра атома:
1) увеличивается;
2) уменьшается;
3) не изменяется;
4) сначала увеличивается, затем уменьшается
1)марганец; 2) сера; 3) аргон; 4) бром.
20. В порядке усиления неметаллических свойств простых веществ образующие их элементы расположены в ряду:
1) C, Si, Ge; 2) Se, S, O; 3) F, O, N; 4) Se, As, Ge.
21. Легче всего присоединяют электроны атомы:
1)хлора; 2) серы; 3) селена; 4) брома.
22. Оксид и соответствующий ему гидроксид с наиболее выраженными основными свойствами образует:
1)стронций; 2) кальций; 3) индий; 4) алюминий.
23. Летучие водородные соединения состава ЭН3 образуют:
1) Be, Ca, Sr; 2) P, As, Sb; 3) Ga, Al, B; 4) Fe, S, Sc.
24. У соединений элементов 3-го периода слева направо возрастают:
1) основные свойства высших гидроксидов;
2) восстановительные свойства водородных соединений;
3) кислотные свойства высших гидроксидов;
4) основные свойства высших оксидов.
25. Устойчивость водородных соединений элементов VIа группы с ростом заряда ядра атома:
1) увеличивается;
2) уменьшается;
3) не изменяется;
4) сначала увеличивается, затем уменьшается
Слайд 18Задания ЕГЭ . Изменение свойств элементов в периодической таблице
26. В
ряду химических элементов бор - углерод - азот возрастает
1) способность атома отдавать электроны 2) высшая степень окисления
3) низшая степень окисления 4) радиус атома
27. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
28. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва 2) Na, Mg, A1 3) K,Ca,Fe 4) Sc, Ca, Mg
29. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
30.Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
31.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
1) способность атома отдавать электроны 2) высшая степень окисления
3) низшая степень окисления 4) радиус атома
27. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
28. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва 2) Na, Mg, A1 3) K,Ca,Fe 4) Sc, Ca, Mg
29. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
30.Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
31.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
Слайд 19Задания ЕГЭ . Изменение свойств элементов в периодической таблице
32.Электронную конфигурацию
1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
33. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p12) 1s22s22p63s1 3) 1s22s2 4) 1s22s22p63s23p1
34..Одинаковую электронную конфигурацию имеют атомы неона и ионы:
2+ 2– + 2+
1)Mg 2) S 3) Cl 4) Be
35. Строение атомов элементов IIа группы сходно по:
1) числу электронов в атоме;
2) числу электронов на внешнем слое;
3) числу энергетических уровней на электронной оболочке;
4) радиусам атомов
36. Среди всех элементов 3-го периода элемент натрий обладает...
1) самой высокой электроотрицательностью
2) наиболее выраженными металлическими свойствами
3) самым маленьким радиусом атома
4) самой большой плотностью
37. Сотый элемент периодической системы Д.И. Менделеева является
1) s – элементом 2) p– элементом 3) d – элементом 4) f – элементом
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
33. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p12) 1s22s22p63s1 3) 1s22s2 4) 1s22s22p63s23p1
34..Одинаковую электронную конфигурацию имеют атомы неона и ионы:
2+ 2– + 2+
1)Mg 2) S 3) Cl 4) Be
35. Строение атомов элементов IIа группы сходно по:
1) числу электронов в атоме;
2) числу электронов на внешнем слое;
3) числу энергетических уровней на электронной оболочке;
4) радиусам атомов
36. Среди всех элементов 3-го периода элемент натрий обладает...
1) самой высокой электроотрицательностью
2) наиболее выраженными металлическими свойствами
3) самым маленьким радиусом атома
4) самой большой плотностью
37. Сотый элемент периодической системы Д.И. Менделеева является
1) s – элементом 2) p– элементом 3) d – элементом 4) f – элементом
Слайд 20Задания ЕГЭ . Изменение свойств элементов в периодической таблице
38.Притяжение электронов
внешнего слоя к ядру увеличивается в ряду:
1) Si – P – N 2) S – P – As 3) Na – K – Rb 4) Sr – Ca – K
39.Притяжение электронов внешнего слоя к ядру ослабевает в ряду:
1) Al - Mg - Ca 2) Al - Si - C 3) Na - Mg - Be 4) Se - S - Cl
40.Способность атома притягивать валентные электроны других атомов увеличивается в ряду:
1) Mg, Ca, Ba 2) Si, S, Cl 3) Р, О, S 4) F, Cl, Br
41.Способность отдавать электроны атомом элемента увеличивается в ряду
l) Ca, Mg, Be 2)B, C, F 3) Al, Mg, Na 4) S, Cl, F
4 2.Способность принимать электроны атомом элемента увеличивается в ряду с порядковыми номерами:
1) 16,20 2) 6, 11 3) 12,17 4) 9,10
43.Верны ли следующие суждения о неметаллах?
А. В периодической системе неметаллы расположены в правой, преимущественно верхней части.
Б. Среди неметаллов нет ни одного d- элемента.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
1) Si – P – N 2) S – P – As 3) Na – K – Rb 4) Sr – Ca – K
39.Притяжение электронов внешнего слоя к ядру ослабевает в ряду:
1) Al - Mg - Ca 2) Al - Si - C 3) Na - Mg - Be 4) Se - S - Cl
40.Способность атома притягивать валентные электроны других атомов увеличивается в ряду:
1) Mg, Ca, Ba 2) Si, S, Cl 3) Р, О, S 4) F, Cl, Br
41.Способность отдавать электроны атомом элемента увеличивается в ряду
l) Ca, Mg, Be 2)B, C, F 3) Al, Mg, Na 4) S, Cl, F
4 2.Способность принимать электроны атомом элемента увеличивается в ряду с порядковыми номерами:
1) 16,20 2) 6, 11 3) 12,17 4) 9,10
43.Верны ли следующие суждения о неметаллах?
А. В периодической системе неметаллы расположены в правой, преимущественно верхней части.
Б. Среди неметаллов нет ни одного d- элемента.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны