- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад открытого урока PowerPoint
Содержание
- 1. Презентация открытого урока PowerPoint
- 2. Цели: углубить и обобщить знания о скорости
- 3. Вопросы ученикам:Приведите примеры реакций, увеличения или уменьшение
- 4. Подготовить таблицы для составления опорного конспекта
- 5. Слайд 5
- 6. 2 этап. Исследовательская работа в группах.1-я группа
- 7. Слайд 7
- 8. 3 этап отчёты групп о проделанной работе:
- 9. Природа реагирующих веществMg + HCl→MgCl2+H2Быстрое выделение
- 10. Площадь соприкосновения реагирующих веществ.Zn( порошок)+HCl→ZnCl2+H2Быстрое выделение газаZn(гранула)+HCl→ZnCl2+H2Медленное
- 11. 4 этап обсуждение вопроса о важности изучения
- 12. 5 этап Подведение итогов работы на уроке:
- 13. Спасибо за внимание.Подготовила Сидорова Татьяна Викторовна -Учитель химии МБОУ Гимназия №1 г.Туапсе
Слайд 1«Факторы, влияющие на скорость химической реакции»
Семинар-практикум
Девиз урока:
«Практика есть основа
Слайд 2Цели:
углубить и обобщить знания о скорости химической реакции;
зависимости скорости гомогенных
уметь экспериментально подтверждать влияние отдельных факторов на скорость химических реакций.
Продолжить формирование таких логических приёмов, как наблюдение, анализ, сравнение и обобщение.
Способствовать обучению специфическим умениям коллективной деятельности.
Слайд 3Вопросы ученикам:
Приведите примеры реакций, увеличения или уменьшение скорости которых имеет положительное
Чем измеряется скорость химических реакций в отличие от скорости в механике?
Как изменяется скорость химической реакции с течением времени , если не вмешиваться в ход её течения?
Что такое концентрация , почему ставят знак (-) перед формулой , для каких реакций верна формула? Дайте определение гомогенной и гетерогенной реакции? Приведите примеры.
1 этап.
Слайд 62 этап. Исследовательская работа в группах.
1-я группа изучает влияние природы
2-я группа влияние концентрации.
3-я группа влияние температуры .
4-я группа исследует влияние катализатора
на скорость химической реакции.
5-я группа влияние площади поверхности реагирующих веществ на скорость гетерогенной химической реакции.
Повторить правила техники безопасности!!!
Слайд 9Природа реагирующих веществ
Mg + HCl→MgCl2+H2
Быстрое выделение газа.
Fe+HCl→ FeCl2+H2
Медленное выделение
Чем активнее металл, тем быстрее протекает реакция.
Концентрация
Zn+ HCl (1:1)→ZnCl2+H2
Быстрое выделение газа
Zn+ HCl (1:5)→ZnCl2+H2
Медленное выделение газа
Чем больше концентрация, тем быстрее протекает реакция.
Температура
Нагревание
Zn+ HCl→ZnCl2+H2
Быстрое выделение газа.
без Нагревания
Zn+ HCl→ZnCl2+H2
Медленное выделение газа.
Катализаторы
MnO2
H2O2→H2O+O2 быстро
Без катализатора ;
H2O2→H2O+O2 медленно
Чем больше температура, тем быстрее протекает реакция.
В присутствии катализатора реакция протекает быстрее.
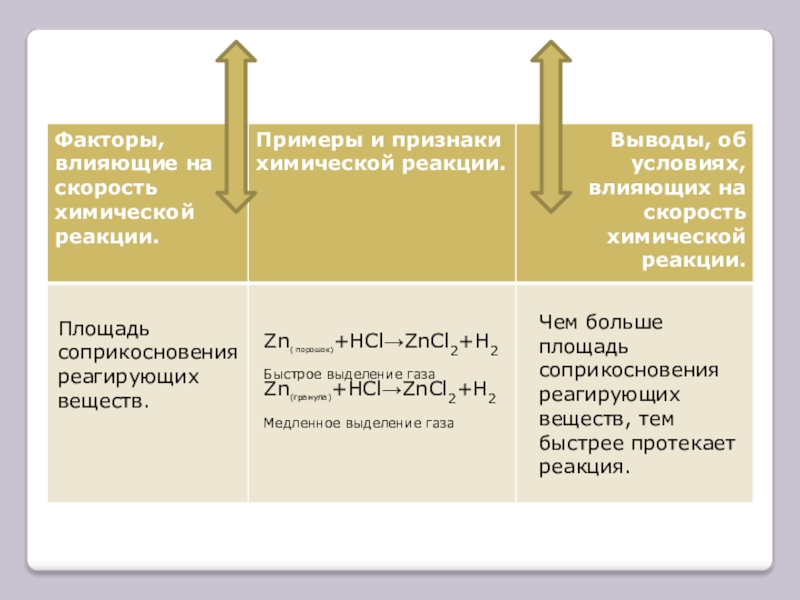
Слайд 10Площадь соприкосновения реагирующих веществ.
Zn( порошок)+HCl→ZnCl2+H2
Быстрое выделение газа
Zn(гранула)+HCl→ZnCl2+H2
Медленное выделение газа
Чем больше площадь
Слайд 114 этап обсуждение вопроса о важности изучения кинетики химических реакций.
Почему в
Почему скоропортящиеся продукты хранят в холодильнике?
Объясните принцип действия скороварки.
Как объяснить, что для разложения сахарозы в пробирке , подкисленный раствор надо кипятить, а в пищеварительном тракте этот же процесс протекает при температуре 37 градусов и значительно быстрее?
Какую продукцию вырабатывает химическая промышленность, которую получают на основе использования катализаторов?
Зачем нужны знания о скорости химической реакции?