высшей категории
МБОУ Рассветовской СОШ
Нор-Аревян К.М. - учитель информатики высшей
категории МБОУ Рассветовской СОШ
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад отчёт об уроке с использованием цифровой лаборатории
Содержание
- 1. Презентация отчёт об уроке с использованием цифровой лаборатории
- 2. Цели урока:«Единственный путь,
- 3. Цели урока в рамках ФГОСПланируемые результаты:ЛичностныеПродолжить формирование
- 4. ВВЕДЕНИЕ – ВЫВОД УЧАЩИХСЯ НА ТЕМУ УРОКА
- 5. ОБСУЖДЕНИЕ МЕХАНИЗМА РАСТВОРЕНИЯ ВЕЩЕСТВ: - ДИФФУЗИЯ
- 6. Слайд 6
- 7. Слайд 7
- 8. 123D:\Эксперимент №запуститьНовый экспериментсохранить
- 9. 12приостановитьостановить
- 10. Эксперимент – 1.Измерение температурысвежеприготовленных растворов неорганических веществ.1. Возьмите
- 11. Эксперимент: Измерение температуры приготовленных растворов:
- 12. Эксперимент: Измерение температуры приготовленных растворов:
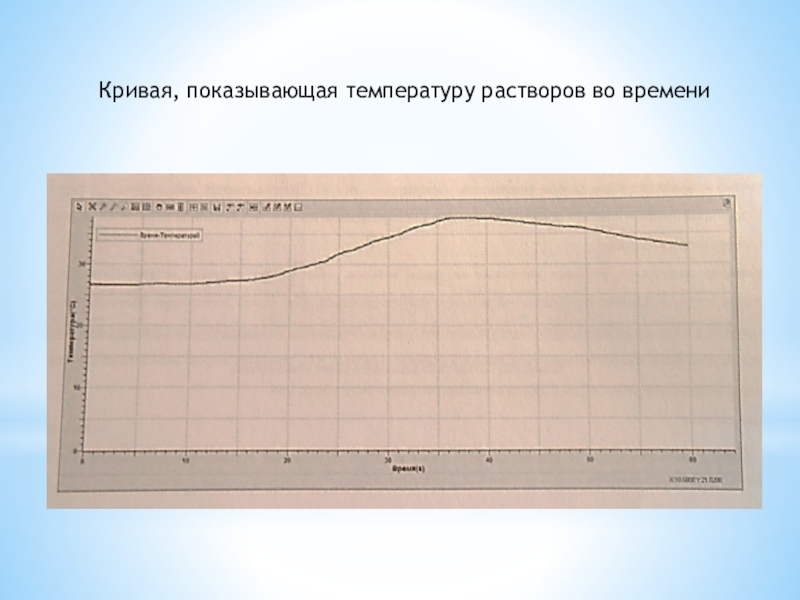
- 13. Кривая, показывающая температуру растворов во времени
- 14. Слайд 14
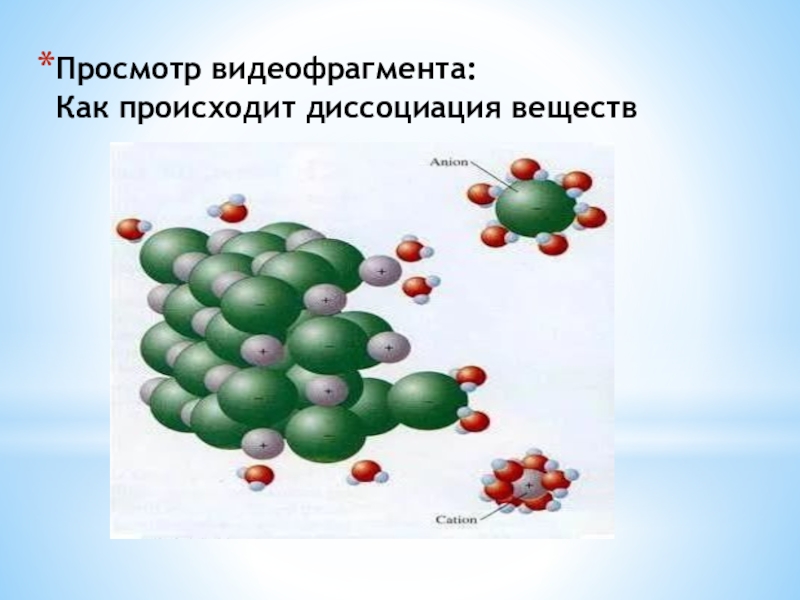
- 15. Просмотр видеофрагмента: Как происходит диссоциация веществ
- 16. Просмотр видеофрагмента: Как происходит диссоциация веществ
- 17. Просмотр видеофрагмента: Как происходит диссоциация веществ
- 18. Уравнения диссоциации электролитов
- 19. Исследование свойств растворов электролитов
- 20. Исследование электропроводности 1 молярных растворов солей хлорида
- 21. исследование электропроводности растворов
- 22. Кривая, показывающая электропроводность растворов
- 23. Слайд 23
- 24. Анализ экспериментальных данныхФакт: электропроводность хлорида алюминия выше электропроводности хлорида натрия
- 25. Анализ экспериментальных данныхПроблема: почему электропроводность одной соли больше чем другой?
- 26. Анализ экспериментальных данныхГипотеза: чем количество заряженных частиц в растворе больше, тем выше его электропроводность
- 27. Анализ экспериментальных данныхПроверка гипотезы: запись уравнений диссоциации солей и их анализ
- 28. Слайд 28
- 29. Рефлексия
- 30. Слайд 30
- 31. Спасибо за внимание
Цели урока:«Единственный путь, ведущий к знанию – это деятельность».(Б.Шоу)Образовательные:Изучить механизм растворения электролитов в воде;Научиться записывать процесс диссоциации при помощи химических знаков и формул;Исследовать свойства растворов электролитов;Использовать межпредметные связи курсов информатики и химии
Слайд 1Механизм растворения
электролитов
Свойства растворов
электролитов
Урок провели:
Пономарева М.В. – учитель химии
Слайд 2
Цели урока:
«Единственный путь, ведущий к знанию – это деятельность».
(Б.Шоу)
Образовательные:
Изучить механизм растворения
электролитов в воде;
Научиться записывать процесс диссоциации при помощи химических знаков и формул;
Исследовать свойства растворов электролитов;
Использовать межпредметные связи курсов информатики и химии для более осознанного изучения этих явлений.
Развивающие:
совершенствовать исследовательские умения учащихся: проводить эксперимент, сравнивать и анализировать, классифицировать, выдвигать гипотезы, обобщать, делать выводы.
Воспитательные:
воспитание положительной мотивации учения, правильной самооценки, трудолюбия, целеустремленности, умения работать в группе.
Научиться записывать процесс диссоциации при помощи химических знаков и формул;
Исследовать свойства растворов электролитов;
Использовать межпредметные связи курсов информатики и химии для более осознанного изучения этих явлений.
Развивающие:
совершенствовать исследовательские умения учащихся: проводить эксперимент, сравнивать и анализировать, классифицировать, выдвигать гипотезы, обобщать, делать выводы.
Воспитательные:
воспитание положительной мотивации учения, правильной самооценки, трудолюбия, целеустремленности, умения работать в группе.
Слайд 3Цели урока в рамках ФГОС
Планируемые результаты:
Личностные
Продолжить формирование устойчивого познавательного интереса
Метапредметные
Познавательные:
проводить наблюдение, анализ; выдвигать гипотезы, формулировать выводы.
Регулятивные: преобразовывать практическую задачу в познавательную; осуществлять контроль и
оценку своих действий
Коммуникативные: умение формулировать высказывание; умение адекватно использовать речевые
средства и символы для представления результата; планировать свою деятельность;
сравнивать, анализировать; умение работать совместно в атмосфере сотрудничества;
обмениваться знаниями между членами группы для формулировки общих выводов
Предметные
Знать механизм растворения электролитов в воде;
Уметь составлять уравнения диссоциации электролитов, пользоваться таблицей растворимости кислот, солей и оснований;
Развитие умений проводить химический эксперимент, фиксировать результаты
Продолжить формирование убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире;
Развивать навыки работы с компьютером, программным обеспечением, устройствами ввода.
Регулятивные: преобразовывать практическую задачу в познавательную; осуществлять контроль и
оценку своих действий
Коммуникативные: умение формулировать высказывание; умение адекватно использовать речевые
средства и символы для представления результата; планировать свою деятельность;
сравнивать, анализировать; умение работать совместно в атмосфере сотрудничества;
обмениваться знаниями между членами группы для формулировки общих выводов
Предметные
Знать механизм растворения электролитов в воде;
Уметь составлять уравнения диссоциации электролитов, пользоваться таблицей растворимости кислот, солей и оснований;
Развитие умений проводить химический эксперимент, фиксировать результаты
Продолжить формирование убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире;
Развивать навыки работы с компьютером, программным обеспечением, устройствами ввода.
Слайд 5ОБСУЖДЕНИЕ МЕХАНИЗМА РАСТВОРЕНИЯ ВЕЩЕСТВ:
- ДИФФУЗИЯ
- исследование процессов, происходящих при растворении электролитов
Слайд 10Эксперимент – 1.
Измерение температуры
свежеприготовленных растворов неорганических веществ.
1. Возьмите три пронумерованных химических стакана.
2. Налейте
в них воду до метки.
3. Возьмите стакан №1 и с помощью температурного электрода
измеряйте температуру образца в течении 2 -3 секунд .
4. Возьмите стакан №2, добавьте в него ложку гидроксида натрия
- NaOH аккуратно перемешайте смесь.
5. Измеряйте температуру образца в течении 2 -3 секунд
6. Возьмите стакан №3, добавьте в него ложку нитрата натрия -
NaNO3, аккуратно перемешайте смесь.
7. Измеряйте температуру образца, в течении 2 -3 секунд
3. Возьмите стакан №1 и с помощью температурного электрода
измеряйте температуру образца в течении 2 -3 секунд .
4. Возьмите стакан №2, добавьте в него ложку гидроксида натрия
- NaOH аккуратно перемешайте смесь.
5. Измеряйте температуру образца в течении 2 -3 секунд
6. Возьмите стакан №3, добавьте в него ложку нитрата натрия -
NaNO3, аккуратно перемешайте смесь.
7. Измеряйте температуру образца, в течении 2 -3 секунд
Слайд 20Исследование электропроводности 1 молярных растворов солей хлорида натрия – NaCl и хлорида
алюминия - AlCl3
в зависимости от количества капель этого раствора в одинаковом объёме воды
Слайд 24Анализ экспериментальных данных
Факт: электропроводность хлорида алюминия выше электропроводности хлорида натрия
Слайд 25Анализ экспериментальных данных
Проблема: почему электропроводность одной соли больше чем другой?
Слайд 26Анализ экспериментальных данных
Гипотеза: чем количество заряженных частиц в растворе больше, тем
выше его электропроводность