- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Особенности реакций окисления углеводородов.
Содержание
- 1. Презентация Особенности реакций окисления углеводородов.
- 2. Общие понятия В органической
- 3. Окисление алканов Учитывая
- 4. Окисление алкановСтепень окисления углерода определяется по количеству атомов водорода , связанных с ним.
- 5. Окисление алкановУравнение реакции горения алканов в общем
- 6. Окисление алканов
- 7. Окисление алкановВажное значение имеет реакция взаимодействия метана
- 8. Реакции окисления алкеновСтроение продуктов окисления алкенов зависит
- 9. Реакции окисления алкеновСхема электронного баланса реакции окисления
- 10. Реакции окисления алкенов2. При жестком окислении алкенов кипящим
- 11. Реакции окисления алкеновЕсли двойная связь находится на
- 12. Реакции окисления алкенов Если в молекуле
- 13. 3. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:
- 14. Реакции окисления алкенов4. Полное окисление (горение): Газообразные гомологи алкенов образуют с воздухом взрывоопасные смеси.
- 15. Окисление алкинов Ацетилен и его гомологи легко
- 16. Окисление алкинов 2. Алкины обесцвечивают разбавленный раствор
- 17. Окисление алкинов 3. При сгорании алкинов происходит
- 18. Реакции окисления аренов Бензол не окисляется даже
- 19. Реакции окисления аренов При действии раствора KMnO4
- 20. Реакции окисления аренов Алкильные группы в алкилбензолах
- 21. Реакции окисления аренов Гомологи бензола могут быть
- 22. Закрепление (на алкены)1) CH3CH=CHCH2CH3 + KMnO4 +
- 23. Закрепление (на алкены)3) CH3CH=CHCH2CH3 + KMnO4 +
- 24. 1) 5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 →
- 25. Закрепление (на алкины)Ацетилен может быть окислен перманганатом
- 26. Проверка1) 3C2H2 + 8KMnO4 = 3K2C2O4 +2H2O
- 27. Использованные источники и Интернет-ресурс1. Габриелян О.С., Остроумов
Общие понятия В органической химии реакции окисления и восстановления рассматриваются как реакции, связанные с потерей и приобретением органическим соединением атомов водорода и кислорода. Эти процессы, естественно, сопровождаются изменением степеней окисления атомов. Окисление органического
Слайд 1Особенности реакций окисления углеводородов
к элективному курсу «Механизмы реакций в органической химии»,
10 класс
Автор: Ким Н.В.
учитель химии
МОУСОШ №6 г. Нягани ХМАО-Югры, 2009 год.
Слайд 2Общие понятия
В органической химии реакции окисления
и восстановления рассматриваются как реакции, связанные с потерей и приобретением органическим соединением атомов водорода и кислорода. Эти процессы, естественно, сопровождаются изменением степеней окисления атомов.
Окисление органического вещества - введение в его состав кислорода и (или) отщепление водорода. Восстановление - обратный процесс (введение водорода и отщепление кислорода).
Окисление органического вещества - введение в его состав кислорода и (или) отщепление водорода. Восстановление - обратный процесс (введение водорода и отщепление кислорода).
Слайд 3Окисление алканов
Учитывая состав алканов (СnH2n+2), можно
сделать вывод о их неспособности вступать в реакции восстановления, но возможности участвовать в реакциях окисления.
Алканы - соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое пламя алканы горят.
При этом в избытке кислорода происходит их полное окисление до СО2 и воды.
Алканы - соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое пламя алканы горят.
При этом в избытке кислорода происходит их полное окисление до СО2 и воды.
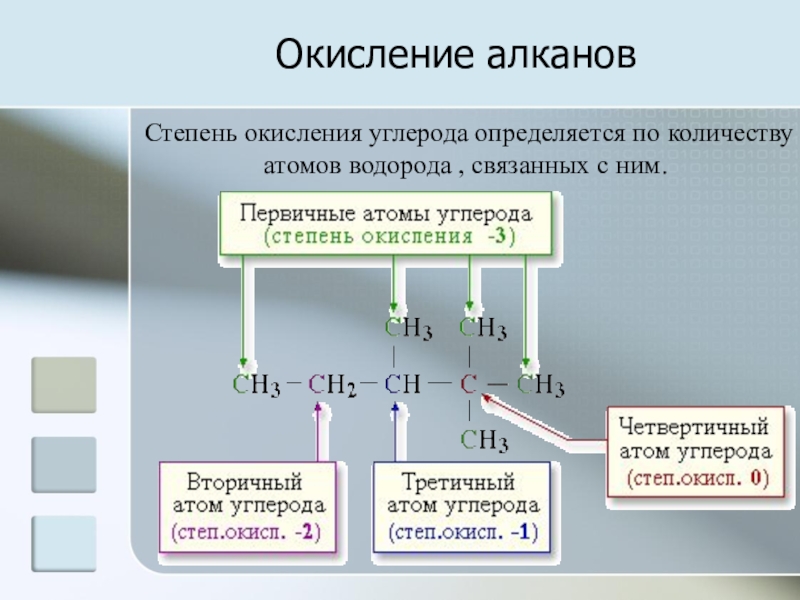
Слайд 4Окисление алканов
Степень окисления углерода определяется по количеству атомов водорода , связанных
с ним.
Слайд 5Окисление алканов
Уравнение реакции горения алканов в общем виде:
Если кислорода недостаточно
для их полного окисления до СО2,то образуются продукты частичного окисления:
угарный газ СО (степень окисления углерода +2),
сажа С (мелкодисперсный углерод, нулевая степень окисления), например:
Слайд 6Окисление алканов
Частичное окисление алканов при
относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту:
Слайд 7Окисление алканов
Важное значение имеет реакция взаимодействия метана с водяным паром, в
результате которой образуется смесь оксида углерода (II) с водородом - "синтез-газ":
Эта реакция используется для получения водорода.
Синтез-газ служит сырьем для получения различных углеводородов.
Эта реакция используется для получения водорода.
Синтез-газ служит сырьем для получения различных углеводородов.
Слайд 8Реакции окисления алкенов
Строение продуктов окисления алкенов зависит от условий реакции и
природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера):
Полное уравнение реакции:
Реакция используется как качественная реакция на алкены.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера):
Полное уравнение реакции:
Реакция используется как качественная реакция на алкены.
Слайд 9Реакции окисления алкенов
Схема электронного баланса реакции окисления этилена раствором KMnO4
Полное уравнение
реакции:
Электронный баланс:
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4.
Электронный баланс:
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4.
Слайд 10Реакции окисления алкенов
2. При жестком окислении алкенов кипящим раствором KMnO4 в кислой
среде происходит полный разрыв двойной связи:
Полное уравнение реакции:
5 СН3-СН=СН-СН3 + 8 КMnO4 + 12 H2SO4 →
19 CH3-COOH + 8 MnSO4 + 4 K2SO4 + 12 H2O
Полное уравнение реакции:
5 СН3-СН=СН-СН3 + 8 КMnO4 + 12 H2SO4 →
19 CH3-COOH + 8 MnSO4 + 4 K2SO4 + 12 H2O
Слайд 11Реакции окисления алкенов
Если двойная связь находится на конце молекулы (например, в
случае бутена – 1), то одним из продуктов окисления станет муравьиная кислота, распадающаяся тотчас на углекислый газ и воду, т.е.
СН3-СН2-СН=СН2 →[О] → СН3-СН2-СООН + [НСООН]
→ [О] → СН3-СН2-СООН + СО2↑ +Н2О
Полное уравнение
СН3-СН2-СН=СН2 + 2 КMnO4 + 3 H2SO4 →
СН3-СН2-СООН +2 MnSO4 + K2SO4 + 4 H2O + СО2
СН3-СН2-СН=СН2 →[О] → СН3-СН2-СООН + [НСООН]
→ [О] → СН3-СН2-СООН + СО2↑ +Н2О
Полное уравнение
СН3-СН2-СН=СН2 + 2 КMnO4 + 3 H2SO4 →
СН3-СН2-СООН +2 MnSO4 + K2SO4 + 4 H2O + СО2
Слайд 12Реакции окисления алкенов
Если в молекуле алкена содержатся заместители при
двойной связи (например, 2 – метилбутен-2), то при его окислении происходит образование кетона, так как превращение такого атома в в атом карбоксильной группы невозможно без разрыва С-С связи (она более сильная!), т.е.:
(СН3)2С=СН-СН3 →[О] → (СН3)2С=О + СН3-СООН
2-метилбутен-2 кетон кислота
Полное уравнение:
5 (СН3)2С=СН-СН3 + 6 КMnO4 + 9 H2SO4 →
5(СН3)2С=О +6MnSO4 +3K2SO4 + 5СН3-СООН
+ 9H2O
(СН3)2С=СН-СН3 →[О] → (СН3)2С=О + СН3-СООН
2-метилбутен-2 кетон кислота
Полное уравнение:
5 (СН3)2С=СН-СН3 + 6 КMnO4 + 9 H2SO4 →
5(СН3)2С=О +6MnSO4 +3K2SO4 + 5СН3-СООН
+ 9H2O
Слайд 13
3. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые
широко используются в органическом синтезе:
Слайд 14Реакции окисления алкенов
4. Полное окисление (горение):
Газообразные гомологи алкенов образуют с воздухом
взрывоопасные смеси.
Слайд 15Окисление алкинов
Ацетилен и его гомологи легко окисляются различными окислителями (перманганатом
калия в кислой и щелочной среде, дихроматом калия в кислой среде и др.). Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
1. При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
Слайд 16Окисление алкинов
2. Алкины обесцвечивают разбавленный раствор перманганата калия, что используется
для доказательства их ненасыщенности. В этих условиях происходит мягкое окисление без разрыва σ-связи С–С (разрушаются только π-связи).
Например, при взаимодействии ацетилена с разбавленным раствором KMnO4 при комнатной температуре возможны следующие превращения с образованием щавелевой кислоты HOOC–COOH:
Например, при взаимодействии ацетилена с разбавленным раствором KMnO4 при комнатной температуре возможны следующие превращения с образованием щавелевой кислоты HOOC–COOH:
Слайд 17Окисление алкинов
3. При сгорании алкинов происходит их полное окисление до
CO2 и H2O. Горение ацетилена сопровождается выделением большого количества тепла (Q = 1300 кДж/моль):
Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии ацетилен способен взрываться от удара. Поэтому он хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест или кизельгур
Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии ацетилен способен взрываться от удара. Поэтому он хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест или кизельгур
При сгорании алкинов происходит их полное окисление до CO2 и H2O. Горение ацетилена сопровождается выделением большого количества тепла (Q = 1300 кДж/моль):
Слайд 18Реакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей
(KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко.
В отличие от бензола его гомологи окисляются довольно легко.
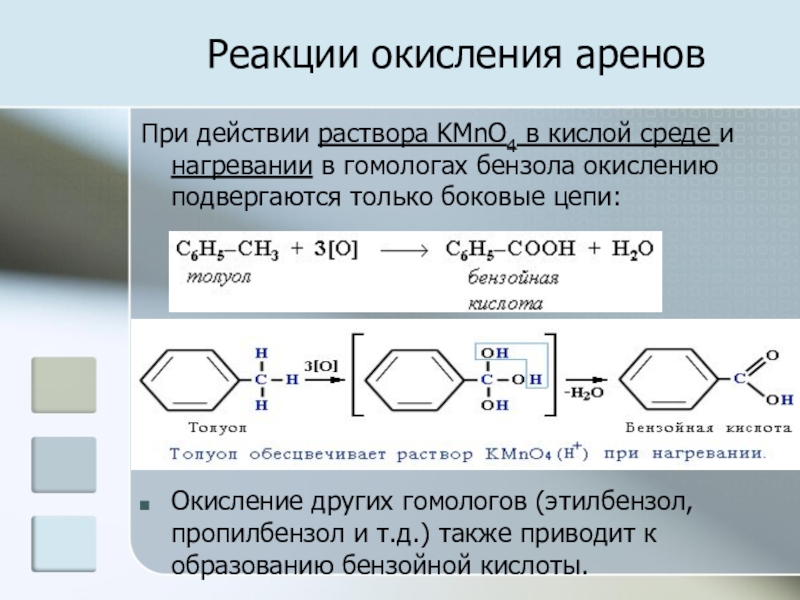
Слайд 19Реакции окисления аренов
При действии раствора KMnO4 в кислой среде и
нагревании в гомологах бензола окислению подвергаются только боковые цепи:
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты.
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты.
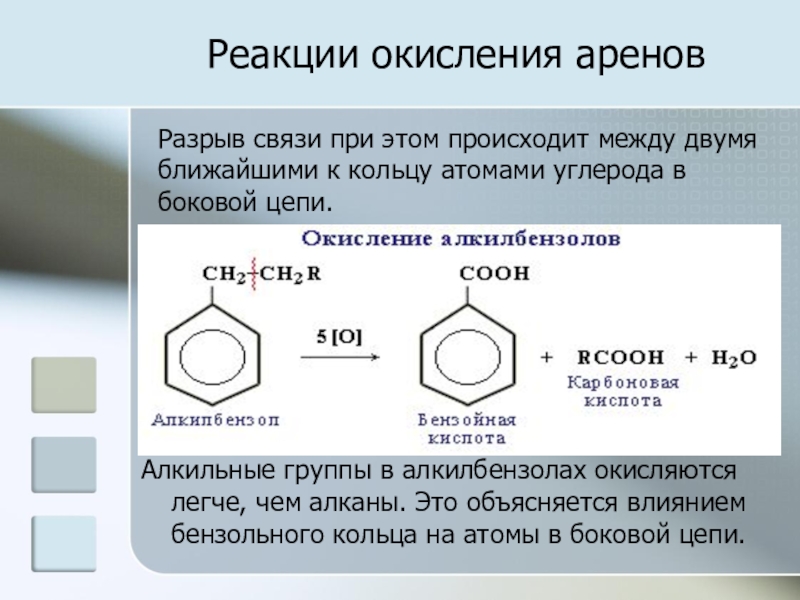
Слайд 20Реакции окисления аренов
Алкильные группы в алкилбензолах окисляются легче, чем алканы.
Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Слайд 21Реакции окисления аренов
Гомологи бензола могут быть окислены раствором перманганата калия
в нейтральной среде до бензоата калия:
C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O (при кипячении)
C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH (при нагревании)
C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O (при кипячении)
C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH (при нагревании)
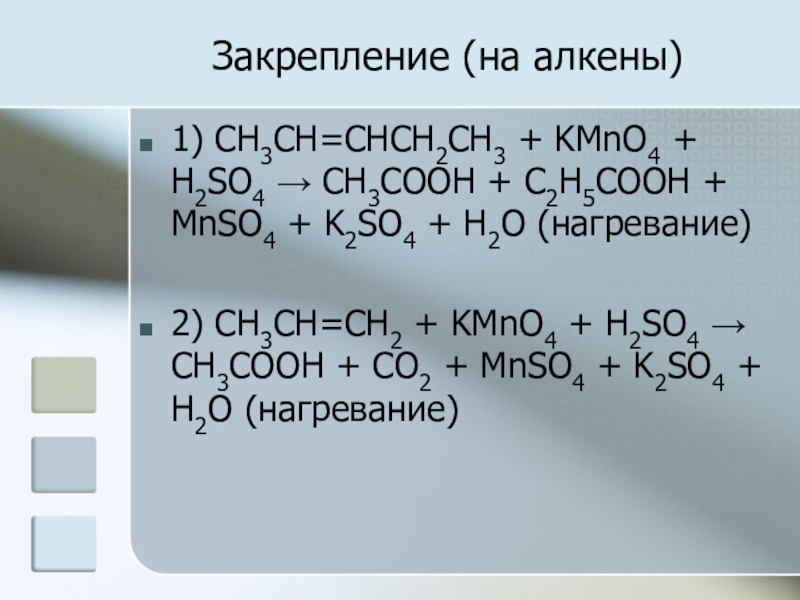
Слайд 22Закрепление (на алкены)
1) CH3CH=CHCH2CH3 + KMnO4 + H2SO4 → CH3COOH +
C2H5COOH + MnSO4 + K2SO4 + H2O (нагревание)
2) CH3CH=CH2 + KMnO4 + H2SO4 → CH3COOH + CO2 + MnSO4 + K2SO4 + H2O (нагревание)
2) CH3CH=CH2 + KMnO4 + H2SO4 → CH3COOH + CO2 + MnSO4 + K2SO4 + H2O (нагревание)
Слайд 23Закрепление (на алкены)
3) CH3CH=CHCH2CH3 + KMnO4 + KOH → CH3COOK +
C2H5COOK + H2O + K2MnO4 (нагревание)
4) CH3CH=CH2 + KMnO4 + KOH → CH3COOK + K2CO3 + H2O + K2MnO4 (нагревание)
4) CH3CH=CH2 + KMnO4 + KOH → CH3COOK + K2CO3 + H2O + K2MnO4 (нагревание)
Слайд 241) 5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH +
8MnSO4 + 4K2SO4 + 17H2O (нагревание)
2) 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O (нагревание)
3) CH3CH=CHCH2CH3 + 6KMnO4 + 10KOH → CH3COOK + C2H5COOK + 6H2O + 6K2MnO4 (нагревание)
4) CH3CH=CH2 + 10KMnO4 + 13KOH → CH3COOK + K2CO3 + 8H2O + 10K2MnO4 (нагревание)
2) 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 → 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O (нагревание)
3) CH3CH=CHCH2CH3 + 6KMnO4 + 10KOH → CH3COOK + C2H5COOK + 6H2O + 6K2MnO4 (нагревание)
4) CH3CH=CH2 + 10KMnO4 + 13KOH → CH3COOK + K2CO3 + 8H2O + 10K2MnO4 (нагревание)
Слайд 25Закрепление (на алкины)
Ацетилен может быть окислен перманганатом калия в слабощелочной среде
до оксалата калия:
1) C2H2 + KMnO4 = K2C2O4 +H2O + MnO2 + KOH
В кислотной среде окисление идет до углекислого газа:
2) C2H2 + KMnO4 +H2SO4 =CO2 + MnSO4 + H2O + K2SO4
1) C2H2 + KMnO4 = K2C2O4 +H2O + MnO2 + KOH
В кислотной среде окисление идет до углекислого газа:
2) C2H2 + KMnO4 +H2SO4 =CO2 + MnSO4 + H2O + K2SO4
Слайд 26Проверка
1) 3C2H2 + 8KMnO4 = 3K2C2O4 +2H2O + 8MnO2 + 2KOH
2)
C2H2 + 2KMnO4 +3H2SO4 =2CO2 + 2MnSO4 + 4H2O + K2SO4
Слайд 27Использованные источники и Интернет-ресурс
1. Габриелян О.С., Остроумов И.Г., Карцова А.А. Органическая
химия. – Москва. Просвещение. 2004.
2. Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия.- Москва. Дрофа. 2004.
3. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии (в двух томах). – Москва. Экзамен. 2004.
4. Потапов В.М., Чертков И.Н. Строение и свойства органических соединений. – Москва. Просвещение, 1984.
5. Книга для чтения по органической химии (Сост. П.Ф.Буцкус). – Москва. Просвещение. 1985.
6. Методические указания по органической химии для слушателей вечерней химической школы. (МХТИ им. Д.И.Менделеева). – Москва. 1990.
http://www.chemistry.ssu.samara.ru/chem5/index5.htm
2. Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия.- Москва. Дрофа. 2004.
3. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии (в двух томах). – Москва. Экзамен. 2004.
4. Потапов В.М., Чертков И.Н. Строение и свойства органических соединений. – Москва. Просвещение, 1984.
5. Книга для чтения по органической химии (Сост. П.Ф.Буцкус). – Москва. Просвещение. 1985.
6. Методические указания по органической химии для слушателей вечерней химической школы. (МХТИ им. Д.И.Менделеева). – Москва. 1990.
http://www.chemistry.ssu.samara.ru/chem5/index5.htm