- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Основные положения теории Бутлерова
Содержание
- 1. Презентация Основные положения теории Бутлерова
- 2. БутлеровАлекса́ндр Миха́йлович Бу́тлеров (3 сентября 1828, Чистополь
- 3. 1. Атомы в молекулах соединены друг с
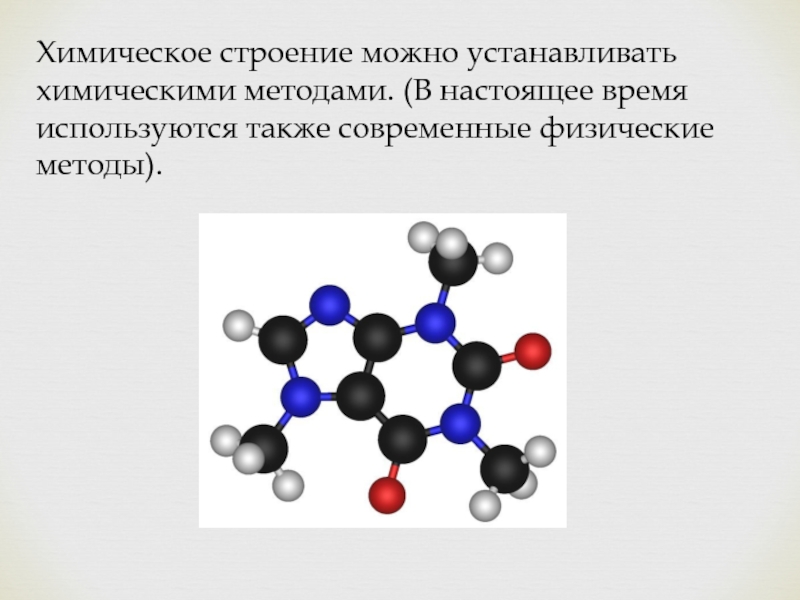
- 4. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
- 5. Свойства веществ зависят от их химического строения.
- 6. Атомы и группы атомов в молекуле оказывают
- 7. Атомная орбиталь — одноэлектронная волновая функция, полученная
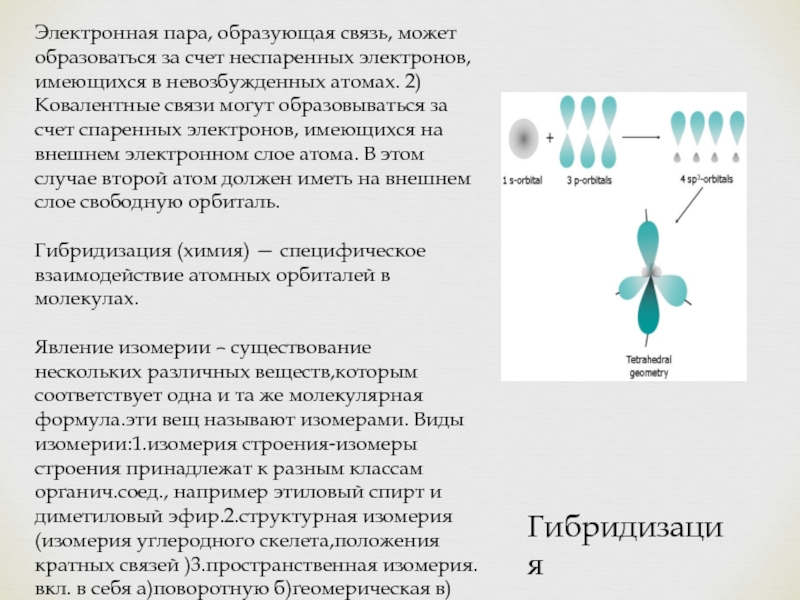
- 8. Электронная пара, образующая связь, может образоваться за
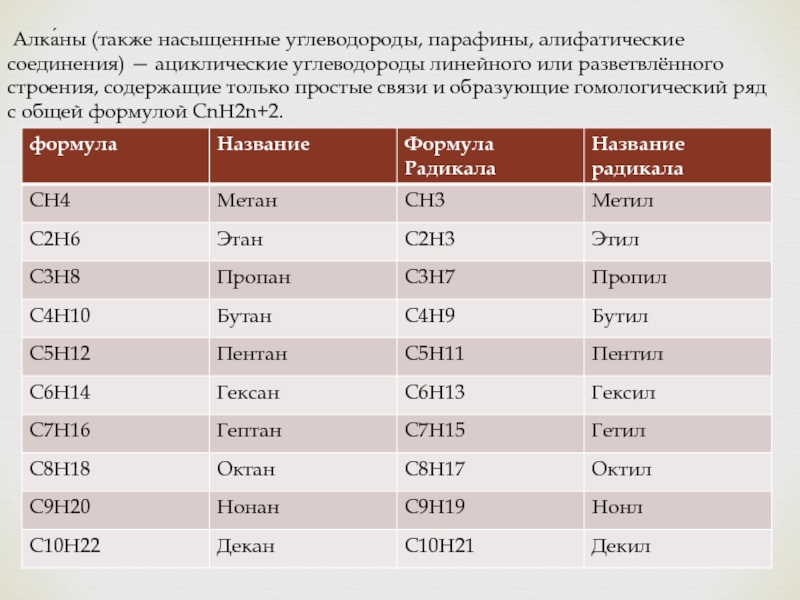
- 9. Алка́ны (также насыщенные углеводороды, парафины, алифатические
- 10. Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения)
- 11. Галогенирование — это одна из реакций замещения.
- 12. При нагревании выше 500 °C алканы подвергаются
- 13. Образование:1) В углеродном скелете 2 (этан) или
- 14. ГорениеОсновным химическим свойством предельных углеводородов, определяющих их
- 15. Правило Марковниковав органической химии правило, используемое для
- 16. R-CH=CH2+HCl – R-CH2-CH2ClОкисление алкенов может происходить в
- 17. Спасибо за внимание.
БутлеровАлекса́ндр Миха́йлович Бу́тлеров (3 сентября 1828, Чистополь — 5 августа 1886, деревня Бутлеровка, ныне Алексеевский район Татарстана) — русский химик, создатель теории химического строения органических веществ, родоначальник «бутлеровской школы» русских химиков, учёный-пчеловод и лепидоптеролог, общественный деятель,
Слайд 2Бутлеров
Алекса́ндр Миха́йлович Бу́тлеров (3 сентября 1828, Чистополь — 5 августа 1886,
деревня Бутлеровка, ныне Алексеевский район Татарстана) — русский химик, создатель теории химического строения органических веществ, родоначальник «бутлеровской школы» русских химиков, учёный-пчеловод и лепидоптеролог, общественный деятель, ректор Императорского Казанского университета в 1860—1863 годах.
Слайд 3
1. Атомы в молекулах соединены друг с другом в определенной последовательности
согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Слайд 4Химическое строение можно устанавливать химическими методами. (В настоящее время используются также
современные физические методы).
Слайд 5Свойства веществ зависят от их химического строения.
По свойствам данного вещества
можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
Слайд 6Атомы и группы атомов в молекуле оказывают взаимное влияние друг на
друга.Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.Развитию теории строения способствовали работы Кекуле, Кольбе, Купера и Вант-Гоффа. Однако их теоретические положения не носили общего характера и служили, главным образом, целям объяснения экспериментального материала.Скелетная формула органических соединений — формула, изображающая структурную формулу химического органического соединенияв «свёрнутом» виде, не отображающим связи углерод—водород, а также атомы водорода и углерода. На атом углерода указывает излом цепи или ее окончание, если к нему не присоединена какая-либо не углеводородная группа.Скелетные формулы органических соединений являются сокращенным представлением молекулярной структуры, они широко распространены в органической химии, поскольку они чётко показывают сложные структуры органических соединений.
Слайд 7Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для
данного атома, задаётся главным n, орбитальным l и магнитным mквантовыми числами.МО) - одноэлект-ронная многоцентровая волновая функция, описывающая состояние отд. электрона молекулы, движущегося в усреднённомполе остальных электронов и в поле её ядерного остова. МО включает пространственную j(r) и спиновую q(sz )компоненты и часто наз. спин-орбиталью:
Слайд 8Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся
в невозбужденных атомах. 2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь.
Гибридизация (химия) — специфическое взаимодействие атомных орбиталей в молекулах.
Явление изомерии – существование нескольких различных веществ,которым соответствует одна и та же молекулярная формула.эти вещ называют изомерами. Виды изомерии:1.изомерия строения-изомеры строения принадлежат к разным классам органич.соед., например этиловый спирт и диметиловый эфир.2.структурная изомерия(изомерия углеродного скелета,положения кратных связей )3.пространственная изомерия.вкл. в себя а)поворотную б)геомерическая в)оптическая
Гибридизация (химия) — специфическое взаимодействие атомных орбиталей в молекулах.
Явление изомерии – существование нескольких различных веществ,которым соответствует одна и та же молекулярная формула.эти вещ называют изомерами. Виды изомерии:1.изомерия строения-изомеры строения принадлежат к разным классам органич.соед., например этиловый спирт и диметиловый эфир.2.структурная изомерия(изомерия углеродного скелета,положения кратных связей )3.пространственная изомерия.вкл. в себя а)поворотную б)геомерическая в)оптическая
Гибридизация
Слайд 9 Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды
линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Слайд 10Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного
или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2. Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть. Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть. Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Слайд 11Галогенирование — это одна из реакций замещения. В первую очередь галогенируется
наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
1. CH4 + Cl2 → CH3Cl (хлорметан) + HCl
2. CH3Cl + Cl2 → CH2Cl2 (дихлорметан) + HCl
3. CH2Cl2 + Cl2 → CHCl3 (трихлорметан) + HCl
4. CHCl3 + Cl2 → CCl4 (тетрахлорметан) + HCl.
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
1. CH4 + Cl2 → CH3Cl (хлорметан) + HCl
2. CH3Cl + Cl2 → CH2Cl2 (дихлорметан) + HCl
3. CH2Cl2 + Cl2 → CHCl3 (трихлорметан) + HCl
4. CHCl3 + Cl2 → CCl4 (тетрахлорметан) + HCl.
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Слайд 12При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием
сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах —400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах —400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Крекинг
Слайд 13Образование:
1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода
— получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3.
а) CH3-CH3 → CH2=CH2 + H2 (этан → этен);
б) CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен).
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода:
в) CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3 — дегидрирование удалённых связей С-С).
в') CH3-CH2-CH2-CH3 → CH2=C=CH-CH3 + 2H2 (бутан → бутадиен-1,2 — дегидрирование соседних связей С-С-С).
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
г) CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 4H2.
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3.
а) CH3-CH3 → CH2=CH2 + H2 (этан → этен);
б) CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен).
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода:
в) CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3 — дегидрирование удалённых связей С-С).
в') CH3-CH2-CH2-CH3 → CH2=C=CH-CH3 + 2H2 (бутан → бутадиен-1,2 — дегидрирование соседних связей С-С-С).
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
г) CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 4H2.
Дегидрирование
Слайд 14Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива,
является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q.
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
CH4 + 2O2 → CO2 + 2H2O + Q.
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
Слайд 15Правило Марковникова
в органической химии правило, используемое для предсказаниярегиоселективности реакции присоединения протонных
кислот и воды к несимметричным алкенам иалкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химикомВ. В. Марковниковым в 1869 году.
В условиях, способствующих гомолитическому разрыву связи, (высокая температура, облучение, наличие свободных радикалов и пр.) присоединение к алкенам происходит порадикальному механизму.
В условиях, способствующих гомолитическому разрыву связи, (высокая температура, облучение, наличие свободных радикалов и пр.) присоединение к алкенам происходит порадикальному механизму.
Слайд 16R-CH=CH2+HCl – R-CH2-CH2Cl
Окисление алкенов может происходить в зависимости от условий и
видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета.
Окисление неорганическими окислителями
В мягких условиях возможно окисление посредством присоединения по двойной связи двух гидроксильных групп:
На первом этапе происходит присоединение оксида осмия к алкену, затем под действием воосстановителя (Zn или NaHSO3) образовавшийся комплекс переходит к диолу (Реакция Криге).
Аналогично реакция идет в нейтральной или слабощелочной среде под действием KMnO4 (Реакция Вагнера):
При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:
(кетон)
Некоторые окислители, например нитрат (III) таллия, окисляют алкены с перегруппировкой по следующей схеме:
Окисление в присутствии солей палладия
В присутствии солей палладия этилен окисляется до ацетальдегида:
Окисление неорганическими окислителями
В мягких условиях возможно окисление посредством присоединения по двойной связи двух гидроксильных групп:
На первом этапе происходит присоединение оксида осмия к алкену, затем под действием воосстановителя (Zn или NaHSO3) образовавшийся комплекс переходит к диолу (Реакция Криге).
Аналогично реакция идет в нейтральной или слабощелочной среде под действием KMnO4 (Реакция Вагнера):
При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:
(кетон)
Некоторые окислители, например нитрат (III) таллия, окисляют алкены с перегруппировкой по следующей схеме:
Окисление в присутствии солей палладия
В присутствии солей палладия этилен окисляется до ацетальдегида: