- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Оксиды углерода 9 класс
Содержание
- 1. Презентация Оксиды углерода 9 класс
- 2. Слайд 2
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Вывод однозначен – все это аллотропные модификации
- 7. Оксиды углеродаСформировать знания об оксиде углерода (II) и оксиде углерода (IV)
- 8. Рассмотреть строение, получение, химические свойства и применение оксидов углерода;Выявить биологическое действие изучаемых веществ на живые организмы.
- 9. Угарный газ - ядовитое вещество!2С + О2 = 2СОСО2 + С = 2СО
- 10. Мr(СО) = 282СО + О2 = 2СО2Физические
- 11. Способы полученияУглекислый газ — условно ядовитое
- 12. Мr(СО2) = 44Физические свойстваЦвета, запаха не имеет.
- 13. СО2 + H2О = H2СО3СО2 – окислитель!Химические
- 14. Химический диктант
- 15. Оксид углерода (IV)1
- 16. СO2
- 17. Окислитель3
- 18. Не имеет запаха4
- 19. Растворим в воде5
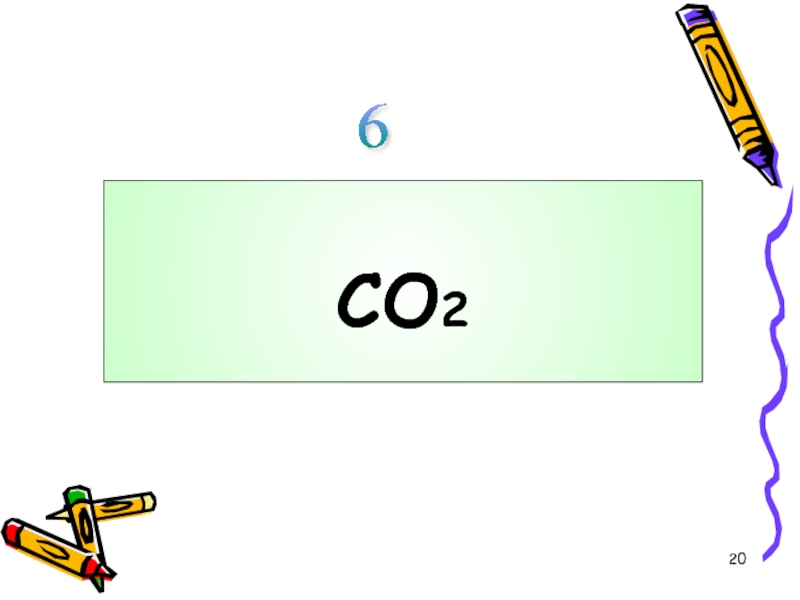
- 20. СO26
- 21. Восстановитель7
Слайд 6Вывод однозначен – все это аллотропные модификации атома углерода!
У элемента номер
Достоинств очень много есть.
«Людям я совсем как брат.
Много тысяч лет назад
Я уже пылал в костре,
Освещая интерьер
Первобытных их пещер.
И украсить был я рад
Дам и рыцарей наряд,
Что блистали при дворе…
Если мягким быть решу,-
То в тетради я пишу.»
Такова, друзья, природа
Элемента углерода!
Однако, и соединения этого необычного атома не менее интересны…
Слайд 8Рассмотреть строение, получение, химические свойства и применение оксидов углерода;
Выявить биологическое действие
Слайд 10Мr(СО) = 28
2СО + О2 = 2СО2
Физические свойства
Цвета, запаха не имеет.
В
Химические свойства
СО – сильный
восстановитель!
~
Мr(возд.) = 29
Слайд 11Способы получения
Углекислый газ —
условно ядовитое вещество
С + О2 = СО2
2СО
СаСО3 = СО2 + СаО
СаСО3 + 2HCl = H2О + СО2 + СаCl2
Слайд 12Мr(СО2) = 44
Физические свойства
Цвета, запаха не имеет.
Хорошо растворяется в воде.
Способы распознавания
Не
w
Мr(возд.) = 29
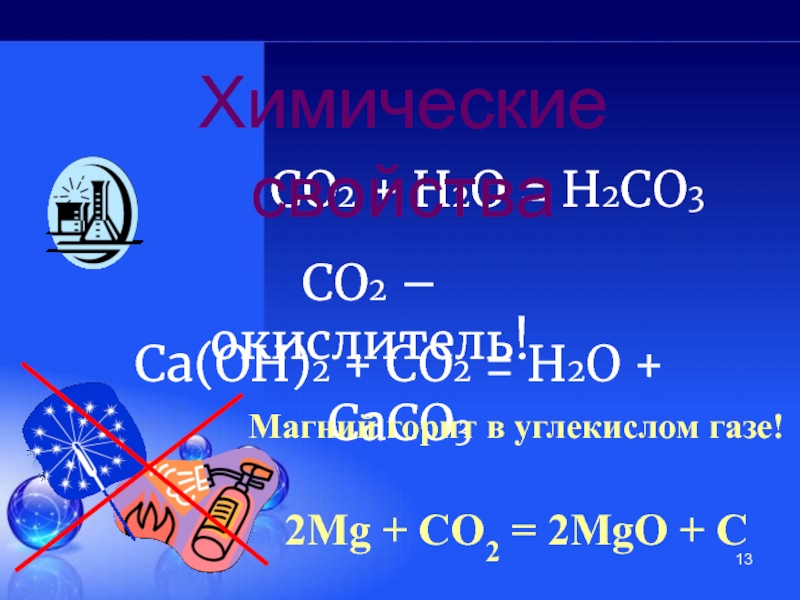
Слайд 13СО2 + H2О = H2СО3
СО2 – окислитель!
Химические свойства
Са(ОН)2 + СО2 =
Магний горит в углекислом газе!
2Мg + CO2 = 2MgO + C