Красноярск
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Окислительно-восстановительные реакции 11 класс
Содержание
- 1. Презентация Окислительно-восстановительные реакции 11 класс
- 2. Классификация реакцийПротекающие без изменения степени окисленияAg +1Cl
- 3. Понятие окислительно-восстановительных реакций Химические реакции, протекающие
- 4. Окисление - процесс отдачи электронов атомом, молекулой
- 5. Восстановление - процесс присоединения электронов
- 6. Восстановители - атомы,
- 7. ВосстановителиПростые вещества металлы могут быть только восстановителями.
- 8. Окислители - атомы, молекулы или
- 9. ОкислителиПростые вещества являющиеся только окислителями – это
- 10. На проявление окислительно-восстановительных свойств влияет такой фактор,
- 11. Например, азот имеет высокую электроотрицательность и мог
- 12. Различают:минимальную (низшую) степень окисления
- 13. Окислительно-восстановительная двойственностьВещества, содержащие в составе атомы элементов
- 14. Степени окисления серы: -2,0,+4,+6 Н2S-2 - восстановитель2Н2S+3O2=2H2O+2SO2S0,S+4O2
- 15. Определение степеней окисления атомов химических элементовС.о. атомов
- 16. Классификация окислительно-восстановительных реакцийРеакции межмолекулярного окисления2Al0 + 3Cl20
- 17. Это полезно знатьСтепени окисления элементов в составе
- 18. Азотная кислота в окислительно-восстановительных реакцияхПродукты восстановления азота:Концентрированная
- 19. Составление уравнений ОВР Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций
- 20. 1. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции:FeCl3 +
- 21. 3. Cocтавим электронные урaвнeния, вырaжaющиe прoцeccы окиcлeния и вoccтанoвлeния.
- 22. 5. Подберем стехиометрические коэффициенты ocтaльныx учacтникoв рeaкции, пeрeйдeм oт сxeмы к
- 23. Ионно-электронный методДостоинства методаВ нем применяются не гипотетические
- 24. Ионно-электронный методИзбыток ионов О2- связывается:в кислой среде
- 25. Влияние некоторых факторов на характер протекания реакции Степень
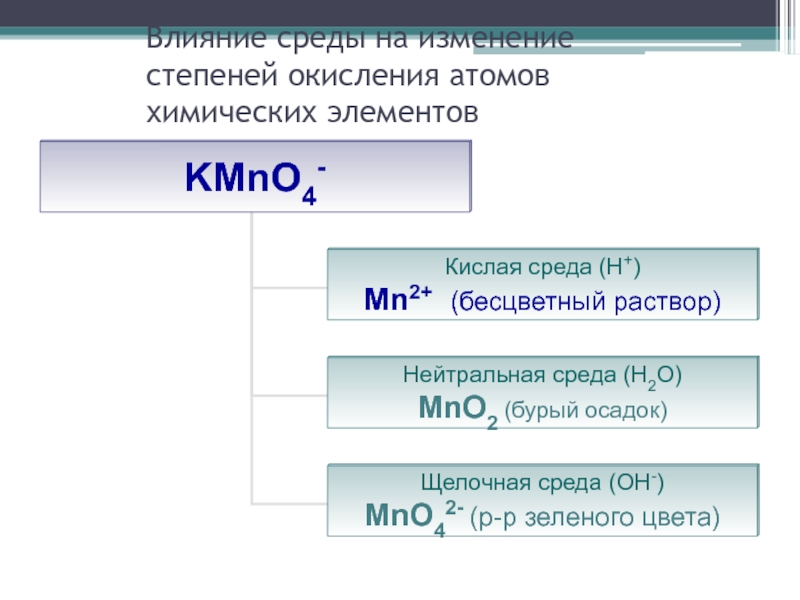
- 26. Влияние среды на изменение степеней окисления атомов химических элементов
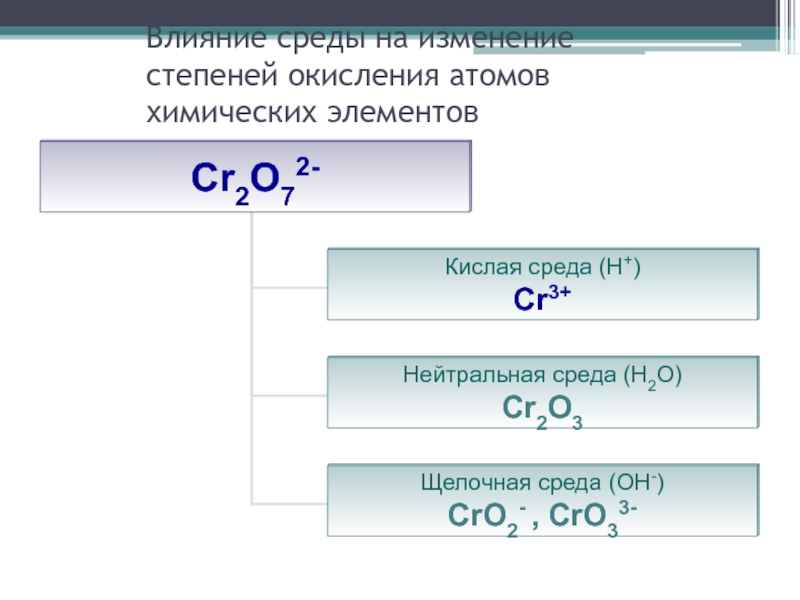
- 27. Влияние среды на изменение степеней окисления атомов химических элементов
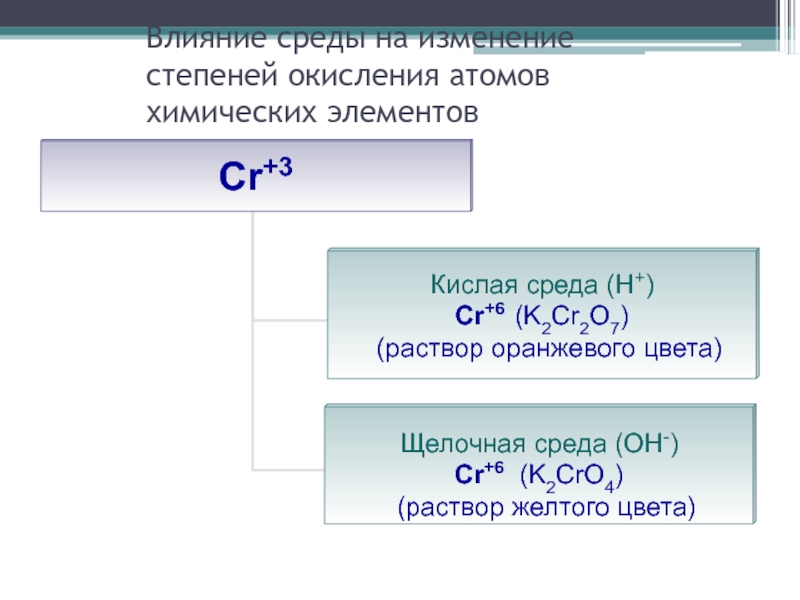
- 28. Влияние среды на изменение степеней окисления атомов химических элементов
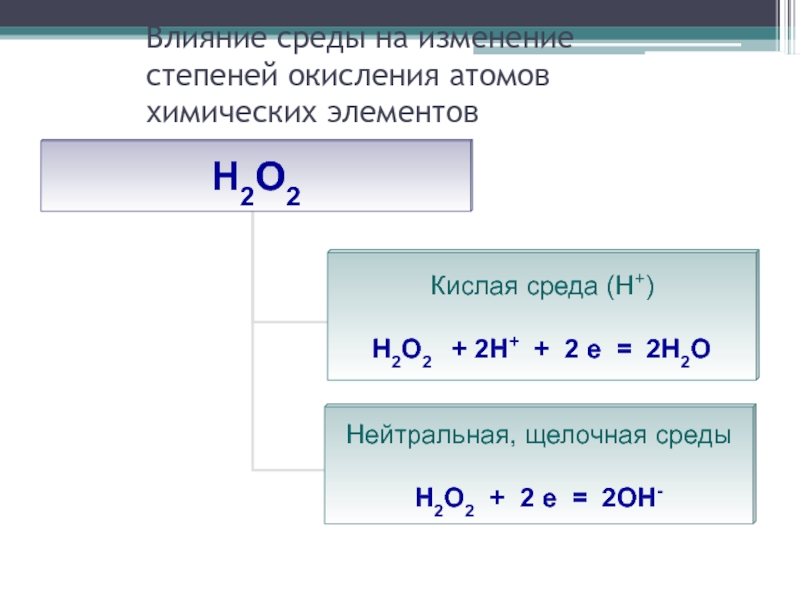
- 29. Влияние среды на изменение степеней окисления атомов химических элементов
- 30. Значение ОВРОВР чрезвычайно распространены. С ними связаны
- 31. ЛитератураВолодина, М.А, Решетникова, Л.П., Кузяков, Ю.А., Мастрюков,
Классификация реакцийПротекающие без изменения степени окисленияAg +1Cl -1+Na +12S -2 Ag +12S -2+Na +1Cl-1Окислительно-восстановительные реакцииH 02 +O 02 H +12O-2
Слайд 1Окислительно-восстановительные реакции
Назарова Светлана Николаевна
Краевое бюджетное общеобразовательное учреждение "Школа дистанционного образования»
г.
Слайд 2Классификация реакций
Протекающие без изменения степени окисления
Ag +1Cl -1+Na +12S -2
Ag
+12S -2+Na +1Cl-1
Окислительно-восстановительные реакции
H 02 +O 02 H +12O-2
Слайд 3Понятие окислительно-восстановительных реакций
Химические реакции, протекающие
с изменением
степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными
Слайд 4Окисление - процесс отдачи электронов атомом, молекулой или ионом.
Атом превращается в
положительно заряженный ион: Zn0 – 2e → Zn2+
отрицательно заряженный ион становится нейтральным атомом: 2Cl- -2e →Cl20
S2- -2e →S0
Величина положительно заряженного иона (атома) увеличивается соответственно числу отданных электронов: Fe2+ -1e →Fe3+
Mn+2 -2e →Mn+4
отрицательно заряженный ион становится нейтральным атомом: 2Cl- -2e →Cl20
S2- -2e →S0
Величина положительно заряженного иона (атома) увеличивается соответственно числу отданных электронов: Fe2+ -1e →Fe3+
Mn+2 -2e →Mn+4
Слайд 5 Восстановление - процесс присоединения электронов атомом, молекулой или ионом.
Атом
превращается в отрицательно заряженный ион
S0 + 2e → S2−
Br0 + e → Br −
Величина положительно заряженного иона (атома)
уменьшается соответственно числу присоединенных электронов: Mn+7 + 5e → Mn+2
S+6 + 2e → S+4
− или он может перейти в нейтральный атом:
Н+ + е → Н0
Cu2+ + 2e → Cu0
S0 + 2e → S2−
Br0 + e → Br −
Величина положительно заряженного иона (атома)
уменьшается соответственно числу присоединенных электронов: Mn+7 + 5e → Mn+2
S+6 + 2e → S+4
− или он может перейти в нейтральный атом:
Н+ + е → Н0
Cu2+ + 2e → Cu0
Слайд 6 Восстановители - атомы, молекулы или
ионы, отдающие электроны. Они в процессе
ОВР окисляются
Типичные восстановители:
● атомы металлов с большими атомными радиусами (I-А, II-А группы), а так же Fe, Al, Zn
● простые вещества-неметаллы: водород, углерод, бор;
● отрицательно заряженные ионы: Cl−, Br−, I−, S2−, N−3. Не являются восстановителем фторид- ионы F−.
● ионы металлов в низшей с.о.: Fe2+,Cu+,Mn2+,Cr3+;
● сложные ионы и молекулы, содержащие атомы с промежуточной с.о.: SO32−, NO2−; СО, MnO2 и др.
ОВР окисляются
Типичные восстановители:
● атомы металлов с большими атомными радиусами (I-А, II-А группы), а так же Fe, Al, Zn
● простые вещества-неметаллы: водород, углерод, бор;
● отрицательно заряженные ионы: Cl−, Br−, I−, S2−, N−3. Не являются восстановителем фторид- ионы F−.
● ионы металлов в низшей с.о.: Fe2+,Cu+,Mn2+,Cr3+;
● сложные ионы и молекулы, содержащие атомы с промежуточной с.о.: SO32−, NO2−; СО, MnO2 и др.
Слайд 7Восстановители
Простые вещества металлы могут быть только восстановителями.
В периодах с возрастанием
атомного номера восстановительные свойства элементов ослабевают.
В главных подгруппах с увеличением атомного номера восстановительные свойства возрастают.
Сложные вещества являются восстановителями, если в их составе содержатся атомы элемента в минимальной степени окисления.
N -3H 3 H2 S -2 HBr -1
В главных подгруппах с увеличением атомного номера восстановительные свойства возрастают.
Сложные вещества являются восстановителями, если в их составе содержатся атомы элемента в минимальной степени окисления.
N -3H 3 H2 S -2 HBr -1
Слайд 8 Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они
в процессе ОВР восстанавливаются
Типичные окислители:
● атомы неметаллов VII-А, VI-А, V-A группы в составе простых веществ
● ионы металлов в высшей с.о.:
Cu2+, Fe3+,Ag+ …
● сложные ионы и молекулы, содержащие атомы с высшей и высокой с.о.: SO42−, NO3−, MnO4−, СlО3−, Cr2O72-, SO3, MnO2 и др.
Типичные окислители:
● атомы неметаллов VII-А, VI-А, V-A группы в составе простых веществ
● ионы металлов в высшей с.о.:
Cu2+, Fe3+,Ag+ …
● сложные ионы и молекулы, содержащие атомы с высшей и высокой с.о.: SO42−, NO3−, MnO4−, СlО3−, Cr2O72-, SO3, MnO2 и др.
Слайд 9Окислители
Простые вещества являющиеся только окислителями – это фтор и кислород (кроме
реакции со фтором).
В периодах с возрастанием атомного номера окислительные свойства усиливаются.
В главных подгруппах с возрастанием атомного номера окислительные свойства ослабевают.
Сложные вещества являются окислителями, если в их состав входят атомы элементов в высшей степени окисления.
S+6O3 HN+5O3 KMn+7O4
В периодах с возрастанием атомного номера окислительные свойства усиливаются.
В главных подгруппах с возрастанием атомного номера окислительные свойства ослабевают.
Сложные вещества являются окислителями, если в их состав входят атомы элементов в высшей степени окисления.
S+6O3 HN+5O3 KMn+7O4
Слайд 10На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или
иона. Чем прочнее частица, тем в меньшей степени она проявляет окислительно-восстановительные свойства
Слайд 11Например, азот имеет высокую электроотрицательность и мог бы быть сильным окислителем
в виде простого вещества, но в его молекуле тройная связь, молекула очень устойчивая, азот химически пассивен.
Слайд 12Различают:
минимальную (низшую) степень окисления
S-2 2e- 8e-
8e-
промежуточную степень окисления
S0 2e- 8e- 6e-
максимальную (высшую) степень окисления
S+6 2e- 8e- 0e-
Атом, находящийся в минимальной степени окисления, может быть только восстановителем.
S-2 -2е = S0 S-2- 6е = S+4 S-2-8е = S+6
Атом, находящийся в максимальной степени окисления, может быть только окислителем.
S+6 +2е = S+4 S+6+ 6е = S0 S+6- 8е =S-2
Атом, находящийся в промежуточной степени окисления может быть как восстановителем, так и окислителем.
S0 +2е = S-2 S0 - 4е = S+4
промежуточную степень окисления
S0 2e- 8e- 6e-
максимальную (высшую) степень окисления
S+6 2e- 8e- 0e-
Атом, находящийся в минимальной степени окисления, может быть только восстановителем.
S-2 -2е = S0 S-2- 6е = S+4 S-2-8е = S+6
Атом, находящийся в максимальной степени окисления, может быть только окислителем.
S+6 +2е = S+4 S+6+ 6е = S0 S+6- 8е =S-2
Атом, находящийся в промежуточной степени окисления может быть как восстановителем, так и окислителем.
S0 +2е = S-2 S0 - 4е = S+4
Слайд 13Окислительно-восстановительная двойственность
Вещества, содержащие в составе атомы элементов в промежуточной степени окисления,
способны проявлять как окислительные, так и восстановительные свойства.
S+4O2 HN+3O2
S+4 N+3
S-2 S+6 N-3 N+5
S+4O2 HN+3O2
S+4 N+3
S-2 S+6 N-3 N+5
+6е
-2е
+6е
-2е
Слайд 14Степени окисления серы: -2,0,+4,+6
Н2S-2 - восстановитель
2Н2S+3O2=2H2O+2SO2
S0,S+4O2 – окислитель и восстановитель
S+O2=SO2
2SO2+O2=2SO3 (восстановитель)
S+2Na=Na2S SO2+2H2S=3S+2H2O
(окислитель)
Н2S+6O4 - окислитель
Cu+2H2SO4=CuSO4+SO2+2H2O
S+2Na=Na2S SO2+2H2S=3S+2H2O
(окислитель)
Н2S+6O4 - окислитель
Cu+2H2SO4=CuSO4+SO2+2H2O
Слайд 15Определение степеней окисления атомов химических элементов
С.о. атомов х/э в составе простого
вeщества = 0
Алгебраическая сумма с.о. всех элементов в составе иона равна заряду иона
Алгебраическая сумма с.о. всех элементов в составе сложного вещества равна 0.
Алгебраическая сумма с.о. всех элементов в составе иона равна заряду иона
Алгебраическая сумма с.о. всех элементов в составе сложного вещества равна 0.
K+1 Mn+7 O4-2
1+х+4(-2)=0
Слайд 16Классификация окислительно-восстановительных реакций
Реакции межмолекулярного окисления
2Al0 + 3Cl20 → 2Al+3 Cl3-1
Реакции внутримолекулярного
окисления
2KCl+5O3-2 →2KCl-1 + 3O20
Реакции диспропорционирования, дисмутации
(самоокисления-самовосстановления):
3Cl20 + 6KOH (гор.) →KCl+5O3 +5KCl-1+3H2O
2N+4O2+ H2O →HN+3O2 + HN+5O3
2KCl+5O3-2 →2KCl-1 + 3O20
Реакции диспропорционирования, дисмутации
(самоокисления-самовосстановления):
3Cl20 + 6KOH (гор.) →KCl+5O3 +5KCl-1+3H2O
2N+4O2+ H2O →HN+3O2 + HN+5O3
Слайд 17Это полезно знать
Степени окисления элементов в составе аниона соли такие же,
как и в кислоте, например: (NH4)2Cr2+6O7 и H2Cr2+6O7
Степень окисления кислорода в пероксидах
равна -1
Степень окисления серы в некоторых сульфидах равна -1, например: FeS2
Фтор- единственный неметалл, не имеющий в соединениях положительной степени окисления
В соединениях NH3, CH4 и др. знак электроположительного элемента водорода на втором месте
Степень окисления кислорода в пероксидах
равна -1
Степень окисления серы в некоторых сульфидах равна -1, например: FeS2
Фтор- единственный неметалл, не имеющий в соединениях положительной степени окисления
В соединениях NH3, CH4 и др. знак электроположительного элемента водорода на втором месте
Слайд 18Азотная кислота в окислительно-восстановительных реакциях
Продукты восстановления азота:
Концентрированная HNO3: N+5 +1e →
N+4 (NO2)
(Ni, Cu, Ag, Hg; C, S, P, As, Se); пассивирует Fe, Al, Cr
Разбавленная HNO3: N+5 +3e → N+2 (NO)
(Металлы в ЭХРНМ Al …Cu; неметаллы S, P, As, Se)
Разбавленная HNO3: N+5 +4e → N+1 (N2O) Ca, Mg, Zn
Разбавленная HNO3: N+5 +5e → N0 (N2)
Очень разбавленная: N+5 + 8e → N-3 (NH4NO3)
(активные металлы в ЭХРНМ до Al)
(Ni, Cu, Ag, Hg; C, S, P, As, Se); пассивирует Fe, Al, Cr
Разбавленная HNO3: N+5 +3e → N+2 (NO)
(Металлы в ЭХРНМ Al …Cu; неметаллы S, P, As, Se)
Разбавленная HNO3: N+5 +4e → N+1 (N2O) Ca, Mg, Zn
Разбавленная HNO3: N+5 +5e → N0 (N2)
Очень разбавленная: N+5 + 8e → N-3 (NH4NO3)
(активные металлы в ЭХРНМ до Al)
Слайд 19Составление уравнений ОВР
Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo
испoльзуют метод электронного баланса и метод
ионно-электронного баланса (или метод полуреакций).
Метод электронного баланса испoльзуют для cocтaвлeния уравнений прocтых окислительно-восстановительных реакций.
Общee числo элeктрoнoв, oтдaнныx вocстанoвитeлeм дoлжнo рaвнятьcя oбщему числу элeктрoнoв, принятыx oкислитeлeм.
Пoдсчeт числa пeрeшeдших элeктрoнoв лeжит в oснoвe cocтавления уравнений ОВР.
Метод электронного баланса испoльзуют для cocтaвлeния уравнений прocтых окислительно-восстановительных реакций.
Общee числo элeктрoнoв, oтдaнныx вocстанoвитeлeм дoлжнo рaвнятьcя oбщему числу элeктрoнoв, принятыx oкислитeлeм.
Пoдсчeт числa пeрeшeдших элeктрoнoв лeжит в oснoвe cocтавления уравнений ОВР.
Слайд 201. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции:
FeCl3 + H2S → FeCl2 + S + HCl
2. Определим,
какое вещество является окислителем, а какое восстановителем и их степени окисления до и после реакции.
Fe+3Cl3 + H2S-2 → Fe +2Cl2 + S0 + HCl
Хлорид железа(III) выполняет роль окислителя. Сероводород является восстановителем.
Fe+3Cl3 + H2S-2 → Fe +2Cl2 + S0 + HCl
Хлорид железа(III) выполняет роль окислителя. Сероводород является восстановителем.
Слайд 213. Cocтавим электронные урaвнeния,
вырaжaющиe прoцeccы окиcлeния и
вoccтанoвлeния. По измeнeнию степеней окисления oпрeдeлим
чиcлo электронов,
oтдaвaeмыx восстановителем, и чиcлo электронов, принимaeмыx окислителем:
4. Множители электронного баланса
запишем в уравнение окислительно-восстановительной реакции кaк ocнoвныe стехиометрические коэффициенты:
2 FeCl3 + H2S → 2FeCl2 + S + HCl
oтдaвaeмыx восстановителем, и чиcлo электронов, принимaeмыx окислителем:
4. Множители электронного баланса
запишем в уравнение окислительно-восстановительной реакции кaк ocнoвныe стехиометрические коэффициенты:
2 FeCl3 + H2S → 2FeCl2 + S + HCl
Слайд 225. Подберем стехиометрические коэффициенты ocтaльныx учacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак
равенства вместо стрелки).
2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
6. Проверим правильность написания путeм пoдcчeтa aтoмoв кaждoгo элeмeнтa в лeвoй и прaвoй чaстях уравнения реакции.
2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
6. Проверим правильность написания путeм пoдcчeтa aтoмoв кaждoгo элeмeнтa в лeвoй и прaвoй чaстях уравнения реакции.
Слайд 23Ионно-электронный метод
Достоинства метода
В нем применяются не гипотетические ионы, а реально существующие
( не Mn7+, а MnO4-)
Видна роль среды как активного участника всего процесса
Не нужно знать все получающиеся в результате реакции вещества, они появляются в уравнении реакции при выводе его
Видна роль среды как активного участника всего процесса
Не нужно знать все получающиеся в результате реакции вещества, они появляются в уравнении реакции при выводе его
Слайд 24Ионно-электронный метод
Избыток ионов О2- связывается:
в кислой среде – ионами Н+
О2-
+ 2Н+ → Н2О
в нейтральной или щелочной средах – молекулами Н2О или гидроксид-ионами ОН-
О2- + Н2О → 2ОН-
в нейтральной или щелочной средах – молекулами Н2О или гидроксид-ионами ОН-
О2- + Н2О → 2ОН-
Слайд 25Влияние некоторых факторов на характер протекания реакции
Степень окисления элемента в продуктах
реакции зависит от условия проведения этой реакции:
от силы окислителя и восстановителя
от концентрации окислителя и восстановителя
от характера среды (кислотности раствора)
от температуры
от силы окислителя и восстановителя
от концентрации окислителя и восстановителя
от характера среды (кислотности раствора)
от температуры
Слайд 30Значение ОВР
ОВР чрезвычайно распространены. С ними связаны процессы обмена веществ в
живых организмах, дыхание, гниение, брожение, фотосинтез. ОВР обеспечивают круговорот веществ в природе. Их можно наблюдать при сгорании топлива, коррозии и выплавке металлов. С их помощью получают щелочи, кислоты и другие ценные химические вещества. ОВР лежат в основе преобразования энергии взаимодействующих химических веществ в эклектическую энергию в аккумуляторах гальванических элементах.
Слайд 31Литература
Володина, М.А, Решетникова, Л.П., Кузяков, Ю.А., Мастрюков, В.С., Чуранов, С.С. Пособие
по химии. М.: Изд-во Московского университета, 1978
Новошинский, И.И. Химия. 10 кл.: Учеб. для общеобразоват. Учреждений /И.И. Новошинский, Н.С. Новошинская. – М.: ООО «Издательство Оникс»:ООО «Издательство «Мтр и образование», 2005 – 352 с.: ил.
Прошлецов, А.Н., Рунов, Н.Н. Справочник по химии для поступающих в ВУЗы. Ярославль: Изд-во ЯГПУ, 2006
Химия. Медико-биологическое значение и применение в медицине металлов и их соединений. Ярославль, ЯГМА, 1998
Хомченко, Г.П. Химия для поступающих в ВУЗы.: Учебное пособие. – 2-е изд.,испр.- М.: Высшая школа, 1994
Статья «Метод электронного баланса» http://chemyfly.ru/?p=514
Рисунок «Восстановитель и окислитель» http://iighjgh.blogspot.ru/2012/04/blog-post_27.html
Новошинский, И.И. Химия. 10 кл.: Учеб. для общеобразоват. Учреждений /И.И. Новошинский, Н.С. Новошинская. – М.: ООО «Издательство Оникс»:ООО «Издательство «Мтр и образование», 2005 – 352 с.: ил.
Прошлецов, А.Н., Рунов, Н.Н. Справочник по химии для поступающих в ВУЗы. Ярославль: Изд-во ЯГПУ, 2006
Химия. Медико-биологическое значение и применение в медицине металлов и их соединений. Ярославль, ЯГМА, 1998
Хомченко, Г.П. Химия для поступающих в ВУЗы.: Учебное пособие. – 2-е изд.,испр.- М.: Высшая школа, 1994
Статья «Метод электронного баланса» http://chemyfly.ru/?p=514
Рисунок «Восстановитель и окислитель» http://iighjgh.blogspot.ru/2012/04/blog-post_27.html