- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Непредельные углеводороды 10 класс
Содержание
- 1. Презентация Непредельные углеводороды 10 класс
- 2. Непредельные углеводороды.Непредельные, или ненасыщенные, УВ содержат кратные углерод- углеродные связи(>C=C
- 3. Непредельные углеводороды:Алкены.Алкадиены.Алкины.
- 4. Алкены ( олефины, этиленовые УВ) CnH2n,
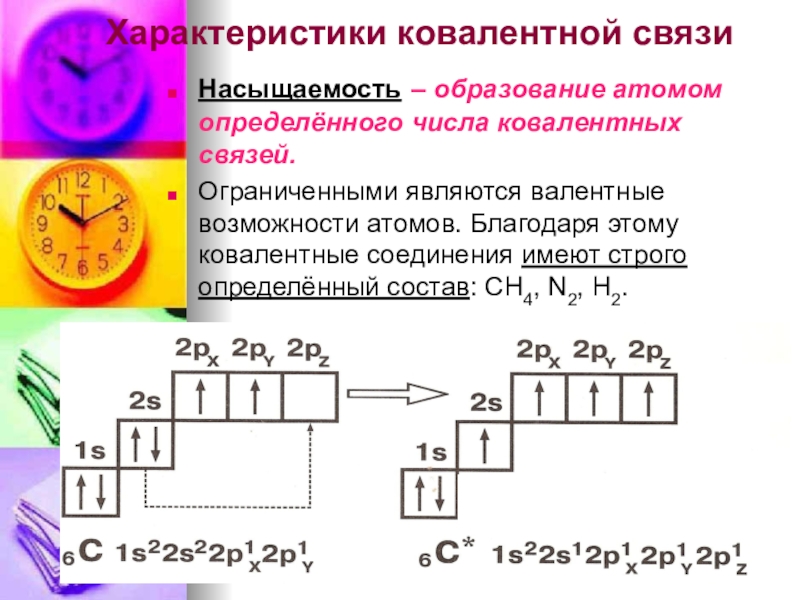
- 5. Характеристики ковалентной связиНасыщаемость – образование атомом определённого
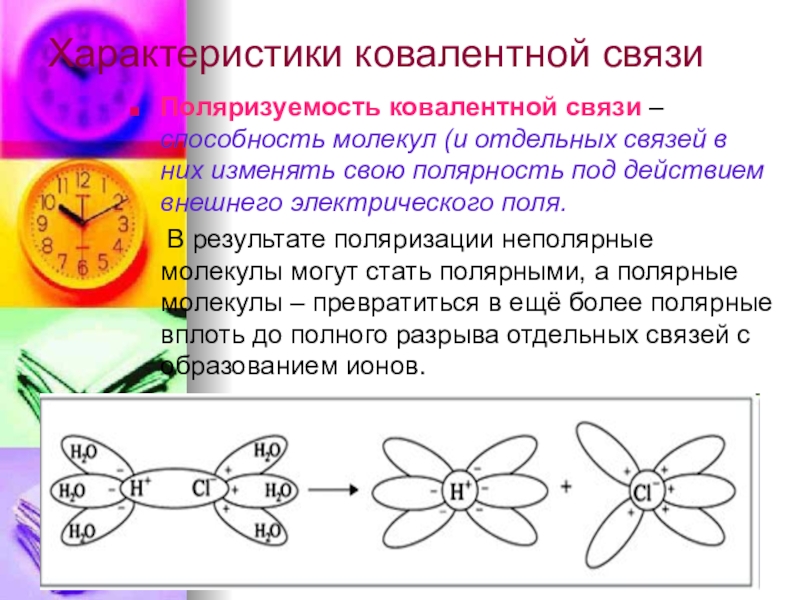
- 6. Характеристики ковалентной связиПоляризуемость ковалентной связи – способность
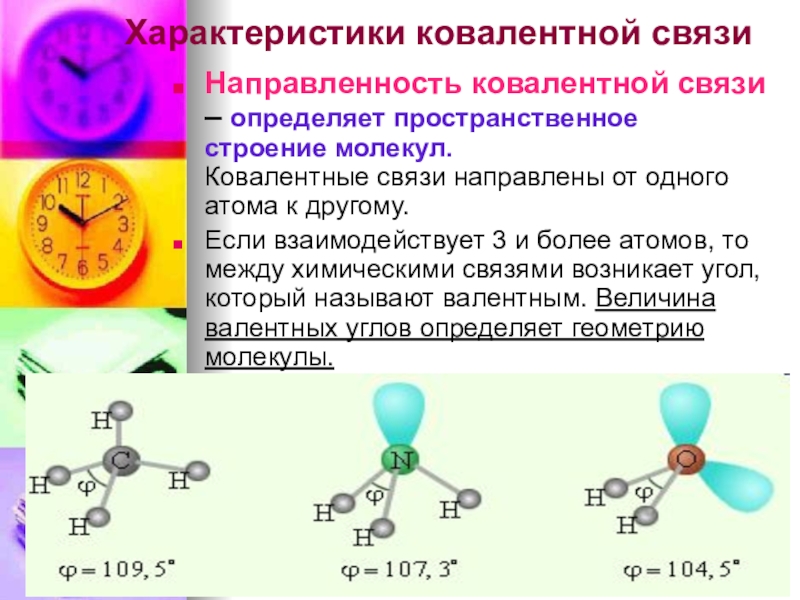
- 7. Характеристики ковалентной связиНаправленность ковалентной связи – определяет
- 8. При выяснении пространственного строения молекулы учитывают:1. Форму
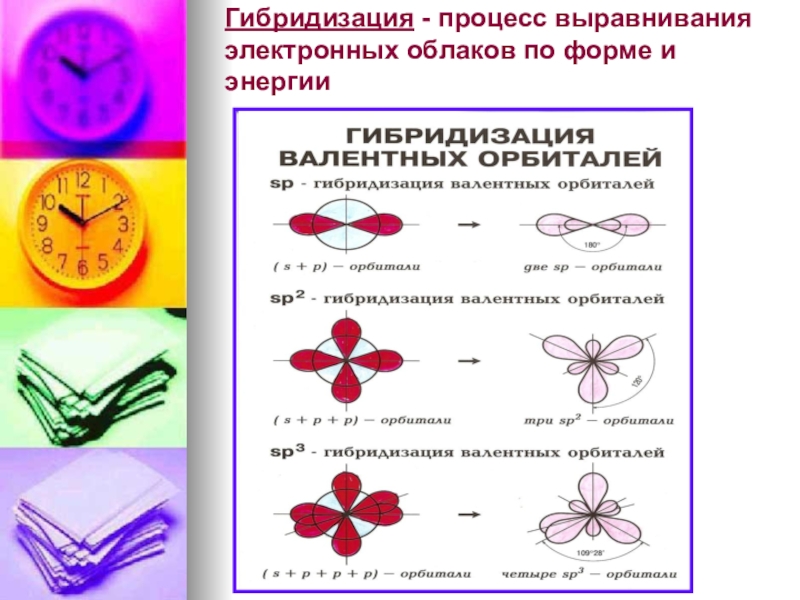
- 9. Гибридизация - процесс выравнивания электронных облаков по форме и энергии
- 10. Определение типа гибридизации на примере молекулы метана.1.Написать
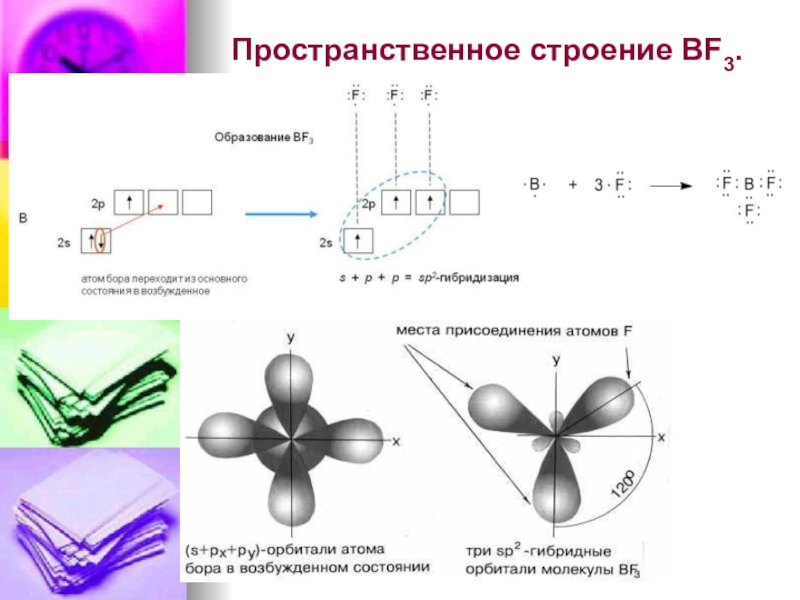
- 11. Пространственное строение BF3.
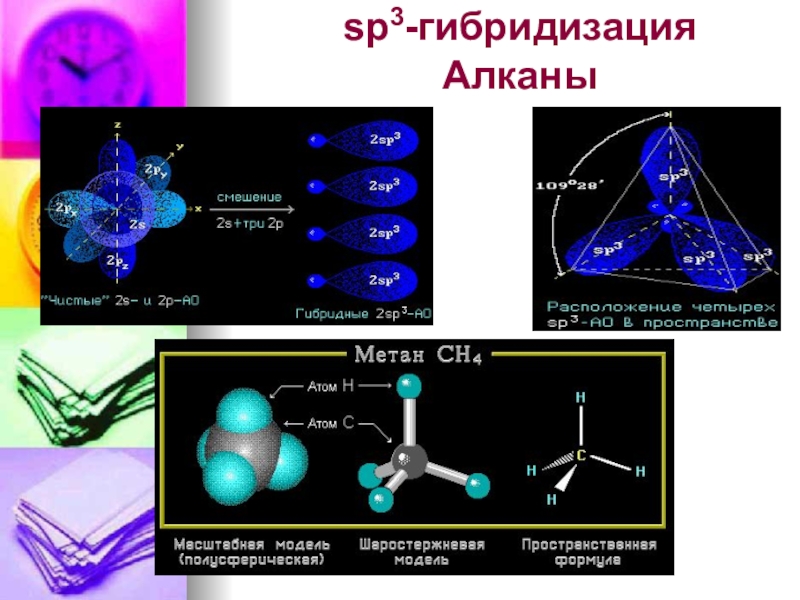
- 12. sp3-гибридизация Алканы
- 13. Строение молекул алкеновАтомы углерода при двойной связи
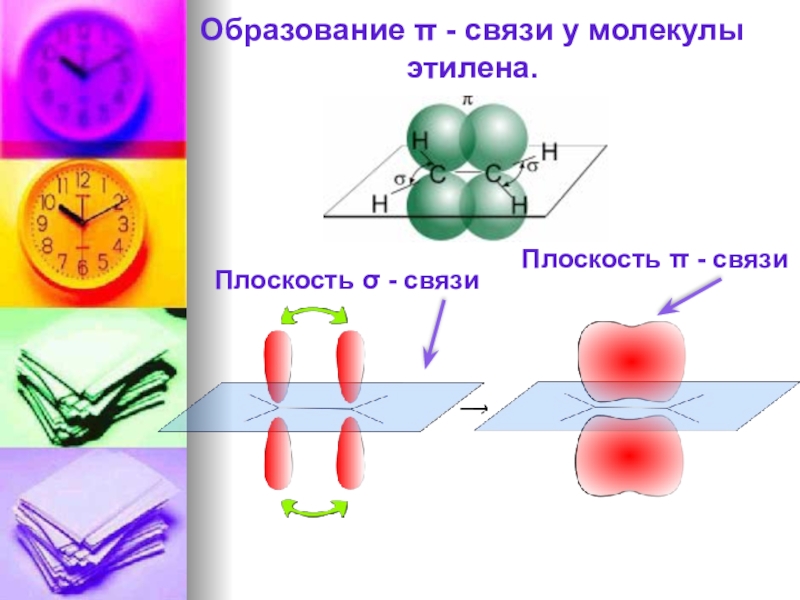
- 14. Образование π - связи у молекулы этилена.Плоскость σ - связиПлоскость π - связи
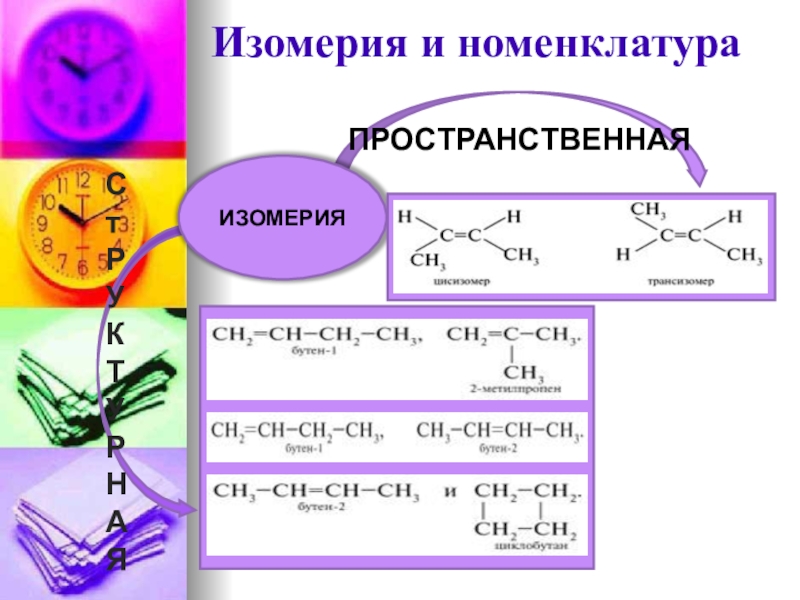
- 15. Изомерия и номенклатураСтРУКТУРНАЯПРОСТРАНСТВЕННАЯИЗОМЕРИЯ
- 16. НоменклатураCnH2nан -- ен или илен 1. В качестве
- 17. Номенклатура алкенов
- 18. Физические свойстваС2-С4 газы, С5-С16 жидкости, С>19 твердые, р
- 19. Химические свойства
- 20. Химические свойстваАктивны из-за наличия непрочной π- связиХарактерны
- 21. Присоединение галогенводородов к несимметричным алкенам происходит по
- 22. Правило В.В. МарковниковаВодород галогенводорода присоединяется к более
- 23. Гидратация (+Н2О) Происходит по правилу Марковникова
- 24. Слайд 24
- 25. Реакции окисленияГорение: а) полное ( избыток О2)
- 26. Реакции полимеризации.Процесс полимеризации алкенов открыт А.М.Бутлеровым.Полимеризацией называется
- 27. Получение алкенов. 1)Крекинг нефтепродуктов С16Н34
- 28. Дегидратация спиртов
- 29. Правило А.М.ЗайцеваДегалогенированиеОтщепление(элиминирование) атома водорода в реакциях происходит от наименее гидрогенизированного атома углерода:
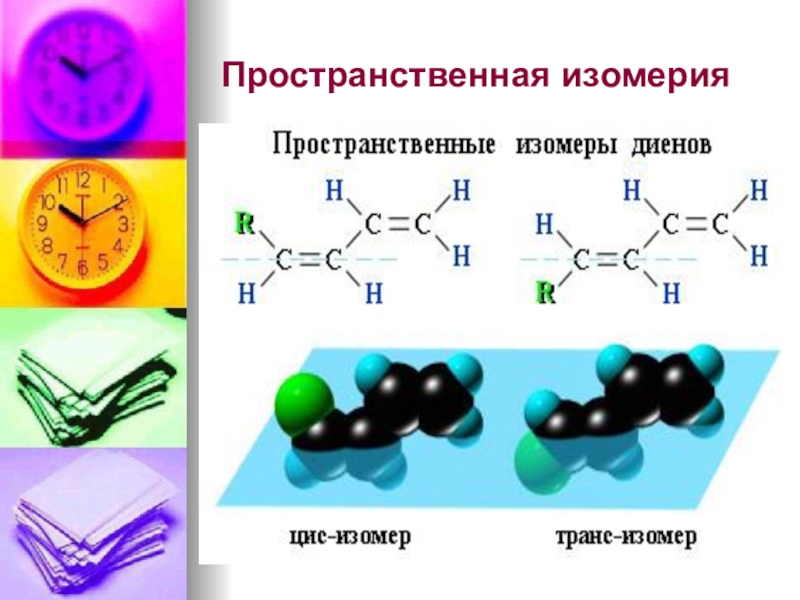
- 30. Диеновые углеводороды (алкадиены)Диеновые УВ (алкадиены) – это
- 31. Классификация Диены с кумулированными
- 32. Изомерия и номенклатураСтруктурная изомерия
- 33. Слайд 33
- 34. Пространственная изомерия
- 35. Химические свойства 1) Реакции присоединения:
- 36. б) гидрогалогенирование СН2=СН-СН=СН2 +НCl
- 37. Получение алкадиенов1)Каталитическое дегидрирование а) алканов
- 38. Алкины (ацетиленовые УВ)Алкины – это углеводороды, в
- 39. ИзомерияУглеродного скелета с «С» >5
- 40. Номенклатура АН → ИНВыбор
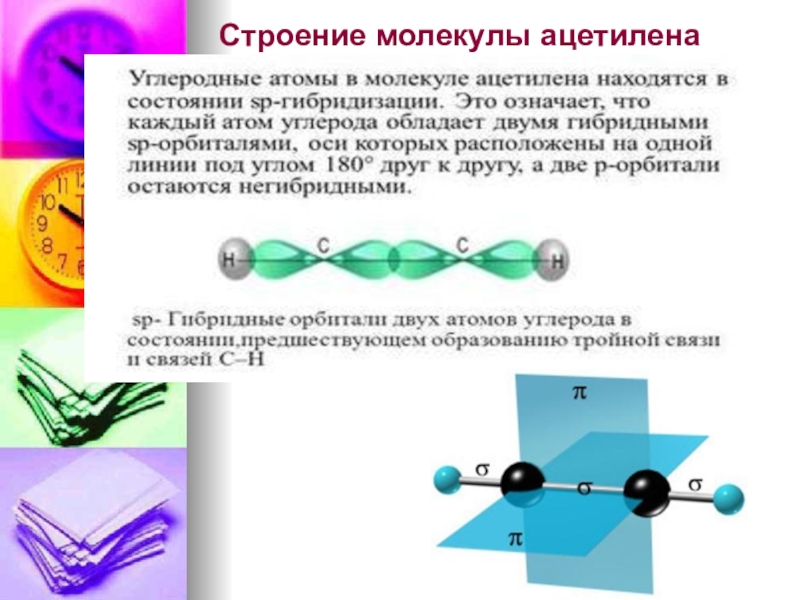
- 41. Строение молекулы ацетилена
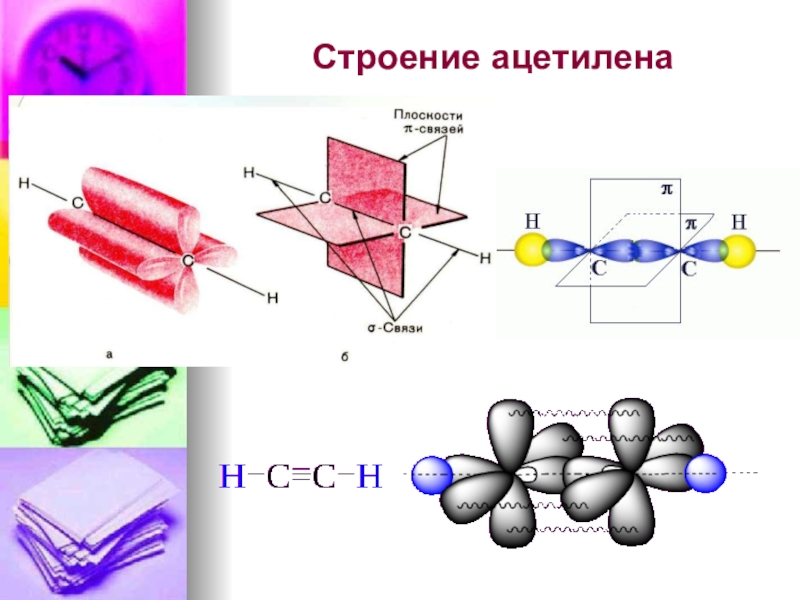
- 42. Строение ацетилена
- 43. Физические свойстваС2-С4-газы, С5-С16-жидкости,С>17 твердые вещества, растворимость в
- 44. Химические свойства алкинов.Алкины во многих реакциях обладают
- 45. I.Реакции присоединения: 1.Присоединение водорода (гидрирование) На I
- 46. 3.Присоединение галогеноводородов (гидрогалогенирование) На I ступени образуются
- 47. Реакция с KMnO4 является качественной реакцией на алкины. Раствор KMnO4 обесцвечивается.
- 48. Кислотные свойства ацетиленовых
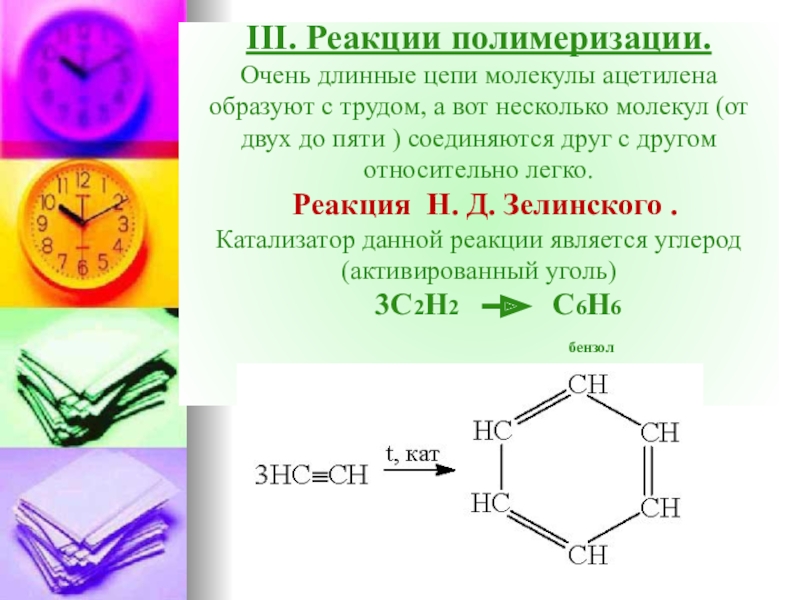
- 49. III. Реакции полимеризации. Очень длинные цепи
- 50. Получение алкиновПиролиз метана (метановый способ) 2СН4 →С2Н2
- 51. Применение ацетилена
Слайд 2Непредельные углеводороды.
Непредельные, или ненасыщенные, УВ содержат кратные углерод- углеродные связи
(>C=C
Слайд 4Алкены ( олефины, этиленовые УВ) CnH2n, n>2
Алкены – это УВ,
Слайд 5Характеристики ковалентной связи
Насыщаемость – образование атомом определённого числа ковалентных связей.
Ограниченными являются
Слайд 6Характеристики ковалентной связи
Поляризуемость ковалентной связи – способность молекул (и отдельных связей
В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы – превратиться в ещё более полярные вплоть до полного разрыва отдельных связей с образованием ионов.
Слайд 7Характеристики ковалентной связи
Направленность ковалентной связи – определяет пространственное строение молекул.
Ковалентные
Если взаимодействует 3 и более атомов, то между химическими связями возникает угол, который называют валентным. Величина валентных углов определяет геометрию молекулы.
Слайд 8При выяснении пространственного строения молекулы учитывают:
1. Форму орбиталей, принимающих участие в
2.Электростатическое взаимодействие электронных пар, которое приводит к отталкиванию электронных орбиталей, вследствие чего они занимают в пространстве наиболее удалённые друг от друга места.
Если в образовании связей принимают участие одновременно электроны s и p подуровней и если их энергии незначительно отличаются, то образуются гибридные облака.
Слайд 10Определение типа гибридизации на примере молекулы метана.
1.Написать полную структурную формулу вещества.
2.Подсчитать
3.Подсчитать число электронов, предоставляемые соседними атомами.
4.Подсчитать число электронов, приходящихся на пи-связь.
5.Полученный результат разделить на два.
6.Если 4 –
расположение тетраэдр
Если 3 -
расположение плоское тригональное
Если 2-
расположение линейное
0
--------------
2
4
+
4
-
0
Слайд 13Строение молекул алкенов
Атомы углерода при двойной связи находятся в sp2-гибридизации и
Длина двойной связи – 0,134 нм.
Все валентные углы НСН близки к 120º.
Слайд 16Номенклатура
CnH2n
ан -- ен или илен
1. В качестве главной выбирают цепь, включающую
2. Нумерация с того конца, к которому ближе двойная связь
3. Положение = связи указывают в конце, номером атома углерода, после которого она находится.
4. В начале названия – положение боковых цепей.
Слайд 19Химические свойства
\ σ
C==C + A—B → C — C
/ π \ / | | \
А В
Алкены вступают в реакции электрофильного присоединения.
При химической реакции π- связь легко разрывается и по линии разрыва происходит присоединение атомов или групп атомов.
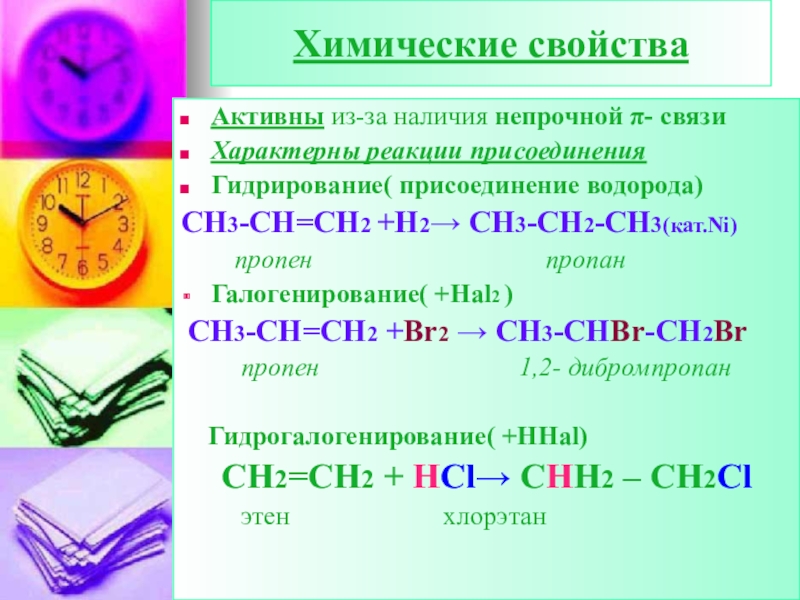
Слайд 20Химические свойства
Активны из-за наличия непрочной π- связи
Характерны реакции присоединения
Гидрирование( присоединение
СН3-СН=СН2 +Н2→ CH3-CH2-CH3(кат.Ni)
пропен пропан
Галогенирование( +Hal2 )
СН3-СН=СН2 +Br2 → CH3-CHBr-CH2Br
пропен 1,2- дибромпропан
Гидрогалогенирование( +HHal)
CH2=CH2 + HCl→ CHH2 – CH2Cl
этен хлорэтан
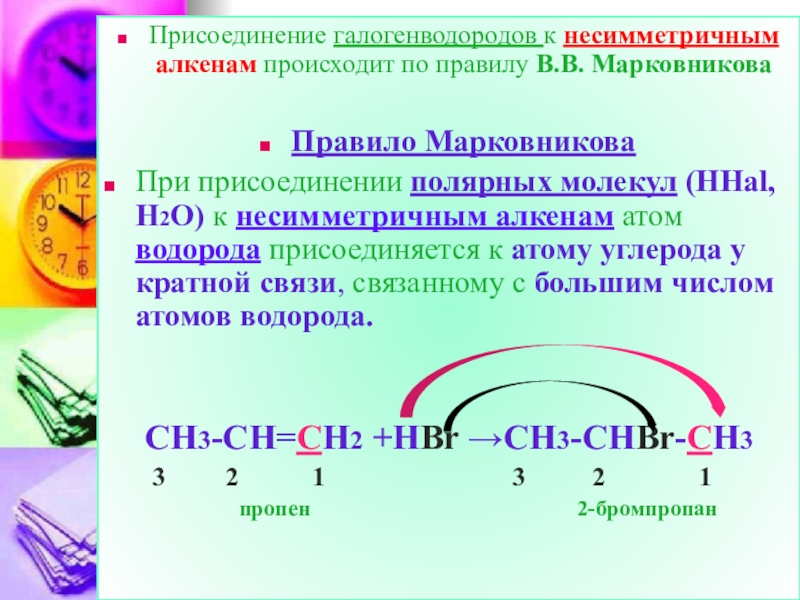
Слайд 21Присоединение галогенводородов к несимметричным алкенам происходит по правилу В.В. Марковникова
Правило
При присоединении полярных молекул (НHal, H2O) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода.
CH3-CH=CH2 +HBr →CH3-CHBr-CH3
3 2 1 3 2 1
пропен 2-бромпропан
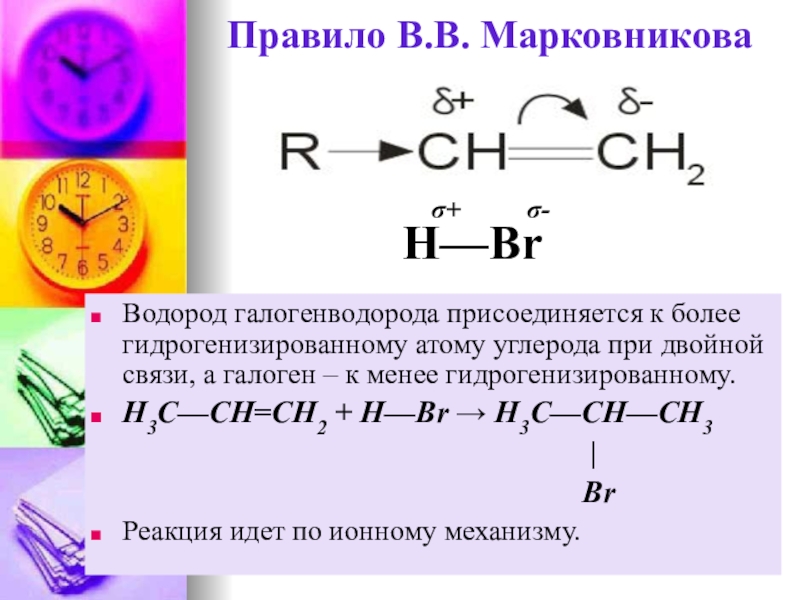
Слайд 22Правило В.В. Марковникова
Водород галогенводорода присоединяется к более гидрогенизированному атому углерода при
H3C—CH=CH2 + H—Br → H3C—CH—CH3
|
Br
Реакция идет по ионному механизму.
H—Br
σ+ σ-
Слайд 23Гидратация (+Н2О)
Происходит по правилу Марковникова
СН2=СН2
этилен этанол
(в кислой среде при нагревании)
1 2 3 4 1 2 3 4
СН2=СН-СН2-СН3+НОH→СН2-СН-СН2-СН3
Н ОН
бутен-1 бутанол-2
Слайд 25Реакции окисления
Горение:
а) полное ( избыток О2)
С2Н4
б) неполное ( недостаток кислорода)
C2H4 +2O2→2CO + 2H2O
C2H4 + O2→2C +2H2O
в)под действием окислителей типа KMnO4, K2Cr2O7
CH2=CH2 + (O) + H2O CH2 – CH2 этилен l l
OH OH
этиленгликоль
Слайд 26Реакции полимеризации.
Процесс полимеризации алкенов открыт А.М.Бутлеровым.
Полимеризацией называется процесс соединения одинаковых молекул
Условия t, P, kat.
n CH2=CH2 → (-CH2-CH2-) n
мономер (этилен) полимер ( полиэтилен)
Слайд 27Получение алкенов.
1)Крекинг нефтепродуктов
С16Н34 --- С8Н18 + С8Н16(
2) Дегидрирование алканов ( де + гидр + ирование= удалять +водород + действие)
CnH2n+2 → CnH2n + H2
( t, kat.) Отщепление водорода.
3) Гидрирование алкинов
CnH2n-2+ H2 → CnH2n ( kat. Ni, Pt )
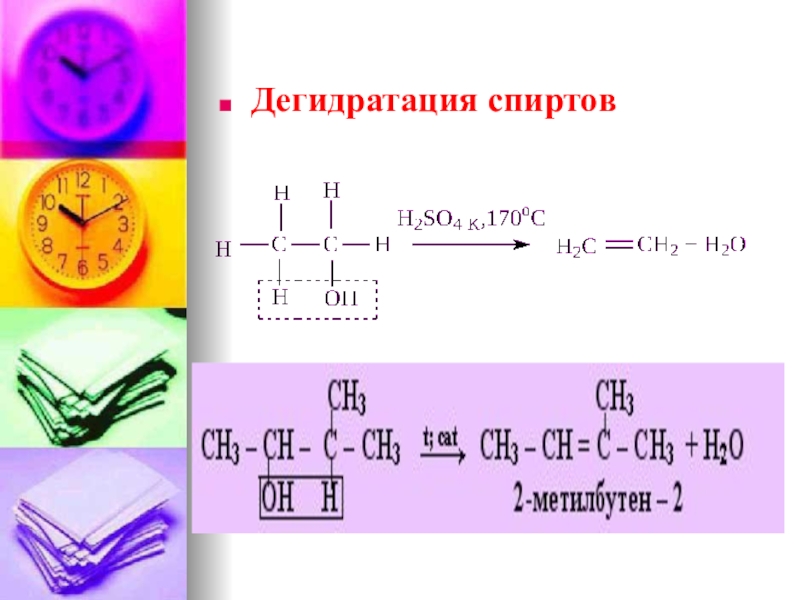
4)Дегидратация спиртов (t, kat:H2SO4, H3PO4, Al2O3,
ZnCl2)
CH3-CH2OH →CH2=CH2 +H2O
(t-170 , Н2SO4 конц.)
Слайд 29Правило А.М.Зайцева
Дегалогенирование
Отщепление(элиминирование) атома водорода в реакциях происходит от наименее гидрогенизированного атома
Слайд 30Диеновые углеводороды (алкадиены)
Диеновые УВ (алкадиены) – это УВ, в молекулах которых
Общая формула:
CnH2n-2 , где n>3
Назад
Слайд 31Классификация
Диены с кумулированными связями
Две
СН2=С=СН2 пропадиен (аллен)
Диены с сопряженными связями
Двойные связи разделены одной одинарной связью
СН2=СН-СН=СН2 бутадиен-1,3
Диены с изолированными связями
Двойные связи разделены двумя или более одинарными связями
СН2=СН-СН2-СН=СН2 пентадиен-1,4
Назад
Слайд 35Химические свойства
1) Реакции присоединения:
а) галогенирование
1 2 3 4 1 2 3 4
СН2=СН-СН=СН2+Br2(H2O)→CH2Br-CH=CH-CH2Br+
бутадиен-1,3 1,4-дибромбутен-2
2-ая стадия 1 2 3 4
+ Br2(H20)→CH2Br-CHBr-CHBr-CH2Br
1,2,3,4-тетрабромбутан
Бромная вода обесцвечивается.
Присоединение идет в положение 1 и 4, а между атомами 2 и 3 образуется новая двойная связь.
Слайд 36 б) гидрогалогенирование
СН2=СН-СН=СН2 +НCl →CH3-CH=CH-CH2Cl
в)гидрирование ( +Н2)
СН2=СН-СН=СН2 +Н2 →СН3-СН=СН-СН3
бутадиен -1,3 бутен-2
2) Полимеризация
СН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n
полибутадиен (бутадиеновый каучук)
Химические свойства
Слайд 37Получение алкадиенов
1)Каталитическое дегидрирование
а) алканов
СН3-СН2-СН2 –СН3 →СН2=СН-СН=СН2 +2Н2
б)алкенов
СН2=СН-СН2-СН3-→ СН2=СН-СН=СН2 + Н2
Слайд 38Алкины (ацетиленовые УВ)
Алкины – это углеводороды, в молекулах которых два атома
Общая формула: CnH2n-2, n>2
Слайд 39Изомерия
Углеродного скелета с «С» >5
CНΞС-СН2-СН2-СН3
бутин-1 СН3
3-метилбутин-1
Положения тройной (кратной) связи
СНΞС-СН2-СН3 СН3-СΞС-СН3
бутин-1 бутин-2
Пространственной изомерии нет
Слайд 40Номенклатура
АН → ИН
Выбор главной цепи и начало
Правила составления названий алкинов по международной номенклатуре аналогичны правилам для алкенов.
Назад
Слайд 43Физические свойства
С2-С4-газы,
С5-С16-жидкости,
С>17 твердые вещества, растворимость в воде небольшая, но больше
Ткип( Н) > Т кип (разв), с увеличением Мr Tкип увеличивается.
Назад
Слайд 44Химические свойства алкинов.
Алкины во многих реакциях обладают большей реакционной способностью,чем алкены.
Слайд 45I.Реакции присоединения: 1.Присоединение водорода (гидрирование) На I ступени образуются алкены, на II cтупени- алканы:
Слайд 463.Присоединение галогеноводородов (гидрогалогенирование) На I ступени образуются моногалогеналкены, на II –дигалогеналканы: С2Н2 + НCl
Слайд 48 Кислотные свойства ацетиленовых углеводородов. Атом водорода в
Слайд 49 III. Реакции полимеризации. Очень длинные цепи молекулы ацетилена образуют с трудом, а
Слайд 50Получение алкинов
Пиролиз метана (метановый способ)
2СН4 →С2Н2 + 3Н2 (электрический разряд)
Дегидрогалогенирование дигалогеналканов
СН2Br-CH2Br +KOH (спирт. р-р) →CH2=CHBr +KBr +H2O
CH2=CHBr + KOH (спирт.р-р) →С2Н2 +KBr + H2O
Карбидный способ
CaC2 + 2H2O → Ca(OH)2 +C2H2
(ацетилен)