- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад НА ТЕМУ ФОСФОР
Содержание
- 1. ПРЕЗЕНТАЦИЯ НА ТЕМУ ФОСФОР
- 2. Цели урока: обеспечить усвоение учащимися знаний о
- 3. Прав ли был Артур Конан-Дойл?
- 4. Открытие фосфораГамбургский алхимикХеннинг Бранд1669 год «Фосфор» - от греческого «светоносный»
- 5. периодФосфор как химический элементгруппавалентных электроновстепени окислениявысший оксид водородное соединение
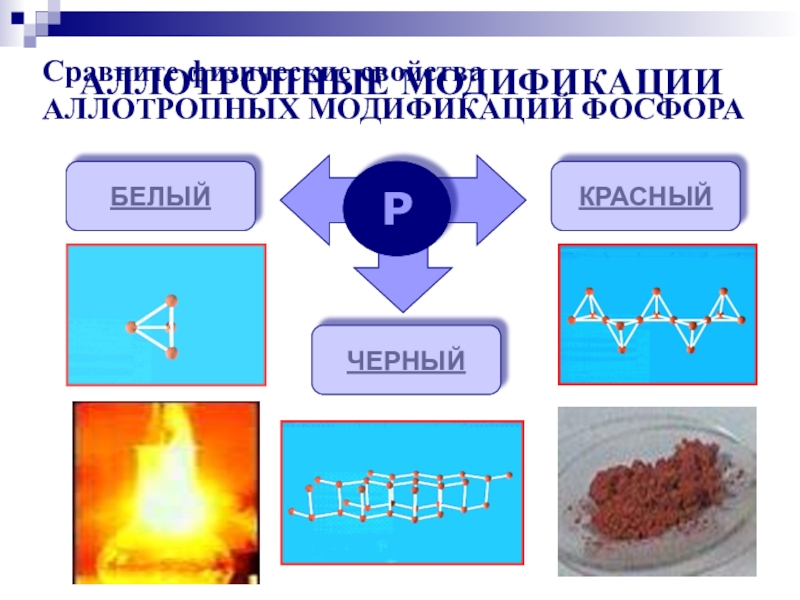
- 6. АЛЛОТРОПНЫЕ МОДИФИКАЦИИРБЕЛЫЙКРАСНЫЙЧЕРНЫЙСравните физические свойстваАЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 7. Молекулы P4 имеют форму тетраэдра.
- 8. Существует несколько форм красного фосфора
- 9. Черный фосфор имеет слоистую атомную
- 10. C неметаллами:
- 11. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
- 12. РОРГАНИЗМЫМИНЕРАЛЫФОСФОЛИПИДЫ,ФЕРМЕНТЫ,ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫВ ЗУБАХ И КОСТЯХФОСФОРИТБИРЮЗА АПАТИТНАХОЖДЕНИЕ В ПРИРОДЕАПАТИТ
- 13. Физиологическое действие белого фосфораРезультат применения чрезмерного
- 14. Получение фосфоранагреванием смеси фосфорита, угля и песка
- 15. ПРИМЕНЕНИЕ ФОСФОРАРудобренияядохимикатыПроизводство спичекСоздание дымовых завесполупроводникиПроизводство красокЗащита от коррозииумягчение водымоющие средства
- 16. Войска СШАиспользовали фосфорныеБомбыв Ираке, 2004 г.
- 17. ДОМАШНЕЕ ЗАДАНИЕ §21. упр2,
Цели урока: обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе; аллотропных видоизменениях фосфора; повторить зависимость свойств вещества от его состава и строения; развивать умение сравнивать; способствовать формированию материалистического мировоззрения, нравственному воспитанию
Слайд 2Цели урока:
обеспечить усвоение учащимися знаний о фосфоре как о химическом
элементе и простом веществе;
аллотропных видоизменениях фосфора;
повторить зависимость свойств вещества от его состава и строения;
развивать умение сравнивать;
способствовать формированию материалистического мировоззрения, нравственному воспитанию школьников.
аллотропных видоизменениях фосфора;
повторить зависимость свойств вещества от его состава и строения;
развивать умение сравнивать;
способствовать формированию материалистического мировоззрения, нравственному воспитанию школьников.
Слайд 4Открытие фосфора
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» -
от греческого «светоносный»
Слайд 5период
Фосфор как химический элемент
группа
валентных электронов
степени окисления
высший оксид
водородное соединение
Слайд 6
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Р
БЕЛЫЙ
КРАСНЫЙ
ЧЕРНЫЙ
Сравните физические свойства
АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
Слайд 7
Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС,
мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.
БЕЛЫЙ ФОСФОР
Слайд 8
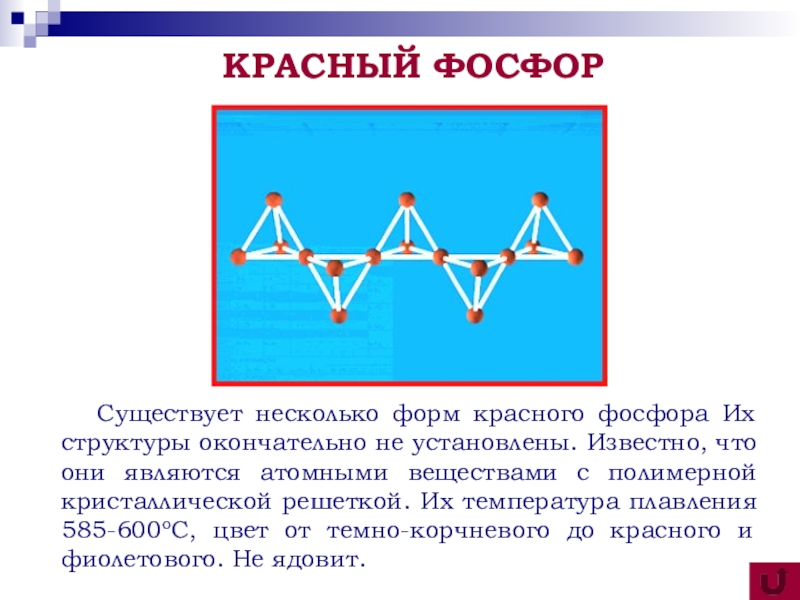
Существует несколько форм красного фосфора Их структуры окончательно не
установлены. Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их температура плавления 585-600оС, цвет от темно-корчневого до красного и фиолетового. Не ядовит.
КРАСНЫЙ ФОСФОР
Слайд 9
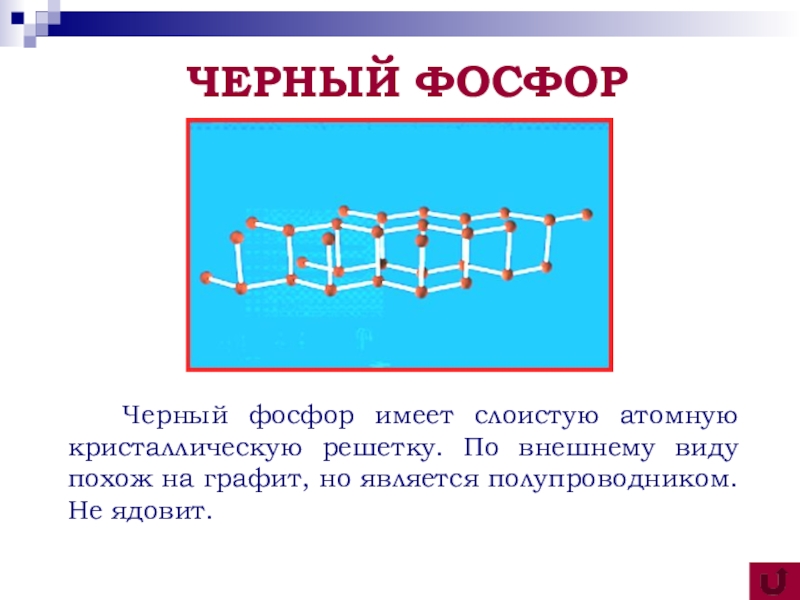
Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему
виду похож на графит, но является полупроводником. Не ядовит.
ЧЕРНЫЙ ФОСФОР
Слайд 12
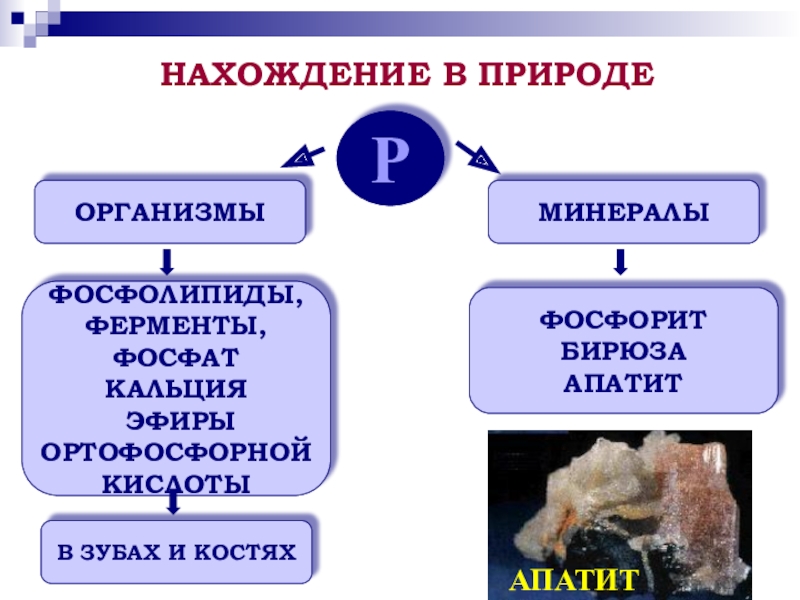
Р
ОРГАНИЗМЫ
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
НАХОЖДЕНИЕ В ПРИРОДЕ
АПАТИТ
Слайд 13Физиологическое действие
белого фосфора
Результат применения чрезмерного количества фосфора
Появление лягушек с
уродствами -результат применения фосфорных удобрений, которые смываются в реки и пруды,
Фосфорный некроз – поражение челюстей
Слайд 14Получение фосфора
нагреванием смеси фосфорита, угля и
песка в электропечи:
Ca3(PO4)2 + C
+ SiO2 → P4 + CaSiO3 + CO
Слайд 15ПРИМЕНЕНИЕ ФОСФОРА
Р
удобрения
ядохимикаты
Производство
спичек
Создание
дымовых завес
полупроводники
Производство
красок
Защита от
коррозии
умягчение воды
моющие средства
Слайд 17ДОМАШНЕЕ ЗАДАНИЕ
§21. упр2, задача 4
Индивидуальные задания.
Подготовить сообщения:
1)об истории спичек;
2) о биологической роли фосфора и его соединений.