1
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад музыкально-литературного мероприятия Парад химических элементов
Содержание
- 1. Презентация музыкально-литературного мероприятия Парад химических элементов
- 2. Периодическая система химических элементов Д.И.Менделеева2
- 3. Другого ничего в природе нетни здесь, ни
- 4. Химия – это наука о веществах и
- 5. Периодическая система Дмитрия Ивановича Менделеева5
- 6. 6
- 7. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Периодическая система химических
- 8. Первым вариантом системы элементов, предложенным Д. И.
- 9. 9
- 10. Слайд 10
- 11. 11
- 12. 12
- 13. 13
- 14. Периодическая таблица химических элементов – графическое изображение
- 15. Периоды1-ый, 2-ой и 3-ий периоды называют малыми.4-ый,
- 16. В периодах
- 17. водород 17
- 18. Визитка химического элементаПорядковый номер: 1Период: 1Группа: 1, 7Подгруппа: главнаяЭлектронная формула атома: 1ē18
- 19. Водород Но гораздо больше на Земле связанного
- 20. К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы
- 21. Распространение элемента водорода в природе 21
- 22. Физические свойства простого вещества 22
- 23. Получение водорода 1) В лаборатории:
- 24. Химические свойства1) + неметалл:2Н2 + О2 =
- 25. Особенности обращенияВодород при смеси с воздухомВодород при
- 26. Применение водорода26
- 27. Применение водородаАтомарный водород используется для атомно-водородной сварки.Химическая
- 28. Гелий Ге́лий возглавляет группу инертных газов в
- 29. Символ элемента, выполненный из газоразрядных трубок, наполненных
- 30. Гелий впервые был идентифицирован как химический элемент
- 31. Ге́лий — второй элементвторой элемент периодической системы химических элементоввторой элемент периодической системы химических
- 32. 11
- 33. 33
- 34. 24Литий 3Li Lithium(He)
- 35. Литий
- 36. 36
- 37. 27 Бериллий BerylliuАтомный номер
- 38. Бериллий присутствует в тканях многих растений и
- 39. В медицине как антисептические средства находят применение
- 40. Электронное строение атома бора+521s22s22р11sE32s2р40
- 41. 41
- 42. Углерод — принадлежит к числу элементов, в значительной
- 43. Углерод Атомный номер
- 44. Аллотропные модификацииГрафит – устойчивая при нормальных условиях
- 45. Аллотропные модификации Алмаз – бесцветное, прозрачное, сильно преломляющее
- 46. Немного из историиУглерод в виде древесного угля применялся в
- 47. Химические свойства углерода При обычных
- 48. Алмаз и графит сгорают в чистом кислороде
- 49. 49
- 50. Характеристика азота как химического элемента и простого вещества.50
- 51. Азот – химический элемент.
- 52. Азот – простое вещество.Физические свойства:Газ;Без цвета;Без запаха;Плохо растворяется в воде;При -1960С становится жидкостьюХимические свойства:52
- 53. Без белка нет жизни, а без азота нет белка!53
- 54. Круговорот азота в природе.54
- 55. KNO3-калийная селитра NH4NO3- аммиачная селитра CO(NH2) - карбамид55
- 56. 56Без этого элемента вы не проживете и десяти минут.
- 57. 57Оно нам хорошо известно:Газообразный кислород,Которым дышат, если
- 58. КИСЛОРОД58
- 59. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД»Химический знак ОПоложение
- 60. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДАКислород – газ, без цвета
- 61. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА62
- 62. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА63В промышленности кислород получают из
- 63. 64г) разложение хлората калия2KClO3 =
- 64. ПРИМЕНЕНИЕ КИСЛОРОДА ЧЕЛОВЕКОМ66
- 65. Фтор Fluorine 9F
- 66. Слайд 66
- 67. Слайд 67
- 68. 56Неон (лат. Neonum), Ne, химический элемент VIII группы
- 69. Эмиссионный спектр неона (слева
- 70. Жидкий неон используют в качестве охладителя в
- 71. Электронное строение атома неона+1021s22s22р61sE82s2р
- 72. Легкие металлы.металлы 3-5 период главных подгрупп: алюминий
- 73. Слайд 73
- 74. Натрий 11Na Натрий Sodium(Ne)3s1
- 75. Модель атома натрия
- 76. Слайд 76
- 77. ОБОБЩИМ ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ
- 78. Качественная реакция на катионы щелочных металлов -
- 79. Электронное строение атома натрия
- 80. СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВВсе щелочные металлы имеют
- 81. ХИМИЧЕСКИЕ СВОЙСТВАРеакции с неметаллами (образуются бинарные соединения):4Li
- 82. Слайд 82
- 83. Физические свойстваВсе металлы этой подгруппы имеют серебристо-белый
- 84. 61Металл НатрийФизические свойства. Натрий- мягкий серебристо-белый легкоплавкий
- 85. Слайд 85
- 86. Применение щелочных металлов
- 87. 3 января 1959 года В
- 88. Магний 12Mg MagnesiumАтомный номер
- 89. 63
- 90. Слайд 90
- 91. Алюминий — элемент главной подгруппы третьей группы третьего периода периодической системы
- 92. Простое вещество алюминий — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью,
- 93. Физические свойстваМикроструктура алюминия на протравленной поверхности слитка,
- 94. Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора около 55×37 мм
- 95. Нахождение в природеПриродный алюминий состоит практически полностью
- 96. Химические свойства Алюминия. Внешняя электронная оболочка атома Алюминия
- 97. Алюминий и его соединения в ракетной техникеАлюминий
- 98. Кремний 4Si SiliconАтомный номер
- 99. Физические свойства Кремния. Кремний образует темно-серые с металлическим
- 100. Открытие фосфораГамбургский алхимикХеннинг Бранд1669 год «Фосфор» - от греческого «светоносный»68
- 101. периодФосфор как химический элемент3группаVвалентных электроновстепени окисления-3; +3; +5высший оксидP2O5водородное соединениеРН3
- 102. АЛЛОТРОПНЫЕ МОДИФИКАЦИИРБЕЛЫЙКРАСНЫЙЧЕРНЫЙСравните физические свойстваАЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 103. Черный фосфор имеет слоистую атомную
- 104. Существует несколько форм красного фосфора
- 105. Молекулы P4 имеют форму тетраэдра.
- 106. ХИМИЧЕСКИЕ СВОЙСТВА С металлами:
- 107. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
- 108. РОРГАНИЗМЫМИНЕРАЛЫФОСФОЛИПИДЫ,ФЕРМЕНТЫ,ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫВ ЗУБАХ И КОСТЯХФОСФОРИТБИРЮЗА АПАТИТНАХОЖДЕНИЕ В ПРИРОДЕАПАТИТ
- 109. Физиологическое действие белого фосфораРезультат применения чрезмерного
- 110. Получение фосфоранагреванием смеси фосфорита, угля и песка
- 111. ПРИМЕНЕНИЕ ФОСФОРАРудобренияядохимикатыПроизводство спичекСоздание дымовых завесполупроводникиПроизводство красокЗащита от коррозииумягчение водымоющие средства79
- 112. СЕРА S 1s22s22p63s23p4 2ē8ē6ē80Сера — достаточно активный
- 113. Слайд 113
- 114. Физические свойстваТвёрдое кристаллическое вещество желтого цвета, без
- 115. Аллотропия серы
- 116. Физические свойства
- 117. Строение атома серы
- 118. Химические свойства Окислительные свойства серы (S0 +
- 119. Химические свойства Восстановительные свойства сера проявляет в
- 120. Реакции диспропорционирования:3S0 + 6KOH → K2S+4O3 +
- 121. Сера является на 16-м месте по распространённости
- 122. Пирит - огненный камень (соединение серы в природе)
- 123. СЕРА - ЖИЗНЕННО ВАЖНЫЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТСера входит
- 124. Применение серыСеру применяют для производства :Серной кислотыВулканизации каучука
- 125. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца.
- 126. Хлор (Cl) - элемент VII A группы
- 127. Строение атомаЗаряд ядра +17, электронная конфигурация внешней
- 128. Положение в таблицеХлор - химический элемент седьмой
- 129. История открытияПервым из галогенов был открыт хлор
- 130. Распространение в природеХлор – активный элемент В природе
- 131. Слайд 131
- 132. ВозбужденияВ невозбужденном состоянии галогены имеют валентность, равную
- 133. 99
- 134. Молекула хлора двухатомна. Связь одинарна и образуется
- 135. Физические свойстваХлор – ядовитый газ желто-зеленого цвета с
- 136. Физические свойстваС возрастанием молекулярной массы температуры плавления
- 137. ПолучениеОсновной промышленный способ получения хлора – электролиз
- 138. Применения хлораВ производстве пластикатов, синтетического каучука и др.Для
- 139. Хлор , находит применение в сельском хозяйстве
- 140. . Хлор - один из химических элементов,
- 141. Арго́н —Третий по распространённости элемент в земной атмосфере
- 142. Аргон служит для создания инертной атмосферы в
- 143. Слайд 143
- 144. К четвёртому пери́оду периоди́ческой систе́мы относятся
- 145. Химические элементы четвёртого периода
- 146. По-гречески – окраска, цвет. Многие его соединения
- 147. Структура ячейки на примере атома железа Обозначение
- 148. ЖЕЛЕЗОПахать и строить - все он может, если ему уголек в том поможет…
- 149. 110
- 150. Нахождение в природе В земной коре железо распространено
- 151. Характеристика элемента4-период, 4ряд, 8-группа, побочная подгруппа, порядковый
- 152. ФИЗИЧЕСКИЕ СЫВОЙСТВАЖелезо - сравнительно мягкий ковкий серебристо-серый
- 153. Железо, отдавая два внешних электрона, проявляет степень
- 154. Химические свойстваПри нагревании2Fe + 3Cl2 =2FeCl33Fe +2O2=
- 155. Химические свойства Fe + CuSO4 = Cu
- 156. При нагревании2Fe + 6H2SO4(k)=Fe2(SO4)3 + 3SO2+6H2OFe+ 6HNO3(k)= Fe(NO3)3+ 3NO2+ 3H2O
- 157. Качественные реакции на ионы Fe2+ и Fe3+.
- 158. Минералы железоFe3O4 магнитный железняк или магнетит Fe2O3
- 159. Feкрасный железняк(руда гематит Fe2O3)магнитный железняк(руда магнетит Fe2O4)бурый
- 160. ПрименениеМагнитный, красный, бурый железняки –для производства черной
- 161. Железо содержится в крови – гемоглобине, а
- 162. В растениях Железо влияет на процесс фотосинтеза.
- 163. В быту человекаИз железа изготавливают различные виды транспорта
- 164. В военной промышленности
- 165. Железо в истории В истории железо известно очень
- 166. Когда открыто железо никто не знает и
- 167. Слайд 167
- 168. Слайд 168
- 169. К пя́тому пери́оду периоди́ческой систе́мы относятся
- 170. Слайд 170
- 171. Один из первых элементов, открытый в начале
- 172. По-гречески белый – «алофос». По-видимому, от этого
- 173. Концентраты солей этого металла обнаруживались даже по
- 174. 129Рубидий (Rb) — первый элемент пятого периода, мягкий серебристо-белый щелочной
- 175. Рутений (Ruthenium) Ru — элемент VIII группы 5-го
- 176. Слайд 176
- 177. Элемент был открыт в 1803г. английским химиком
- 178. Слайд 178
- 179. По-гречески - фиолетовый. Такой цвет имеют пары этого элемента, а также его растворы.ЙОД
- 180. По-гречески – белый, блестящий, сверкающий. Интересно, что единственная страна названа по химическому элементу, а не наоборот.СЕРЕБРОAg
- 181. Шестой период периодической системы элементовШестой период (Cs — Rn) включает
- 182. Слайд 182
- 183. 131
- 184. Седьмой период периодической системы элементовСедьмой период, начинающийся
- 185. Слайд 185
- 186. VI ГРУППА
- 187. VII ГРУППА
- 188. VIII ГРУППА
- 189. Слайд 189
- 190. Слайд 190
- 191. Франций - (Francium). Франций - химический элемент
- 192. Эти элементы следуют после лантана и актиния, принадлежат к 3 группе.
- 193. Слайд 193
- 194. Окраска пламени соединениями щелочных и щелочноземельных металлов
- 195. ХАРАКТЕРИСТИКА МЕТАЛЛОВ ГЛАВНОЙ ПОДГРУППЫ I ГРУППЫЩелочны́е мета́ллы:
- 196. Стали бывают углеродистыми (в таких сталях нет
- 197. Слайд 197
- 198. Слайд 198
- 199. Слайд 199
- 200. Слайд 200
- 201. Слайд 201
- 202. Слайд 202
- 203. ПОЛУЧЕНИЕ АЛЮМИНИЯ
- 204. Со сложными веществами:4) С водой (после удаления
- 205. ХИМИЧЕСКИЕ СВОЙСТВАС простыми веществами:1) С кислородом:4Al0 +
- 206. ФИЗИЧЕСКИЕ СВОЙСТВАМеталл серебристо-белого цвета, легкий, плотность 2,7
- 207. АЛЮМИНИЙ13Al [Ne] 3s23p1 Алюминий находится в
- 208. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ Все
- 209. ХИМИЧЕСКИЕ СВОЙСТВАЩелочноземельные элементы - химически активные металлы.
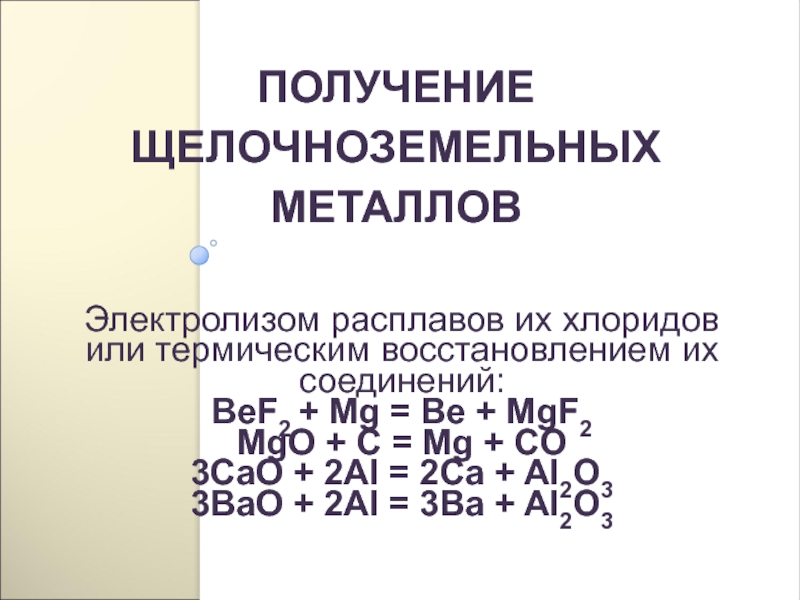
- 210. ПОЛУЧЕНИЕ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВЭлектролизом расплавов их хлоридов или
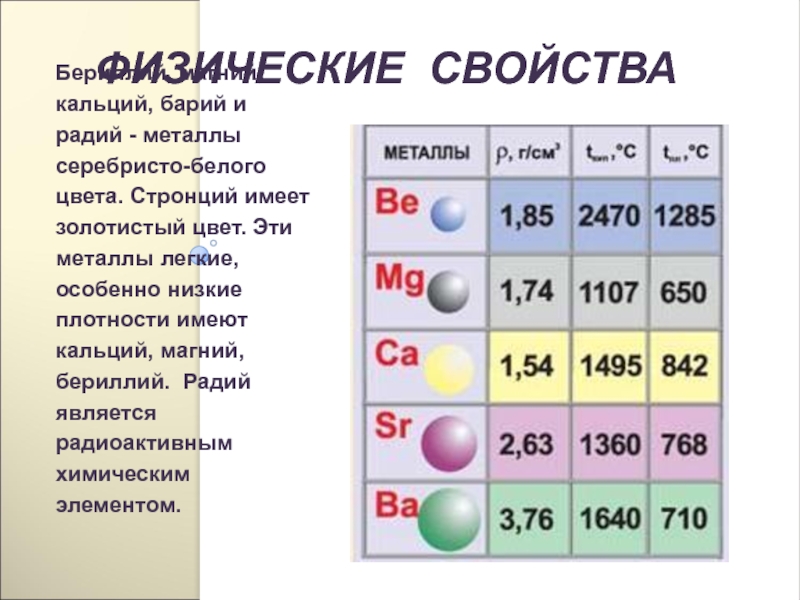
- 211. ФИЗИЧЕСКИЕ СВОЙСТВАБериллий, магний, кальций, барий и
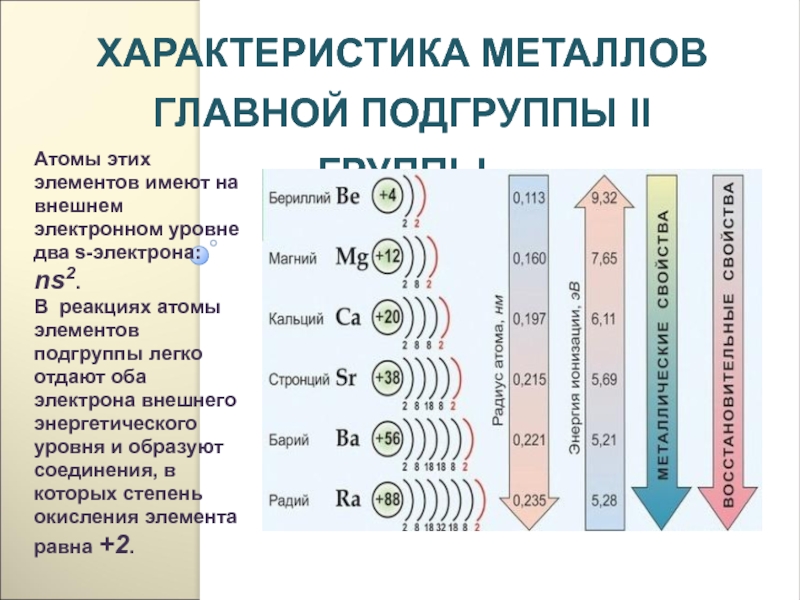
- 212. ХАРАКТЕРИСТИКА МЕТАЛЛОВ ГЛАВНОЙ ПОДГРУППЫ II ГРУППЫАтомы этих
- 213. Мел, известняк, мрамор не растворяются в чистой
- 214. Кальций в природе Кальциевые горные породы
- 215. Слайд 215
- 216. Положение элемента в ПС отражает строение его атомов
- 217. Сера - химический элементКаков химический знак?В какой
- 218. План характеристики элемента: 1. Символ и название.2.
Слайд 1Государственное бюджетное профессиональное образовательное учреждение КК «Венцы-Заря» Сельскохозяйственный техникум Методическая разработка
Слайд 3Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все
из элементов состоит единых.
Как формула, как график трудовой
строй Менделеевской системы строгой.
Вокруг тебя творится мир живой,
входи в него, вдыхай, руками трогай.
Степан Щипачев
«Читая Менделеева»
3
Слайд 4Химия – это наука о веществах и их свойствах, о превращениях
Химия - наука конкретная и касается бесчисленных веществ вокруг.
Химия – древняя наука, ей несколько тысяч лет. Тем не менее, в ней до сих пор много неоткрытого. Ведь многие элементы и вещества открывают до сих пор.
4
Слайд 7ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Периодическая система химических элементов (таблица Менделеева) - классификация
7
Слайд 8Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869
.8
Слайд 14 Периодическая таблица химических элементов – графическое изображение периодического закона.
Период –
Периоды разделяют на малые (1 – 3) и большие (4 – 7). Малые периоды состоят из одного горизонтального ряда. Большие периоды состоят из двух горизонтальных рядов. Верхние ряды больших периодов называются четными, нижние ряды — нечетными. В шестом периоде после лантана (Z = 57) находятся 14 элементов (Z = 58 – 71), которые похожи по свойствам на лантан и называются лантоноидами. Они располагаются в нижней части периодической системы.
14
Слайд 15Периоды
1-ый, 2-ой и 3-ий периоды называют малыми.
4-ый, 5-ый, 6-ой и 7-ой
15
Слайд 16
В периодах с увеличением зарядов атомных
Возрастает число электронов на внешнем уровне атома;
Число энергетических уровней в атомах остается постоянным;
Уменьшается радиус атомов. В периодах:
высшая положительная степень окисления увеличивается от +1 до +8;
Низшая степень окисления увеличивается от - 4 до -1;
в соединениях элементов происходит усиление кислотных и ослабление основных свойств.
Номер периода – число энергетических уровней (электронных слоев) в атомах элементов данного периода.
16
Слайд 18Визитка химического элемента
Порядковый номер: 1
Период: 1
Группа: 1, 7
Подгруппа: главная
Электронная формула атома:
18
Слайд 19Водород
Но гораздо больше на Земле связанного водорода: ведь он входит
Например, ближайшая к нам звезда Галактики, которую мы знаем под именем "Солнце", на 70% своей массы состоит из водорода. Атомов водорода во Вселенной в несколько десятков тысяч раз больше, чем всех атомов всех металлов, вместе взятых. Даже его товарищ по периоду, очень легкий и широко распространенный элемент гелий содержится на Солнце в количестве, в пять раз меньшем, чем водород…
В земной атмосфере тоже есть немного водорода в виде простого вещества - газа состава Н2. Водород легче воздуха, и поэтому его находят в верхних слоях атмосферы.
Водород входит в состав всех органических веществ.
19
Слайд 20К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы первой строки (или первого
Водоро́д — первый элементэлемент периодической системы элементов.
Широко распространён в природе.
Простое вещество водород — H2 — лёгкий бесцветный — лёгкий бесцветный газ — лёгкий бесцветный газ. В смеси с воздухом — лёгкий бесцветный газ. В смеси с воздухом или кислородом — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
20
Слайд 23Получение водорода
1) В лаборатории:
Zn + 2HCl =
2) В промышленности:
Взаимодействием угля с водой С + Н2О = СО + Н2
Метана с водой
СН4 + Н2О = СО + 3Н2
Электролизом воды
2Н2О = 2Н2 + О2
23
Слайд 24Химические свойства
1) + неметалл:
2Н2 + О2 = 2Н2О
Н2 + Сl2 =
H2 + S = H2S
3H2 + N2 = 2NH3
2) + металл:
H2 + 2Na = 2NaH
H2 + Ca = CaH2
24
Слайд 25Особенности обращения
Водород при смеси с воздухомВодород при смеси с воздухом образует
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75(74) % объёмных.
25
Слайд 27Применение водорода
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
При производстве аммиакаПри производстве
Пищевая промышленность
При производстве маргарина из жидких растительных масел
Зарегистрирован в качестве пищевой добавкиЗарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Авиационная промышленность
Водород очень лёгок и в воздухеВодород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижаблиВодород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шарыВодород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковыхВедутся исследования по применению водорода как топлива для легковых и грузовых автомобилейВедутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
27
Слайд 28Гелий
Ге́лий возглавляет группу инертных газов в периодической таблице. Он является одним
Схема атома гелия
28
Слайд 29Символ элемента, выполненный из газоразрядных трубок, наполненных гелием. При пропускании тока
Спектральные линии гелия
29
Слайд 30Гелий впервые был идентифицирован
как химический элемент в 1868 П.Жансеном при
назвали гелием от греч. «гелиос», что означает
солнце. В то время не знали, что гелий – инертный газ,
и предполагали, что это металл.
Поскольку гелий обладает низкой плотностью и негорюч, им заполняют метеорологические шары-зонды, аэростаты, дирижабли. Жидкий гелий используется для создания низких температур, близких к абсолютному нулю.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой
30
Слайд 31Ге́лий — второй элементвторой элемент периодической системы химических элементоввторой элемент периодической системы химических элементов Д. И. Менделеевавторой элемент периодической системы химических элементов Д. И. Менделеева с атомным
Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), первом периоде периодической системы. Возглавляет группу инертных газов в периодической системе Менделеева.
Обозначается символом He (лат. Helium).
Простое вещество Простое вещество гелий (CAS-номер Простое вещество гелий (CAS-номер: 7440-59-7) — инертный одноатомный газ без цвета, вкуса и запаха.
Гелий — один из наиболее распространённых элементов во ВселеннойГелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода.
Также гелий является вторым по лёгкости (после водорода) химическим веществом.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой -Дистилляция
31
Слайд 34
24
Литий 3Li
Lithium
(He)
Атомный номер 3
Атомная масса 6,941
Плотность, кг/м³ 530
Температура плавления, °С 180,5
Температура кипения, °С 1342
Теплоемкость, кДж/(кг·°С) 3,307
Электроотрицательность 1,0
Ковалентный радиус, Å 1,23
1-й ионизац. потенциал, эв 5,39
34
Слайд 35 Литий ― это элемент 2
Строение атома лития можно отразить так: 3Li ― 2ē, 1ē. Атомы лития будут проявлять сильные восстановительные свойства: легко отдадут свой единственный внешний электрон и получат в результате степень окисления (с. о.) +1. Эти свойства атомов лития будут слабее выражены, чем у атомов натрия, что связано с увеличением радиусов атомов: Rат (Li) < Rат (Na). Восстановительные свойства атомов лития выражены сильнее, чем у бериллия, что связано и с числом внешних электронов, и с расстоянием от ядра до внешнего уровня. Литий ― простое вещество, представляет собой металл, а, следовательно, имеет металлическую кристаллическую решетку и металлическую химическую связь. Заряд иона лития: не Li+1 (так указывают с. о.), а Li+. Общие физические свойства металлов, вытекающие из их кристаллического строения: электро- и теплопроводность, ковкость, пластичность, металлический блеск и т. д.
35
Слайд 3727
Бериллий Berylliu
Атомный номер
Атомная масса 9,0122
Плотность, кг/м³ 1850
Температура плавления, °С 1285
Температура кипения, °С 2470
Теплоемкость, кДж/(кг·°С) 1,884
Электроотрицательность 1,5
Ковалентный радиус, Å 0,90
1-й ионизац. потенциал, эв 9,32
m(He) 2s2
27
Бериллий (лат. Beryllium), Be, хямический элемент II группы периодической системы Менделеева, атомный номер 4, атомная масса 9,0122; легкий светло-серый металл. Имеет один стабильный изотоп 9Ве.
Историческая справка. Открыт в 1798 году в виде оксида ВеО, выделенной из минерала берилла Л. Вокленом. Соли Бериллия сладкого вкуса, его вначале называли "глюциний" (от греч. glykys - сладкий) или "глиций". Название Glicinium (знак Gl) употребляется (наряду с Бериллием) только во Франции. Применение Бериллия началось в 40-х годах 20 века, хотя его ценные свойства как компонента сплавов были обнаружены еще ранее, а замечательные ядерные - в начале 30-х годов 20 века.
Распространение Бериллия в природе. Бериллий - редкий элемент, среднее содержание его в земной коре 6·10-4% по массе. Бериллий - типичный литофильный элемент, характерный для кислых, субщелочных и щелочных магм. Известно около 40 минералов Бериллия.
Физические свойства Бериллия. Кристаллическая решетка Бериллия гексагональная плотноупакованная с периодами а=2,855Å и с = 3,5840Å. Бериллий легче алюминия, его плотность 1847,7 кг/м3 (у Аl около 2700 кг/м3), tпл 1285°С, tкип 2470°С. Бериллий обладает наиболее высокой из всех металлов теплоемкостью, 1,80 кДж/(кг·К) или 0,43 ккал/(кг·°С), высокой теплопроводностью, 178 Вт/(м·К) или 0,45 кал/(см·сек·°С) при 50°С, низким электросопротивлением, 3,6-4,5 мком·см при 20°С; коэффициент линейного расширения 10,3-131 (25-100°С).
Бериллий - хрупкий металл; его ударная вязкость 10-50 кДж/м2 (0,1-0,5 кгс·м/см2). Температура перехода Бериллия из хрупкого состояния в пластическое 200-400°С.
Химические свойства Бериллия. В химических соединениях Бериллий 2-валентен (конфигурация внешних электронов 2s2). Бериллий обладает высокой химической активностью, но компактный металл устойчив на воздухе благодаря образованию тонкой и прочной пленки оксида ВеО. При нагревании выше 800°С быстро окисляется. С водой до 100°С Бериллий практически не взаимодействует. Расплавленный Бериллий взаимодействует с большинством оксидов, нитридов, сульфидов и карбидов. Единственно пригодным материалом тиглей для плавки Бериллия служит оксид бериллия.
37
Слайд 38Бериллий присутствует в тканях многих растений и животных. Содержание в почвах
При избытке в рационе Ве, по-видимому, происходит связывание в кишечнике ионов фосфорной кислоты в неусвояемый фосфат Ве. Активность некоторых ферментов (щелочной фосфатазы, аденозинтрифосфатазы) тормозится малыми концентрациями Ве. Под влиянием Ве при недостатке фосфора развивается не излечиваемый витамином D бериллиевый рахит, встречаемый у животных в биогеохимических, богатых Ве.
Соединения Ве очень ядовиты, особенно в виде пыли и дыма, обладают аллергическим и канцерогенным действием, раздражают кожу и слизистые оболочки. При попадании в легкие могут вызвать хроническое заболевание – бериллиоз (легочная недостаточность). Заболевания легких, кожи и слизистых оболочек могут возникнуть через 10–15 лет после прекращения контакта с Ве.
Серьезный недостаток Ве, заключающийся в низкой ударной вязкости и хладноломкости, может быть преодолен использованием сплавов с Al. Из диаграммы состояния Al–Be видно, что эти элементы практически взаимно нерастворимы.
38
Слайд 39В медицине как антисептические средства находят применение бура и борная кислота
(He) 2s22p1
Атомный номер 5
Атомная масса 10,811
Плотность, кг/м³ 2340
Температура плавления, °С 2030
Температура кипения, °С 3860
Теплоемкость, кДж/(кг·°С) 1,293
Электроотрицательность 2,0
Ковалентный радиус, Å 0,82
1-й ионизац. потенциал, эв 8,3
39
Бор Boron 5B
Слайд 42Углерод — принадлежит к числу элементов, в значительной степени распространенных в 30природе.
В воздухе углерод находится в малом количестве, в виде окиси углерода (СО,), углекислоты (CO2), углеводородов и пр.
В воде рек морей и пр. — в виде углекислоты и углекислых соединений кальция, магния, железа и пр.
В живых организмах содержится в виде белков, жиров и углеводов.
В наземных растениях, животных и бактерий 54%
В водных растениях и животных 45,4-46,5%
В земной коре — в виде каменного и бурого угля, антрацита, нефти, асфальта, озокерита, углекислых солей и пр.
Присутствие углерода в небесных телах показывает спектроскоп; кроме того, его находят в метеоритах.
42
Слайд 43Углерод
Атомный номер 6
Атомная
Плотность, кг/м³ 2260
Температура плавления, °С 3700 (возг.)
Теплоемкость, кДж/(кг·°С) 0,69
Электроотрицательность 2,5
Ковалентный радиус, Å 0,77
1-й ионизац. потенциал, эв 11,26
Углерод (лат. Carboneum), С, химический элемент IV группы периодической системы Менделеева, атомный номер 6, Историческая справка. Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз - как драгоценный камень. Значительно позднее стали применять графит для изготовления тиглей и карандашей.
1
1
1
Слайд 44Аллотропные модификации
Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет
а – модель строения алмаза
б – модель строения графита
45
Слайд 45Аллотропные модификации
Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже
Куллинан
Эксельсиор
Орлов
Хоуп
46
Слайд 46Немного из истории
Углерод в виде древесного угля применялся в глубокой древности для выплавки
В 1772 году французский химик Антуан Лоран Лавуазье показал, что при сгорании алмаза образуется углекислый газ.
В 1797 году английский химик Смитсон Теннант (1761-1815) установил, чтоалмаз, графит и древесный уголь имеют одинаковую химическую природу.
47
Слайд 47Химические свойства углерода
При обычных условиях углерод химически инертен.
Реакционная способность повышается в ряду
алмаз – графит – аморфный углерод
Алмаз и графит инертны, устойчивы к действию кислот и щелочей.
48
Слайд 48Алмаз и графит сгорают в чистом кислороде при высоких температурах с
C + O2 (800° c ) CO2
2. Непосредственно из галогенов с аморфным углеродом реагирует лишь фтор:
C + 2F2 CF4
С остальными галогенами реакция происходит лишь при нагревании.
3. С металлами и оксидами некоторых металлов углерод образует соответствующие карбиды:
4 Al + 3C Al4C3 3C + CaO CaC2 + 2CO
4. Взаимодействие карбидов с водой
Al4C3 + 12H2O = 4Al(OH)3+ 3CH4 CaC2 + 2H2O → C2H2 + Ca(OH)2
36
Слайд 51Азот – химический элемент.
Положение в ПС:
Возможные степени окисления:
-3,0,+1,+2,+3,+4,+5
51
Слайд 52Азот – простое вещество.
Физические свойства:
Газ;
Без цвета;
Без запаха;
Плохо растворяется в воде;
При -1960С
Химические свойства:
52
Слайд 5757
Оно нам хорошо известно:
Газообразный кислород,
Которым дышат, если честно,
И человек, и бегемот.
Из
(Обозначают буквой О)
Ёще придумала природа
Одно простое вещество,
Которое зовут озоном.
И в этом есть большой резон:
В грозу запахнет над газоном –
От слова «пахнущий» - озон.
Как по составу различают
Два аллотропных вещества?
О3озон обозначают,
А кислород – всего О2.
Слайд 59ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД»
Химический знак О
Положение в ПСХЭ период
Относительная атомная масса Аr(O)=16
Химическая формула вещества О2
Относительная молекулярная масса Mr(O2)=32
Валентность II
59
Слайд 60ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Кислород – газ, без цвета и запаха, мало
растворим в
при 20°C растворяется 3,1 объема
кислорода), кислород немного
тяжелее воздуха (1 л О2 при нормальных
условиях (н.у.) весит 1,43 г; 1 л воздуха
при н.у.-1,29 г),температура кипения
кислорода -183°C, температура
плавления -219°.
61
Слайд 62СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА
63
В промышленности кислород получают из воздуха. Воздух представляет собой
В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании.
а) разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2↑
б) электролиз воды
2H2O = 2H2↑ + O2↑
в) разложение пероксида водорода
2H2O2 = 2H2O + O2↑
Слайд 6364
г) разложение хлората калия
2KClO3 = 2KCl +
д) разложение оксида ртути (II)
2HgO = 2Hg + O2↑
Слайд 65
Фтор
Fluorine 9F
Атомный номер
Атомная масса 18,998
Плотность, кг/м³ 1,696
Температура плавления, °С-19,6
Температура кипения, °С- 188,2
Теплоемкость, кДж/(кг·°С) 0,753
Электроотрицательность 4,0
Ковалентный радиус, Å 0,72
1-й ионизац. потенциал, эв 17,42
(He) 2s22p5
Фтор - химический элемент VII группы периодической системы Менделеева. Атомный номер его 9, а атомная масса 18.998403. Конфигурация фтора 2s2 2p5. Он относится к галогенам. Фтор - бледно-желтый газ с резким запахом, плотность которого 1.70г/см3. Название от греческого «phthoros» - разрушение. Открыл его А.Муассан в 1886 году.
Фтор – довольно распространенный элемент. Из минералов фтора наибольшее значение имеют СаF2 — плавиковый шпат (флюорит), Nа3А1F6 — криолит и Са5(РО4)3F— фторапатит.
Фтор исключительно активен химически, он — сильнейший окислитель.
55
Слайд 6856
Неон (лат. Neonum), Ne, химический элемент VIII группы периодической системы Менделеева, относится
При обычных условиях Неон - газ без цвета и запаха. При 0°C и 760 мм рт. ст. (101 кн/м) плотность Неона 0,900 г/л, tпл -248,6 °C, tкип (при 101 кн/м) -245,9 °C, растворимость в воде 10,4 мл/л; кристаллическая решетка твердого Неона кубическая; параметр а элементарной ячейки равен 4,52 Å при -253 °C. Молекула Неон одноатомна. Внешняя электронная оболочка атома Неона содержит 8 электронов и очень устойчива; химические соединения Неон еще не синтезированы.
Получают Неон при разделении воздуха.
Применение Неона связано главным образом с электротехнической промышленностью. Лампы, заполненные Неоном, дающие красное свечение, используют в портах, на аэродромах и т. д. Жидкий Неон начинают применять для получения низких температур.
Слайд 69 Эмиссионный спектр неона (слева направо: от ультрафиолетовых до
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
Газоразрядные лампы, заполняемые неоном, раньше применялись в рекламе, но в последнее время на смену им пришли люминесцентные лампы.
Слайд 70Жидкий неон используют в качестве охладителя в криогенных установках. Газоразрядные лампы,
Во время исследования в спектре обнаружились новые линии. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать «болельщиком» отцовых работ. Увидев необычное свечение, он воскликнул: «new one!» Так возникло название газа «неон», по-древнегречески значит «новый».
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха.
58
Слайд 72Легкие металлы.
металлы 3-5 период главных подгрупп: алюминий Al, галлий Ga, индий
Слайд 74 Натрий
11Na Натрий Sodium(Ne)3s1
Атомный номер
Атомная масса 22,990
Плотность, кг/м³ 970
Температура плавления, °С 97,8
Теплоемкость, кДж/(кг·°С) 1,235
Электроотрицательность 0,9
Ковалентный радиус, Å 1,54
1-й ионизац. потенциал, эв 5,14
Нахождение в природе. Натрий по своей распространенности в природе занимает 6 место среди элементов. Присутствует в атмосфере Солнца и в межзвездном пространстве, содержание натрия в земной коре- 2.3 %, в морской воде- 1.05 %. Натрий по своей распространенности в природе занимает 6 место среди элементов. Присутствует в атмосфере Солнца и в межзвездном пространстве, содержание натрия в земной коре- 2.3 %, в морской воде- 1.05 %. Натрий входит в состав человеческого организма, в крови содержится около 0.6 % NaCl.
Осмотическое давление крови поддерживается на необходимом уровне в основном за счет хлорида натрия. Натрий входит в состав человеческого организма, в крови содержится около 0.6 % NaCl.
В природе натрий встречается в виде минералов, основными из которых являются: -каменная соль NaCl, -каменная соль NaCl, -глауберова соль Na2SO 4 *10H2O, -глауберова соль Na2SO4 *10H2 O, -криолит Na 3 AlF 6,
Слайд 78Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие
Li+ - карминово-красный
Na+ - желтый
K+, Rb+ и Cs+ - фиолетовый
Так выглядит проба на окрашивание пламени солями натрий
Карминово-красное окрашивание пламени солями лития
Окрашивание пламени горелки ионами калия
Слайд 80СТРОЕНИЕ АТОМОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Все щелочные металлы имеют один s-электрон на внешнем
Слайд 81ХИМИЧЕСКИЕ СВОЙСТВА
Реакции с неметаллами
(образуются бинарные соединения):
4Li + O2 2Li2O(оксид лития)
2Na
K + O2 KO2(надпероксид калия)
2Li + Cl2 = 2LiCl(галогениды)
2Na + S = Na2S(сульфиды)
2Na + H2 = 2NaH(гидриды)
6Li + N2 = 2Li3N(нитриды)
2Li + 2C = 2Li2C2(карбиды)
Слайд 83Физические свойства
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия),
калий
рубидий
литий
натрий
цезий
Слайд 8461
Металл Натрий
Физические свойства. Натрий- мягкий серебристо-белый легкоплавкий металл(температура плавления 97.9 С),хорошо
Получение Натрия. Основной промышленный метод получения Натрия - электролиз расплава поваренной соли NaCl, содержащей добавки KCl, NaF, CaCl2 и другие, которые снижают температуру плавления соли до 575-585 °C. Электролиз чистого NaCl привел бы к большим потерям Натрия от испарения, так как температуры плавления NaCl (801 °C) и кипения Na (882,9 °C) очень близки. Электролиз проводят в электролизерах с диафрагмой, катоды изготовляют из железа или меди, аноды - из графита. Одновременно с Натрием получают хлор. Старый способ получения Натрия - электролиз расплавленного едкого натра NaOH, который значительно дороже NaCl, однако электролитически разлагается при более низкой температуре (320-330 °C).
Слайд 86
Применение щелочных металлов
Электро-
вакуумная
техника
В мощных
осветительных
лампах
Производство
органических
веществ
Производство
сверхлегких
сплавов
Гальванические
элементы для
космических
аппаратов
Фотоэлементы
Очистка
инертных
газов
Li
Na
Cs
Rb
K
Теплоноситель
в ядерных
реакторах
Часы
Слайд 873 января 1959 года
В небе появилась комета. Необычная
Это было первое космическое применение натрия.
Слайд 88 Магний
12Mg Magnesium
Атомный номер
Атомная масса 24,305
Плотность, кг/м³ 1740
Температура плавления, °С 650
Теплоемкость, кДж/(кг·°С) 1,047
Электроотрицательность 1,2
Ковалентный радиус, Å 1,36
1-й ионизац. потенциал, эв 7,64
(Ne) 3s2
Магний (лат. Magnesium), Mg, химический элемент II группы периодической системы Менделеева. Магний открыт в 1808 году Г. Дэви, который подверг электролизу с ртутным катодом увлажненную магнезию; Дэви получил амальгаму, а из нее после отгонки ртути - новый порошкообразный металл, названный магнием. В 1828 году французский химик А. Бюсси восстановлением расплавленного хлорида Магния парами калия получил Магний в виде небольших шариков с металлическим блеском.
Распространение Магния в природе. Магний - характерный элемент мантии Земли, в ультраосновных породах его содержится 25,9% по массе. В земной коре Магния меньше, средний кларк его 1,87%; преобладает Магний в основных породах (4,5%), в гранитах и других кислых породах его меньше (0,56%).
Физические свойства Магния. Компактный Магний - блестящий серебристо-белый металл, тускнеющий на воздухе вследствие образования на поверхности окисной пленки. Магний кристаллизуется в гексагональной решетке, а = 3,2028Å, с = 5,1998Å. Атомный радиус 1,60Å, ионный радиус Mg2+ 0,74Å. 20,0 кгс/мм2), относительное удлинение 8,0 и 11,5%.
Химические свойства Магния. Конфигурация внешних электронов атома Магния 3s2. Во всех стабильных соединениях Магний двухвалентен. Нагревание до 300-350 °С не приводит к значительному окислению компактного Магния, так как поверхность его защищена оксидной пленкой, но при 600-650 °С Магний воспламеняется и ярко горит, давая оксид магния и отчасти нитрид Mg3N2.
Слайд 90 Алюминий
13Al
Aluminium
Атомный
Атомная масса 26,982
Плотность, кг/м³ 2700
Температура плавления, °С 660
Теплоемкость, кДж/(кг·°С) 0,9
Электроотрицательность 1,5
Ковалентный радиус, Å 1,18
1-й ионизац. потенциал, эв 5,98
(Ne) 3s23p1
Алюминий (лат. Aluminium), Al, химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815; серебристо-белый легкий металл. Состоит из одного стабильного изотопа 27Al.
Историческая справка. Название Алюминий происходит от лат. alumen - так еще за 500 лет до н. э. назывались алюминиевые квасцы, которые применялись как протрава при крашении тканей и для дубления кожи. Датский ученый X. К. Эрстед в 1825, действуя амальгамой калия на безводный АlСl3 и затем отгоняя ртуть, получил относительно чистый Алюминий.
Распространение Алюминия в природе. По распространенности в природе Алюминий занимает 3-е место после кислорода и кремния и 1-е - среди металлов. Его содержание в земной коре составляет по массе 8,80% . В свободном виде Алюминий в силу своей химической активности не встречается.
Физические свойства Алюминия. Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Он легко поддается ковке, штамповке, прокатке, волочению. Алюминий хорошо сваривается газовой, контактной и других видами сварки. Решетка Алюминия кубическая гранецентрированная с параметром а = 4,0413 Å.
Слайд 91Алюминий — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 13.
Алюминий
Слайд 92Простое вещество алюминий — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает
Внешний вид простого вещества
Слайд 93Физические свойства
Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого
Металл серебристо-белого цвета, лёгкий
плотность — 2,7 г/см³
температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C
удельная теплота плавления — 390 кДж/кг
температура кипения — 2500 °C
удельная теплота испарения — 10,53 МДж/кг
временное сопротивление литого алюминия — 10-12 кг/мм², деформируемого — 18-25 кг/мм², сплавов — 38-42 кг/мм²
Твёрдость по Бринеллю — 24…32 кгс/мм²
высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу
Модуль Юнга — 70 ГПа
Алюминий обладает высокой электропроводностью (37·106 См/м) и теплопроводностью (203,5 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью.
Слабый парамагнетик.
Температурный коэффициент линейного расширения 24,58·10−6 К−1 (20…200 °C).
Температурный коэффициент электрического сопротивления 2,7·10−8K−1.
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Слайд 94Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора
Слайд 95Нахождение в природе
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al
По распространённости в земной коре Земли занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Некоторые из них:
Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд (сапфир, рубин, наждак) — Al2O3
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых специфических восстановительных условиях возможно образование самородного алюминия.
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в поверхностных водных объектах России колеблются от 0,001 до 10 мг/л, в морской воде 0,01 мг/л.
Слайд 96Химические свойства Алюминия. Внешняя электронная оболочка атома Алюминия состоит из 3 электронов
Получение Алюминия. В промышленности Алюминий получают электролизом глинозема Аl2О3, растворенного в расплавленном криолите NasAlF6 при температуре около 950° С. Используются электролизеры трех основных конструкций: 1) электролизеры с непрерывными самообжигающимися анодами и боковым подводом тока, 2) то же, но с верхним подводом тока и 3) электролизеры с обожженными анодами. Электролитная ванна представляет собой железный кожух, футерованный внутри тепло- и электроизолирующим материалом - огнеупорным кирпичом, и выложенный угольными плитами и блоками.
Применение Алюминия. Сочетание физических, механических и химических свойств Алюминия определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с других металлами. В электротехнике Алюминий успешно заменяет медь, особенно в производстве массивных проводников, например, в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах (электрическая проводимость Алюминия достигает 65,5% электрической проводимости меди, и он более чем в три раза легче меди; при поперечном сечении, обеспечивающем одну и ту же проводимость, масса проводов из Алюминий вдвое меньше медных). Алюминий используют в производстве взрывчатых веществ (аммонал, алюмотол). Широко применяют различные соединения Алюминия.
Алюминий в организме. Алюминий входит в состав тканей животных и растений; в органах млекопитающих животных обнаружено от 10-3 до 10-5% Алюминия (на сырое вещество). Алюминий накапливается в печени, поджелудочной и щитовидной железах. В растительных продуктах содержание Алюминия колеблется от 4 мг на 1 кг сухого вещества (картофель) до 46 мг (желтая репа), в продуктах животного происхождения - от 4 мг (мед) до 72 мг на 1 кг сухого вещества (говядина). В суточном рационе человека содержание Алюминия достигает 35-40 мг.
65
Слайд 97Алюминий и его соединения в ракетной технике
Алюминий и его соединения используются
Порошковый алюминий как горючее в твердых ракетных топливах. Применяется также в виде порошка и суспензий в углеводородах.
Гидрид алюминия.
Боранат алюминия.
Триметилалюминий.
Слайд 98Кремний
4Si Silicon
Атомный номер
Атомная масса 28,086
Плотность, кг/м³ 2330
Температура плавления,°С
1410
Температура кипения, °С 2600
Теплоемкость,кДж/(кг·°С) 0,678
Электроотрицательность 1,8
Ковалентный радиус, Å 1,11
1-й ионизац. потенциал, эв 8,15
66
Кремний (лат. Silicium), Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086. В природе элемент представлен тремя стабильными изотопами:28Si (92,27%), 29Si (4,68%) и 30Si (3,05%).
Историческая справка. Соединения Кремния, широко распространенные на земле, были известны человеку с каменного века. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. Применение соединений Кремния, связанное с их переработкой, - изготовление стекла - началось около 3000 лет до н. э. (в Древнем Египте). Раньше других известное соединение Кремния - оксид SiO2 (кремнезем). В 18 веке кремнезем считали простым телом и относили к "землям" (что и отражено в его названии). Сложность состава кремнезема установил И. Я. Берцелиус.
Распространение Кремния в природе. По распространенности в земной коре Кремний - второй (после кислорода) элемент, его среднее содержание в литосфере 29,5% (по массе). В земной коре Кремний играет такую же первостепенную роль, как углерод в животном и растительном мире. Для геохимии Кремния важна исключительно прочная связь его с кислородом. Около 12% литосферы составляет кремнезем SiO2 в форме минерала кварца и его разновидностей. 75% литосферы слагают различные силикаты и алюмосиликаты (полевые шпаты, слюды, амфиболы и т. д.). Общее число минералов, содержащих кремнезем, превышает 400.
Слайд 99Физические свойства Кремния. Кремний образует темно-серые с металлическим блеском кристаллы, имеющие кубическую
Химические свойства Кремния. В соответствии с положением Кремния в периодической системе Менделеева 14 электронов атома Кремния распределены по трем оболочкам: в первой (от ядра) 2 электрона, во второй 8, в третьей (валентной) 4; конфигурация электронной оболочки 1s22s22p63s23p2. Последовательные потенциалы ионизации (эв): 8,149; 16,34; 33,46 и 45,13. Атомный радиус 1,ЗЗÅ, ковалентный радиус 1,17Å, ионные радиусы Si4+ 0,39Å, Si4- 1,98Å. Кремний образует соединения почти со всеми металлами - силициды (не обнаружены соединения только с Bi, Tl, Pb, Hg). Получено более 250 силицидов, состав которых (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si и других) обычно не отвечает классическим валентностям. Силициды отличаются тугоплавкостью и твердостью; наибольшее практическое значение имеют ферросилиций (восстановитель при выплавке специальных сплавов, см. Ферросплавы) и силицид молибдена MoSi2 (нагреватели электропечей, лопатки газовых турбин и т. д.).
Получение Кремния. Кремний технической чистоты (95-98%) получают в электрической дуге восстановлением кремнезема SiO2 между графитовыми электродами. В связи с развитием полупроводниковой техники разработаны методы получения чистого и особо чистого Кремния Это требует предварительного синтеза чистейших исходных соединений Кремния, из которых Кремний извлекают путем восстановления или термического разложения. Применение Кремния. Специально легированный Кремний широко применяется как материал для изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители тока, тиристоры; солнечные фотоэлементы, используемые в космических кораблях, и т. д.). Поскольку Кремний прозрачен для лучей с длиной волны от 1 до 9 мкм, его применяют в инфракрасной оптике, Кремний имеет разнообразные и все расширяющиеся области применения.
Кремний в организме. Кремний в организме находится в виде различных соединений, участвующих главным образом в образовании твердых скелетных частей и тканей. Особенно много Кремния могут накапливать некоторые морские растения (например, диатомовые водоросли) и животные (например, кремнероговые губки, радиолярии), образующие при отмирании на дне океана мощные отложения оксида кремния (IV). В холодных морях и озерах преобладают биогенные илы, обогащенные Кремнием, в тропич. морях - известковые илы с низким содержанием Кремния.
Слайд 100Открытие фосфора
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» - от греческого «светоносный»
68
Слайд 101период
Фосфор как химический элемент
3
группа
V
валентных электронов
степени окисления
-3; +3; +5
высший оксид
P2O5
водородное соединение
РН3
Слайд 102
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Р
БЕЛЫЙ
КРАСНЫЙ
ЧЕРНЫЙ
Сравните физические свойства
АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
Слайд 103
Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему
ЧЕРНЫЙ ФОСФОР
71
Слайд 104
Существует несколько форм красного фосфора Их структуры окончательно не
КРАСНЫЙ ФОСФОР
Слайд 105
Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС,
БЕЛЫЙ ФОСФОР
Слайд 106ХИМИЧЕСКИЕ СВОЙСТВА
С металлами:
Ca
C неметаллами:
P + O2 = P2O5
P + S = P2S5
74
Слайд 108
Р
ОРГАНИЗМЫ
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
НАХОЖДЕНИЕ В ПРИРОДЕ
АПАТИТ
Слайд 109Физиологическое действие
белого фосфора
Результат применения чрезмерного количества фосфора
Появление лягушек с
Фосфорный некроз – поражение челюстей
Слайд 110Получение фосфора
нагреванием смеси фосфорита, угля и
песка в электропечи:
Ca3(PO4)2 + C
78
Слайд 111ПРИМЕНЕНИЕ ФОСФОРА
Р
удобрения
ядохимикаты
Производство
спичек
Создание
дымовых завес
полупроводники
Производство
красок
Защита от
коррозии
умягчение воды
моющие средства
79
Слайд 112СЕРА
S
1s22s22p63s23p4
2ē
8ē
6ē
80
Сера — достаточно активный неметалл. Царская водка (смесь азотной
Слайд 114Физические свойства
Твёрдое кристаллическое вещество желтого цвета, без запаха.
Как и все неметаллы
Сера в природе практически не растворяется.
Температура плавления 1200С.
81
Слайд 118Химические свойства
Окислительные свойства серы (S0 + 2ē → S-2)
Сера реагирует со
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t°:
2Al + 3S –t°→ Al2S3
Zn + S –t°→ ZnS
С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
84
Слайд 119Химические свойства
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
S
кислородом:
S + O2 –t°→ S+4O2
2S + 3O2 –t°;Рt→ 2S+6O3
c галогенами (кроме йода):
S + Cl2 → S+2Cl2
c кислотами - окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
Слайд 120Реакции диспропорционирования:
3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O
сера растворяется
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия
86
Слайд 121Сера является на 16-м месте по распространённости в земной коре. Встречается в
Сера в природе
Слайд 123СЕРА - ЖИЗНЕННО ВАЖНЫЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ
Сера входит в состав белков. Особенно
Сера в природе
Слайд 124Применение серы
Серу применяют для производства :
Серной кислоты
Вулканизации каучука
Фунгицида в сельском хозяйстве
Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента - для получения серобетона.
90
Слайд 127Строение атома
Заряд ядра +17, электронная конфигурация внешней электронной оболочки атома: 3s23p5.
При движении по группе сверху вниз число энергетических уровней увеличивается, значит увеличивается
радиус атома и ослабляется связь валентных электронов с ядром. Таким образом, среди галогенов самый маленький атом у фтора и самый большой у астата. Легче всего оторвать электрон от атома At и труднее – от атома F.
93
Слайд 128Положение в таблице
Хлор - химический элемент седьмой группы, главной подгруппы, третьего
Общее название элементов VIIA группы – галогены – происходит от греческих слов – "галс" – соль и "генес" – рождающий, т. е. "солероды". У галогенов наиболее ярко по сравнению с остальными элементами выражены свойства неметаллов. Говорят, галогены – типичные неметаллы.
Слайд 129История открытия
Первым из галогенов был открыт хлор (К. Шееле, 1774 год).
В 1807 году английский химик Гемфри Дэви получил тот же газ, что и Шееле. Три года пытался Дэви выделить из него "мурий", но безуспешно. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" – желто-зеленый). Через пять лет Гей-Люсак дал газу название хлор. В жидком виде хлор был впервые получен в 1823 году М. Фарадеем.
Слайд 130Распространение в природе
Хлор – активный элемент
В природе он встречается только в
сильвина KCl,
сильвинита KCl · NaCl,
бишофита MgCl2 · 6H2O,
карналлита KCl · MgCl2 · 6Н2O,
каинита KCl · MgSO4 · 3Н2О.
Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37.
96
Слайд 132Возбуждения
В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном
98
Слайд 134Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р-облаков
Молекула хлора
Слайд 135Физические свойства
Хлор – ядовитый газ желто-зеленого цвета с резким запахом. Это первое
Слайд 136Физические свойства
С возрастанием молекулярной массы температуры плавления и кипения веществ, состоящих
Все галогены окрашены: фтор – светло-желтый, хлор – желтовато-зеленый, бром – красно-коричневый, йод – серо-фиолетовый.
За исключением фтора, который бурно реагирует с водой, галогены мало растворимы в воде. Чтобы приготовить концентрированный раствор, используют другие растворители. Водные растворы галогенов называются соответственно хлорной, бромной и йодной водой, в них галогены сохраняют в значительной мере свои свойства.
Хлор - это тяжелый зеленовато-желтый газ, обладающий острым удушающим запахом и высокой ядовитостью для всего живого - от едва различимых под микроскопом бактерий до крупнейших животных.
Tпл.= -101°С
Tкип.= -34° С
Слайд 137Получение
Основной промышленный способ получения хлора – электролиз хлоридов щелочных металлов (NaCl,
4HCl + O2 = 2Cl2 + 2H2O
В лаборатории молекулярный хлор получают взаимодействием HCl с перманганатом калия, оксидом марганца (IV), бихроматом калия и др.:
2KMnO4+16HCl (конц.) = 2KCl+2MnCl2+8H2O+5Cl2
При нагревании:
MnO2 + 4 HCl = MnCl2 + Cl2 + 2 H2O
6HCl + KClO3 = 3Cl2 + KCl + 3H2O
103
Слайд 138Применения хлора
В производстве пластикатов, синтетического каучука и др.
Для отбеливания в текстильной и
Производство веществ, убивающих вредных для посевов насекомых, но безопасные для растений.
Использовался как боевое отравляющее вещество (слезоточивый газ), а так же для производства других боевых отравляющих веществ: иприт, фосген.
Для обеззараживания воды — «хлорирования».
В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
В химическом производстве ядов, лекарств, удобрений.
В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
Как индикатор солнечных нейтрино в хлор-аргонных детекторах.
104
Слайд 139 Хлор , находит применение в сельском хозяйстве для борьбы с вредителями.
Основным компонентом отбеливателей является хлорная вода
В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы
Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Использовался как оружие массового поражения и в производстве других отравляющих веществ массового поражения: иприт, фосген
Слайд 140.
Хлор - один из химических элементов, без которого немыслимо существование
И хотя почти все пищевые продукты содержат некоторое количество поваренной соли, человек вынужден добавлять
Особую роль в пищеварении играет соляная кислота HCI, которая входит в состав желудочного сока .
Без 0,2 %-й соляной кислоты практически прекращается процесс переваривания пищи
В больших количествах соединения хлора ( хлорная известь) необходима для обеззараживания питьевой воды и воды в плавательных бассейнах
106
Слайд 141Арго́н —Третий по распространённости элемент в земной атмосфере — 0,93 % по объёму.
Аргон
Схема
Арго́н — элементэлемент главной подгруппы восьмой группы, третьего периода периодической системы химических
элементов элементов Д. И. Менделеева элементов Д. И. Менделеева, с атомным номером 18.
бозначаетссимволом Ar (лат. Argon).
Третий по распространённости элемент в земной атмосфереТретий по распространённости элемент в земной атмосфере (после азотаТретий по распространённости элемент в земной атмосфере (после азота и кислородаТретий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму.Простое веществоТретий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму.Простое вещество аргон (CAS-номерТретий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму.Простое вещество аргон (CAS-номер: 7440-37-1) — инертный одноатомный газ без цвета, вкуса и запаха.
107
Слайд 142Аргон служит для создания инертной атмосферы в металлургических процессах, в химическом
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9°C аргон конденсируется, при −189,4°С — кристаллизуется
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от греч. αργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность.
108
Слайд 144
К четвёртому пери́оду периоди́ческой систе́мы относятся элементы четвёртой строки (или
Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон. Первые два из них, калий и кальций, входят в s-блок Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон. Первые два из них, калий и кальций, входят в s-блок периодической таблицы, десять следующих являются d-элементами Четвёртый период содержит восемнадцать элементов (на десять элементов больше, чем предыдущий), в него входят: калий, кальций, скандий, титан,ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон. Первые два из них, калий и кальций, входят в s-блок периодической таблицы, десять следующих являются d-элементами, а остальные относятся к р-блоку. Следует обратить внимание, что заполненные 3d-орбитали появляются только у элементов 4 периода. Все элементы этого периода имеют стабильные изотопы, следовательно, они могут встречаться в природе
Слайд 146По-гречески – окраска, цвет. Многие его соединения окрашены: оксиды – в
ХРОМ
ответ
Cr
Слайд 147Структура ячейки на примере атома железа
Обозначение элемента
Порядковый номер элемента
Относительная атомная масса (Аr)
Название элемента
Слайд 150Нахождение в природе
В земной коре железо распространено достаточно широко.
Около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо. По запасам железных руд Россия занимает первое место в мире.
В морской воде 1·10–5 — 1·10–8% железа.
Слайд 151Характеристика элемента
4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер 26
26 электронов, 26
4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s2p63s2p6d64s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем
112
Слайд 152ФИЗИЧЕСКИЕ СЫВОЙСТВА
Железо - сравнительно мягкий ковкий серебристо-серый металл.
Температура плавления – 1535
Температура кипения около 2800 0С
При температуре ниже 770 0С железо обладает ферромагнитными свойствами
(оно легко намагничивается, и из него можно изготовить магнит).
Выше этой температуры
ферромагнитные свойства
железа исчезают,
железо «размагничивается».
Слайд 153
Железо, отдавая два внешних электрона, проявляет степень окисления +2;
отдавая три
Электронные структуры 3d- и 4s-орбиталей атома железа и ионов Fe+2 и Fe+3 можно изобразить так:
ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 154Химические свойства
При нагревании
2Fe + 3Cl2 =2FeCl3
3Fe +2O2= Fe3O4 (FeO Fe2O3)
Fe +S
При очень высокой температуре
4Fe + 3C =Fe4C3
4Fe + 3Si =Fe4Si3
3Fe + 2P = Fe3P2
115
Слайд 155Химические свойства
Fe + CuSO4 = Cu + FeSO4
Fe + 2HClр
Fe + H2SO4 p= FeSO4 + H2
Fe + H2SO4(k) =/=
Fe + HNO3 (к)=/=
Слайд 157Качественные реакции на ионы Fe2+ и Fe3+.
FeSO4 + K3 [Fe(CN)6
красная кровяная соль турнбулева синь
FeCI3 + K4 [Fe(CN)6 ] = KFe+3 [Fe +2(CN)6 ] +3KCI
желтая кровяная соль берлинская лазурь
FeCI3 + 3 KCNS = Fe(CNS )3 +3KCI кроваво-красный
118
Слайд 158Минералы железо
Fe3O4 магнитный железняк или магнетит
Fe2O3 красный железняк или
2Fe2O3.3H2O бурый железняк или лимонит
FeS2 железный или серный колчедан
FeSO4.7H2O железный купорос
Слайд 159
Fe
красный железняк
(руда гематит Fe2O3)
магнитный железняк
(руда магнетит Fe2O4)
бурый железняк
(руда гидрогетит НFeO2·nH2O)
шпатовый железняк
(руда
пирит
FeS2
(другие названия — серный колчедан, железный колчедан, дисульфид железа
Слайд 160Применение
Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали)
Железный
Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины
Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии .
Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe и C) и легированными (такие стали содержат добавки хрома, никеля, молибдена, кобальта и других металлов, улучшающие механические и иные свойства стали).
Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.
121
Слайд 161Железо содержится в крови – гемоглобине, а именно в красных кровяных
о
В ОРГАНИЗМЕ ЧЕЛОВЕКА
Слайд 165Железо в истории
В истории железо известно очень давно. из него изготовляли
Слайд 166
Когда открыто железо никто не знает и не узнает, так как
127
Слайд 169 К пя́тому пери́оду периоди́ческой систе́мы относятся элементы пятой строки (или
рубидий рубидий, стронций рубидий, стронций, иттрий рубидий, стронций, иттрий, цирконий рубидий, стронций, иттрий, цирконий, ниобий рубидий, стронций, иттрий, цирконий, ниобий, молибден рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма, теллур рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма, теллур, иод рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма, теллур, иод и ксенон рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма, теллур, иод и ксенон. Все элементы этого периода имеют пять электронных оболочек рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма, теллур, иод и ксенон. Все элементы этого периода имеют пять электронных оболочек. Первые два из них, рубидий и стронций, входят в s-блок рубидий, стронций, иттрий, цирконий, ниобий, молибден, технеций,рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма, теллур, иод и ксенон. Все элементы этого периода имеют пять электронных оболочек. Первые два из них, рубидий и стронций, входят в s-блок периодической таблицы, тогда как остальные относятся к р-блоку. Этот период содержит элементы, представляющие собой исключения из правил. Так технеций Этот период содержит элементы, представляющие собой исключения из правил. Так технеций является одним из двух элементов до свинца Этот период содержит элементы, представляющие собой исключения из правил. Так технеций является одним из двух элементов до свинца, который не имеет стабильных изотопов, амолибден Этот период содержит элементы, представляющие собой исключения из правил. Так технеций является одним из двух элементов до свинца, который не имеет стабильных изотопов, амолибден и иод являются самыми тяжелыми элементами, играющими биологическую роль. Кроме того, ниобий Кроме того, ниобий имеет наибольшую глубину магнитного проникновения среди всех элементов. Этот период имеет большое количество исключений из правила Клечковского Кроме того, ниобий имеет наибольшую глубину магнитного проникновения среди всех элементов. Этот период имеет большое количество исключений из правила Клечковского, к ним относятся: ниобий Кроме того, ниобий имеет наибольшую глубину магнитного проникновения среди всех элементов. Этот период имеет большое количество исключений из правила Клечковского, к ним относятся: ниобий (Nb), молибден Кроме того, ниобий имеет наибольшую глубину магнитного проникновения среди всех элементов. Этот период имеет большое количество исключений из правила Клечковского, к ним относятся: ниобий (Nb), молибден (Mo), рутений Кроме того, ниобий имеет наибольшую глубину магнитного проникновения среди всех элементов. Этот период имеет большое количество исключений из правила Клечковского, к ним относятся: ниобий (Nb), молибден (Mo), рутений (Ru), родий Кроме того, ниобий имеет наибольшую глубину магнитного проникновения среди всех элементов. Этот период имеет большое количество исключений из правила Клечковского, к ним относятся: ниобий (Nb), молибден (Mo), рутений (Ru), родий (Rh), палладий Кроме того, ниобий имеет наибольшую глубину магнитного проникновения среди всех элементов. Этот период имеет большое количество исключений из правила Клечковского, к ним относятся: ниобий (Nb), молибден (Mo), рутений (Ru), родий (Rh), палладий (Pd) и серебро (Ag).
Слайд 171Один из первых элементов, открытый в начале XVIII века Г.Кирхгофом и
РУБИДИЙ
Rb
Слайд 172По-гречески белый – «алофос».
По-видимому, от этого слова и произошло название
ОЛОВО
Sn
Слайд 173Концентраты солей этого
металла обнаруживались даже по интенсивному окрашиванию пламени горелки.
элемента.
ИНДИЙ
In
Слайд 174129
Рубидий (Rb) — первый элемент пятого периода, мягкий серебристо-белый щелочной металл с атомным номером 37
Рубидий входит как компонент в материал катодов для фотоэлементов и фотоэлектрических умножителей, входит в состав смазочных композиций, используемых в реактивной и космической технике, применяется как катализатор в гидридных топливных элементах. Пары рубидия используются в разрядных электрических трубках, лампах низкого давления, источниках резонансного излучения, в чувствительных магнитометрах, стандартах частоты и времени. Перспективно использование рубидия в качестве теплоносителя и рабочей среды в ядерных реакторах и турбоэлектрических генераторных установках. Мировое производство рубидия и его соединений около 450 кг/год.
Рубидий опасен в обращении, хранят его в ампулах из стекла пирекс в атмосфере аргона или в стальных герметичных сосудах под слоем обезвоженного масла (вазелинового, парафинового). Утилизируют рубидий обработкой остатков металла пентанолом.
|Стронций — второй элемент пятого периода, мягкий, ковкий и пластичный серебристо-белый щелочноземельный металл с атомным номером 38 и атомной массой 87,62.Природный стронций состоит из четырёх стабильных изотопов: 88Sr (82,56 %), 86Sr (9,86 %), 87Sr (7,02 %) и 84Sr (0,56 %). Стронций отличается большой химической активностью, по химическим свойствам сходен с кальцием и барием.
Содержание стронция в земной коре 3,4·10-2% по массе, в океанических водах содержится 11097000 т (8,1 мг/л). В свободном виде не встречается.
Стронций ограниченно используют в технике для раскисления меди и бронзы, в качестве легирующих добавок к сплавам магния, алюминия, свинца, никеля и меди. Более широко используют соединения стронция при изготовлении специальных оптических стёкол, в пиротехнических составах, в производстве ферромагнитных и люминесцентных материалов и т. д. Соли стронция, в том числе радиоактивного стронция, применяют в терапии кожных болезней, соли жирных кислот — при изготовлении консистентных смазок.
Радиоактивный стронций может поступать в окружающую среду в результате ядерных испытаний и аварий на АЭС. Как аналог кальция, стронций активно участвует в обмене веществ у растений. В растения стронций-90 попадает при загрязнении листьев и из почвы через корни. Особенно много его накапливают бобовые, корне- и клубнеплоды и злаки. При избытке стронция в организме человека прежде всего поражаются костная ткань, печень и кровь. Предельно допустимая концентрация стронция в воде 8 мг/л, в воздухе от 1 до 6 мг/м3 (для разных соединений по-разному).
Слайд 175Рутений (Ruthenium) Ru — элемент VIII группы 5-го периода периодической системы Д.
Слайд 177Элемент был открыт в 1803г. английским химиком У.Г.Волластоном. Его название произведено
РОДИЙ
Rh
Слайд 180По-гречески – белый,
блестящий, сверкающий. Интересно, что единственная страна названа по
СЕРЕБРО
Ag
Слайд 181
Шестой период периодической системы элементов
Шестой период (Cs — Rn) включает 32 элемента. В нём
Слайд 184Седьмой период периодической системы элементов
Седьмой период, начинающийся с Fr (Z = 87), также должен
Слайд 191Франций - (Francium).
Франций - химический элемент I группы периодической системы
Слайд 195ХАРАКТЕРИСТИКА МЕТАЛЛОВ ГЛАВНОЙ ПОДГРУППЫ I ГРУППЫ
Щелочны́е мета́ллы: литий Li, натрий Na,
Слайд 196
Стали бывают углеродистыми (в таких сталях нет других компонентов, кроме Fe
Стали получают, перерабатывая чугун и металлический лом в кислородном конвертере, в электродуговой или мартеновской печах. При такой переработке снижается содержание углерода в сплаве до требуемого уровня, как говорят, избыточный углерод выгорает.
Слайд 204Со сложными веществами:
4) С водой (после удаления защитной оксидной пленки):
2Al0 +
5) Со щелочами:
2Al0 + 2NaOH + 6H2O ® 2Na[Al+3(OH)4]
(тетрагидроксоалюминат натрия) + 3H2
6) Легко растворяется в соляной и разбавленной серной киcлотах:
2Al + 6HCl ® 2AlCl3 + 3H2
2Al + 3H2SO4(разб) ® Al2(SO4)3 + 3H2
При нагревании растворяется в кислотах - окислителях:
2Al + 6H2SO4(конц) ® Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(конц) ® Al(NO3)3 + 3NO2 + 3H2O
7) Восстанавливает металлы из их оксидов (алюминотермия):
8Al0 + 3Fe3O4 ® 4Al2O3 + 9Fe
2Al + Cr2O3 ® Al2O3 + 2Cr
Слайд 205ХИМИЧЕСКИЕ СВОЙСТВА
С простыми веществами:
1) С кислородом:
4Al0 + 3O2 → 2Al+32O3
2) С
2Al0 + 3Br20 → 2Al+3Br3
3) С другими неметаллами (азотом, серой, углеродом) реагирует при нагревании:
2Al0 + 3S t°→ Al2+3S3(сульфид алюминия)
2Al0 + N2 t° → 2Al+3N(нитрид алюминия)
4Al0 + 3С → Al4+3С3(карбид алюминия)
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O → 2Al(OH)3¯ + 3H2S
Al4C3 + 12H2O → 4Al(OH)3¯+ 3CH4
Слайд 206ФИЗИЧЕСКИЕ СВОЙСТВА
Металл серебристо-белого цвета, легкий, плотность 2,7 г/см³, температура плавления у
Твердость по Бринеллю 24-32 кгс/мм², высокая пластичность: у технического 35 %, у чистого 50 %, прокатывается в тонкий лист и даже фольгу.
Слайд 207АЛЮМИНИЙ
13Al [Ne] 3s23p1
Алюминий находится в главной п/группе III
На внешнем энергетическом уровне имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.
Слайд 208
ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
Все легко взаимодействуют с кислородом и
2Be + O2 = 2BeO
Ca + S = CaS
Бериллий и магний реагируют с кислородом и серой при нагревании, остальные металлы - при обычных условиях.
Все металлы этой группы легко реагируют с галогенами:
Mg + Cl2 = MgCl2
При нагревании все реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами:
Ca + H2 = CaH2 (гидрид кальция)
3Mg + N2 = Mg3N2 (нитрид магния)
Ca + 2C = CaC2 (карбид кальция)
Слайд 209ХИМИЧЕСКИЕ СВОЙСТВА
Щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями.
кальций
магний
бериллий
Слайд 210ПОЛУЧЕНИЕ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Электролизом расплавов их хлоридов или термическим восстановлением их соединений:
BeF2
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + Al2O3
3BaO + 2Al = 3Ba + Al2O3
Слайд 211 ФИЗИЧЕСКИЕ СВОЙСТВА
Бериллий, магний, кальций, барий и радий - металлы серебристо-белого
Слайд 212ХАРАКТЕРИСТИКА МЕТАЛЛОВ ГЛАВНОЙ ПОДГРУППЫ II ГРУППЫ
Атомы этих элементов имеют на внешнем
В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
Слайд 213Мел, известняк, мрамор не растворяются в чистой воде, но растворимы в
При просачивании воды с поверхности земли через залежи
известняка происходят
процессы:
Если порода залегает под тонким слоем почвы – образуются провалы;
Слайд 214Кальций в природе
Кальциевые горные породы – известняк, мрамор, мел.
Вспомните
В чем их отличие?
Слайд 217Сера - химический элемент
Каков химический знак?
В какой группе периодической системы находится?
В
Какой атомный номер?
Какая относительная атомная масса?
Сколько электронов в атоме? Как располагаются электроны на АО?
Какая электронная формула серы?
Какие низшая (в соединениях с водородом и металлами) и высшая (в соединении с кислородом) валентности серы?
Слайд 218План характеристики элемента:
1. Символ и название.
2. Положение в ПСХЭ.
3. Строение атома.
4.
5. Структурная конфигурация.
6. Формула и характер высшего оксида.
7. Формула водородного соединения.







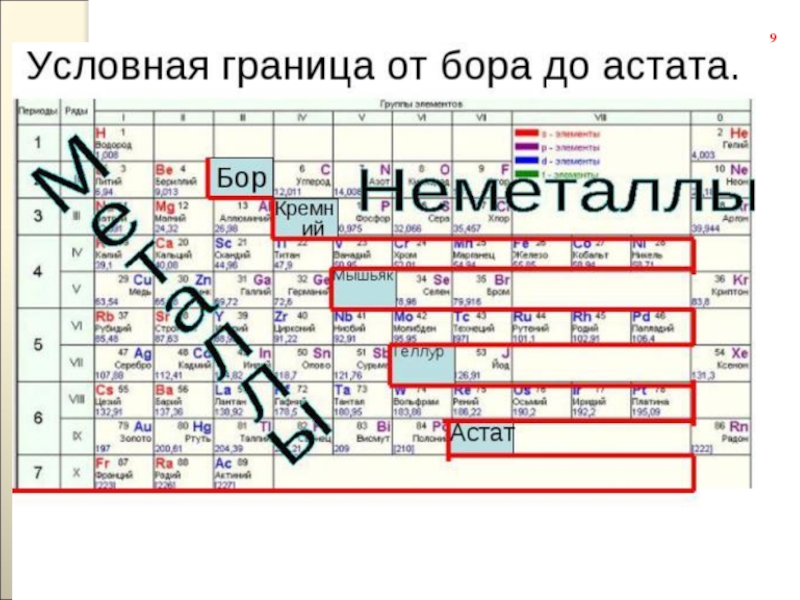
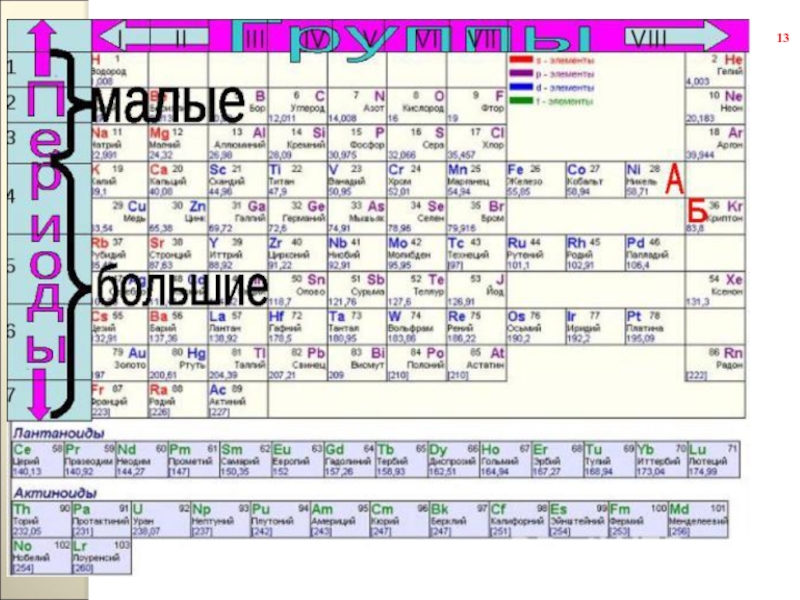








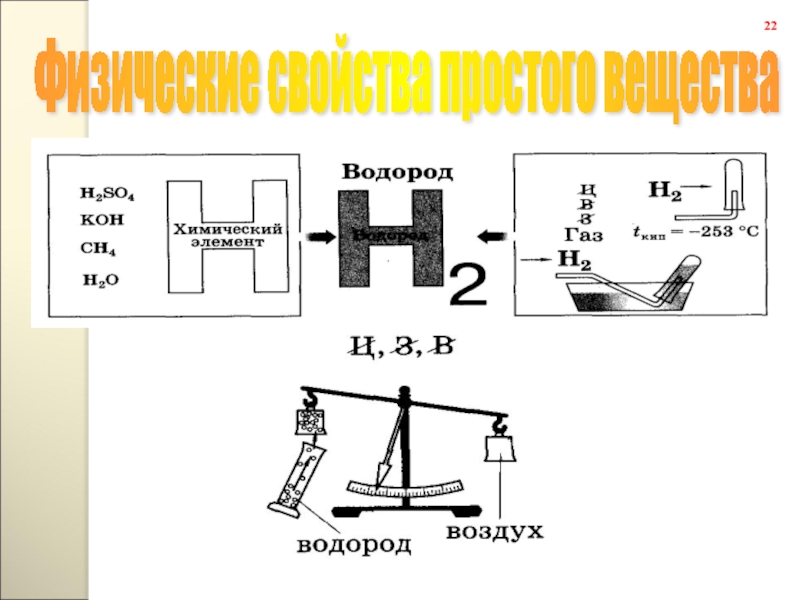

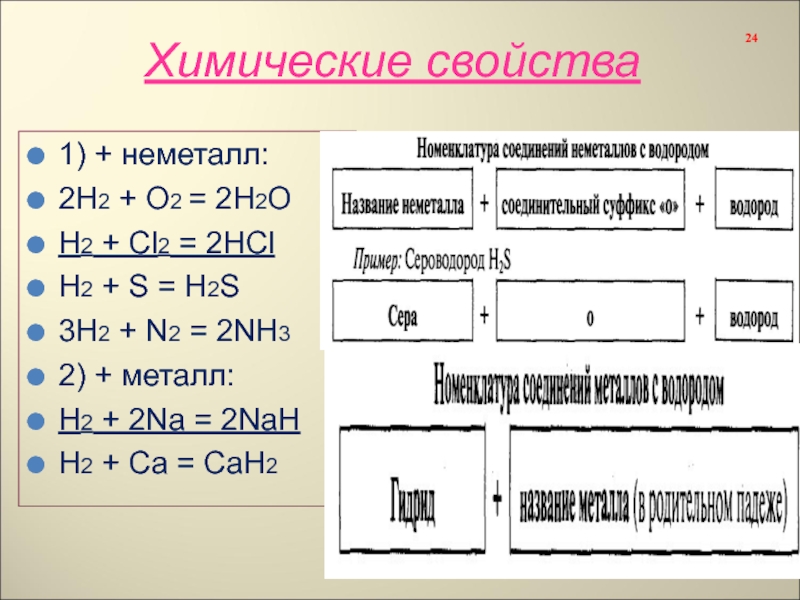















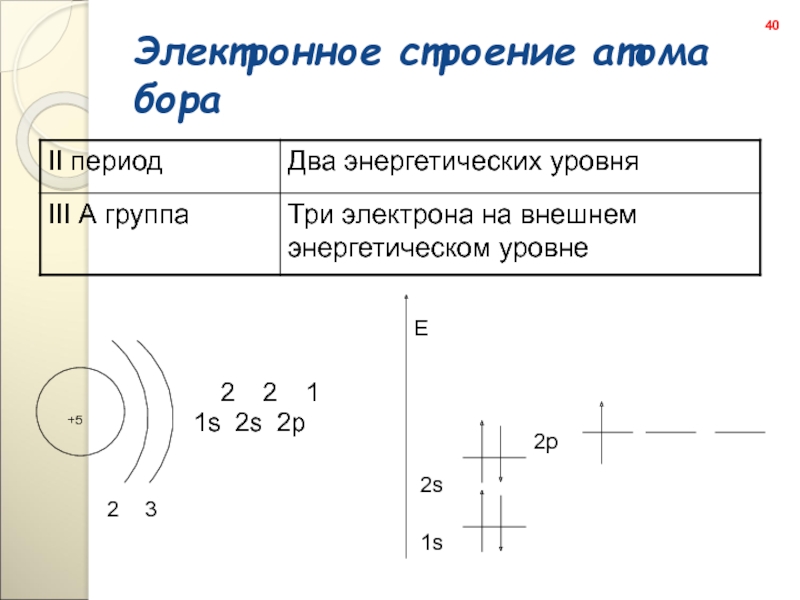








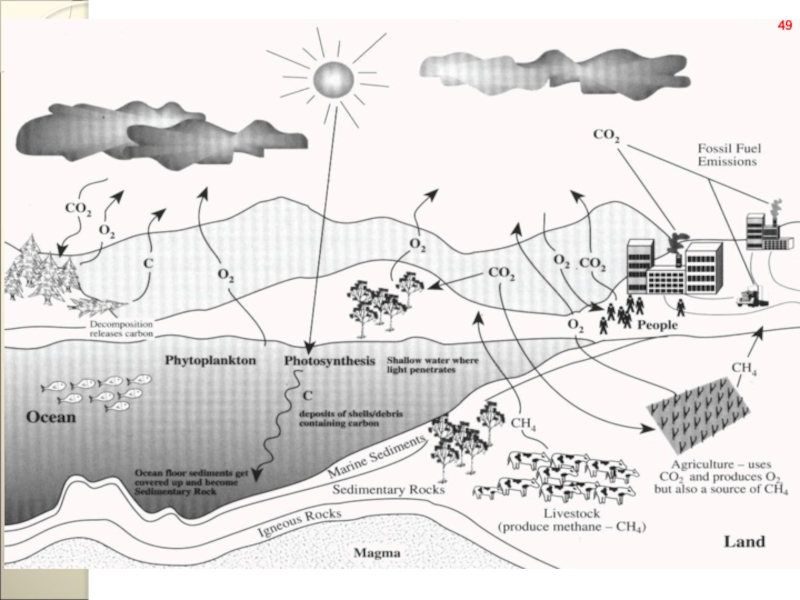
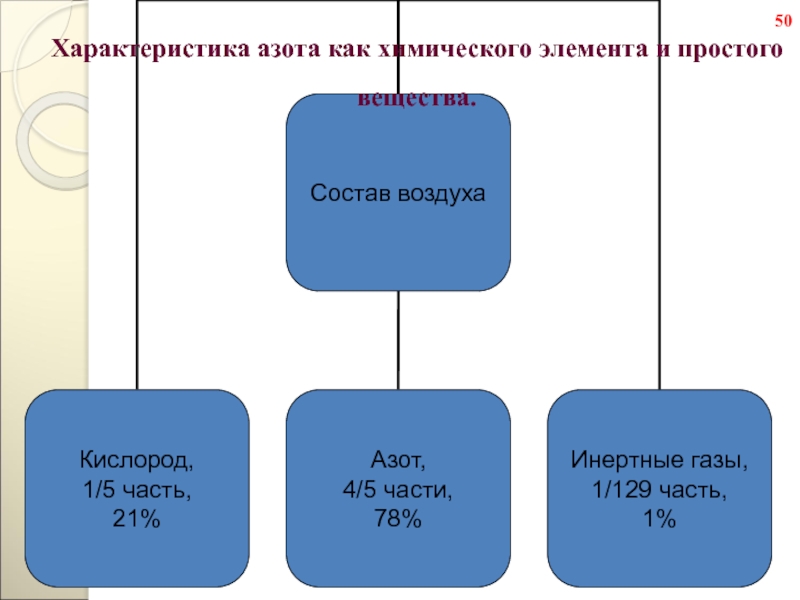
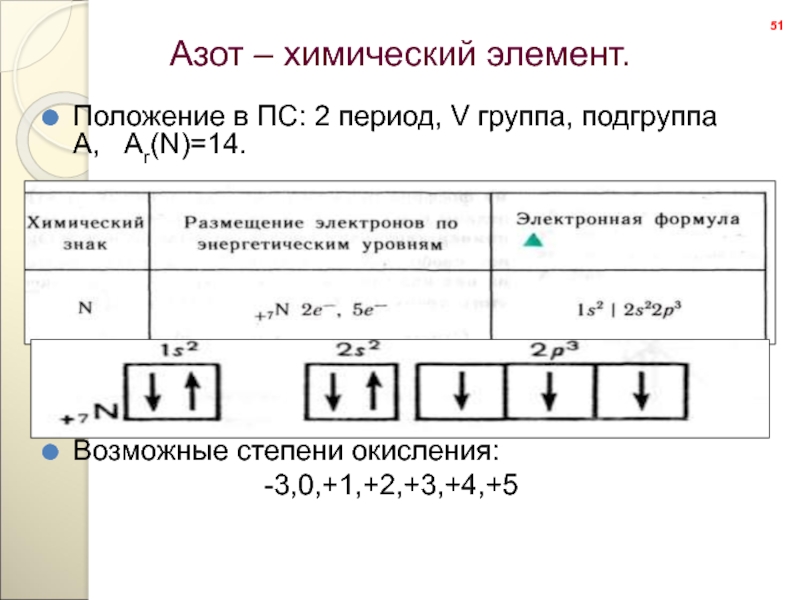
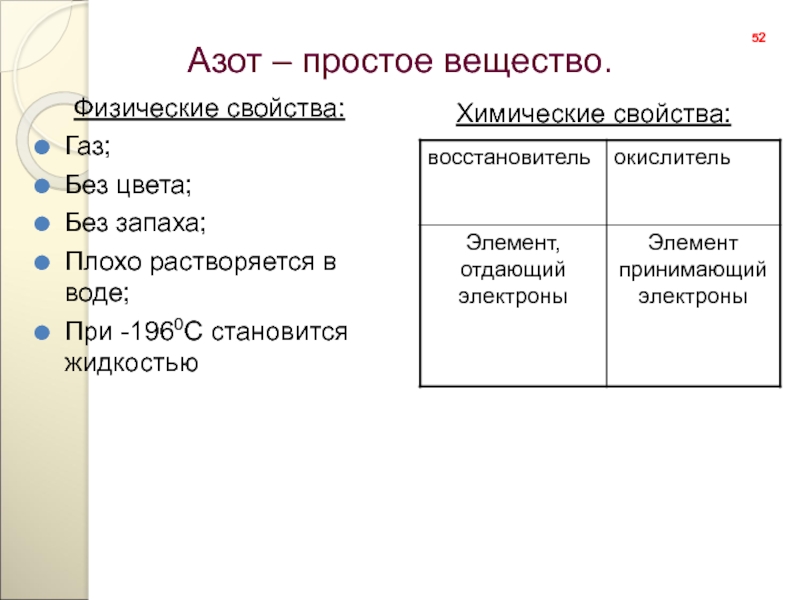

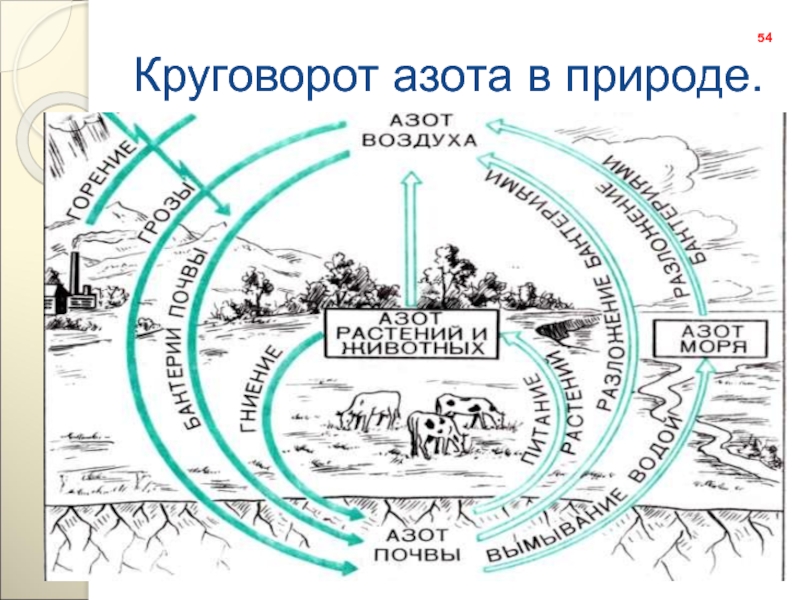
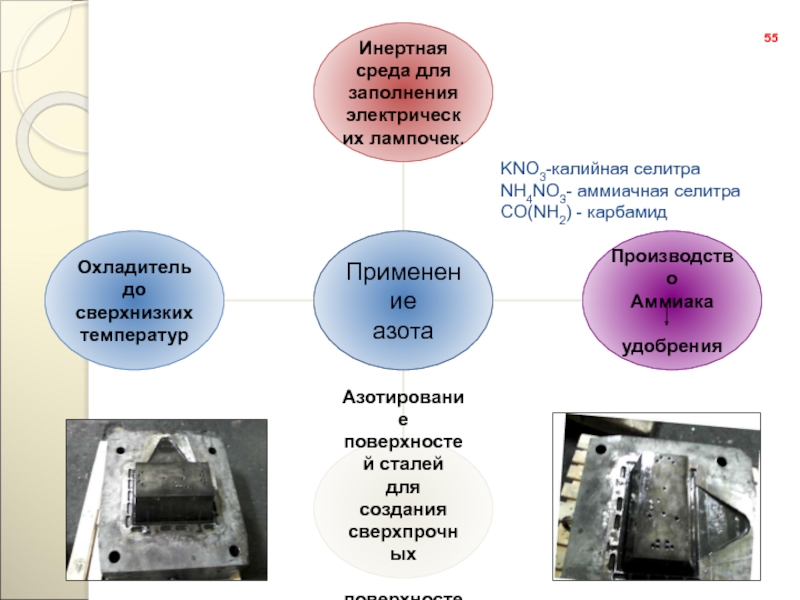


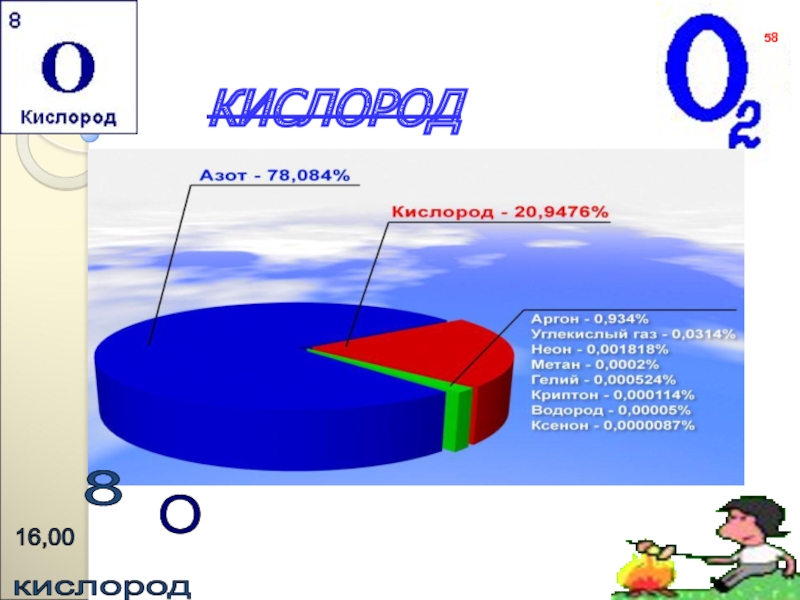


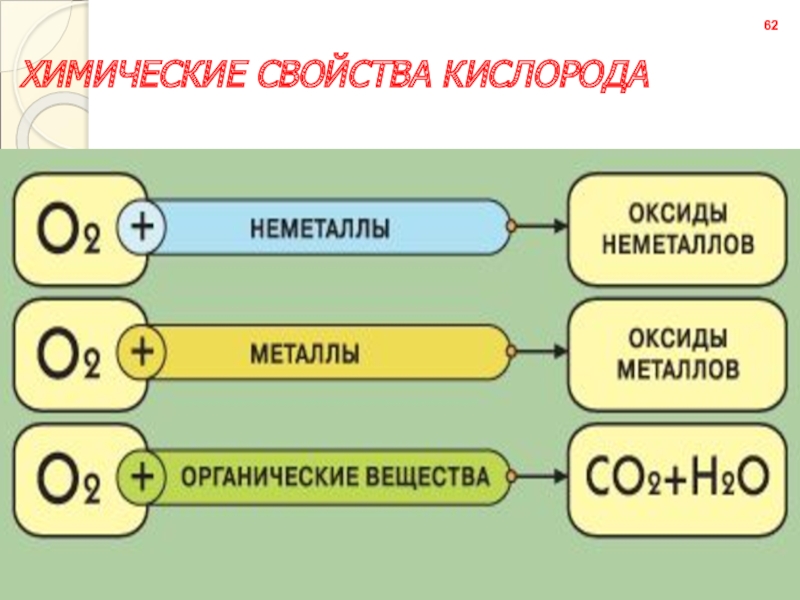

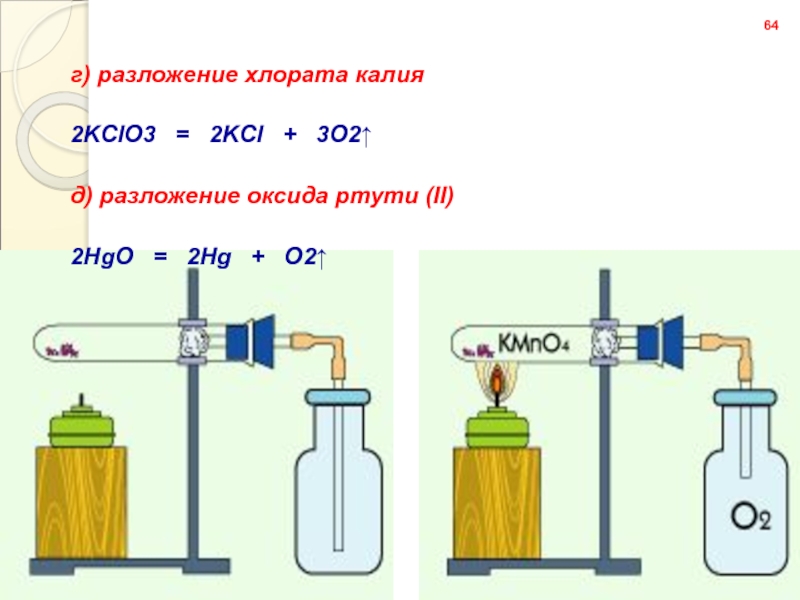






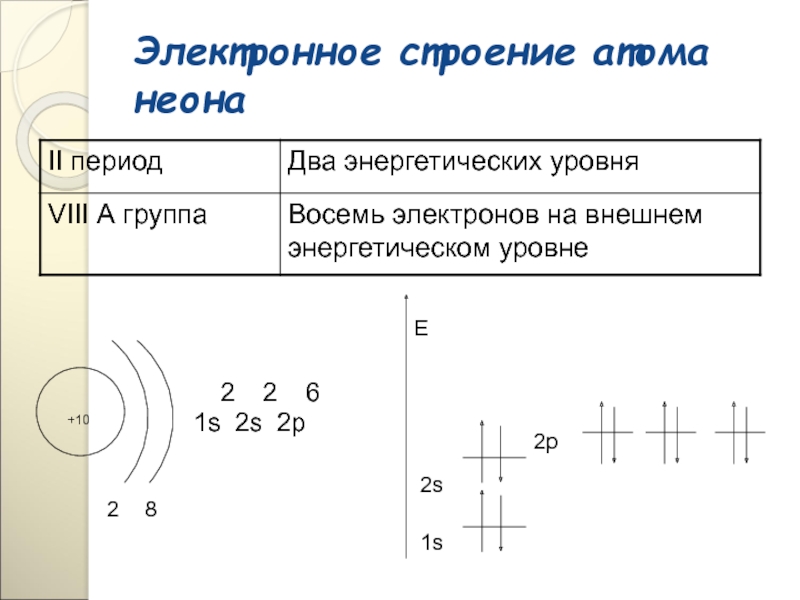



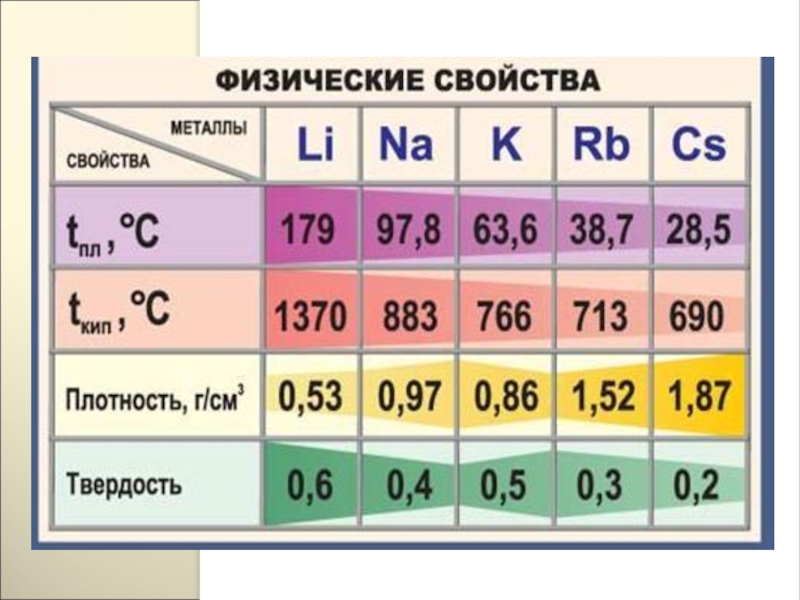
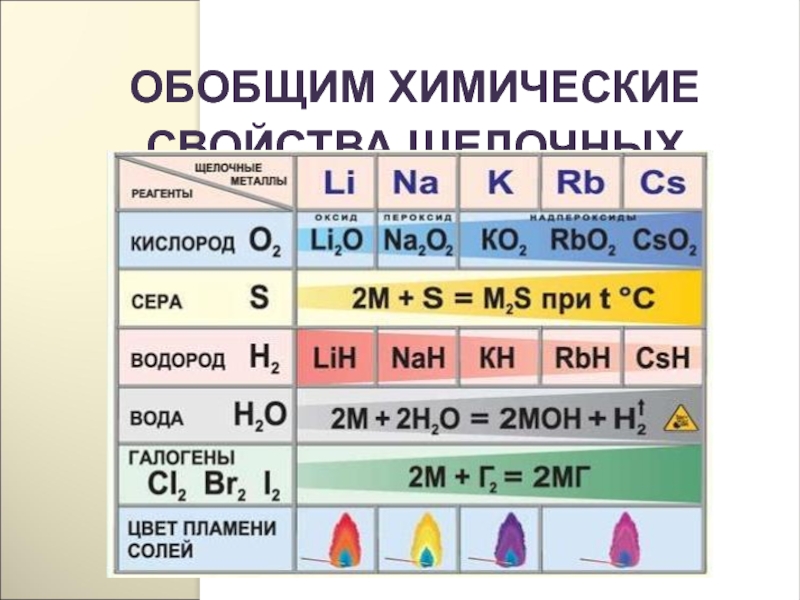

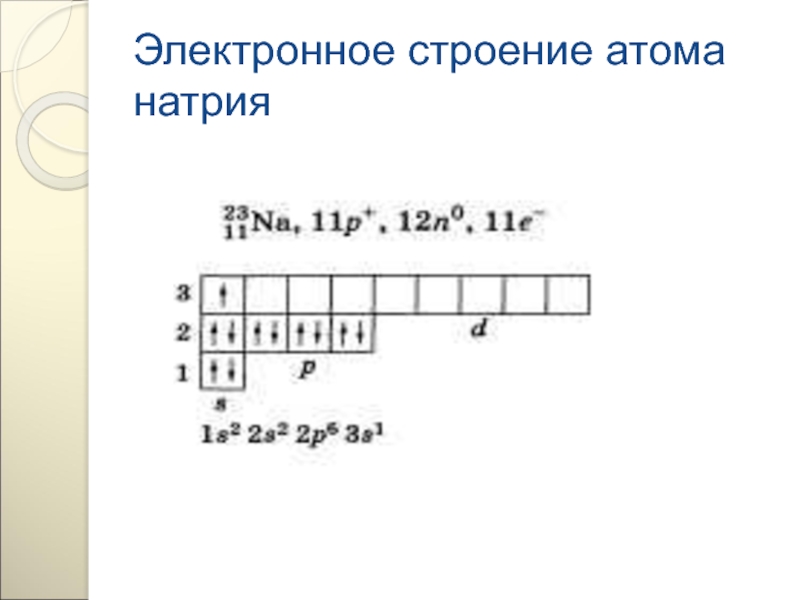






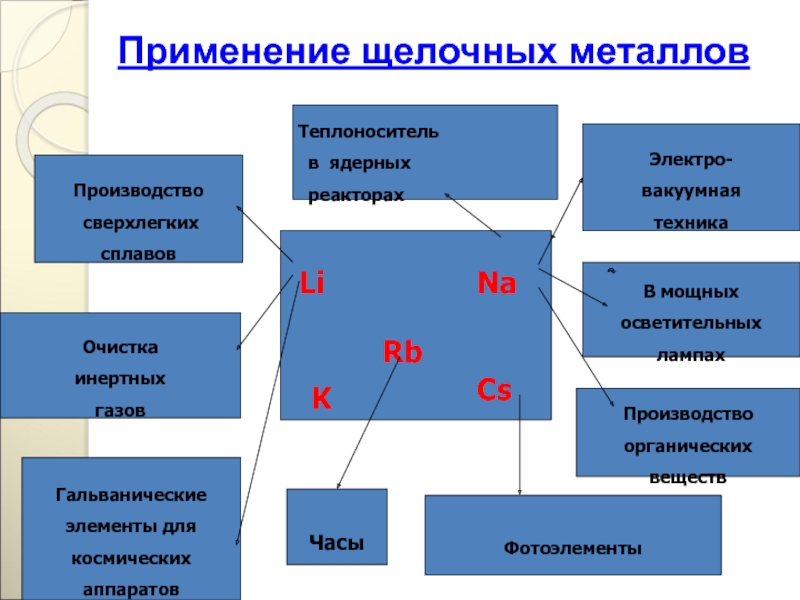















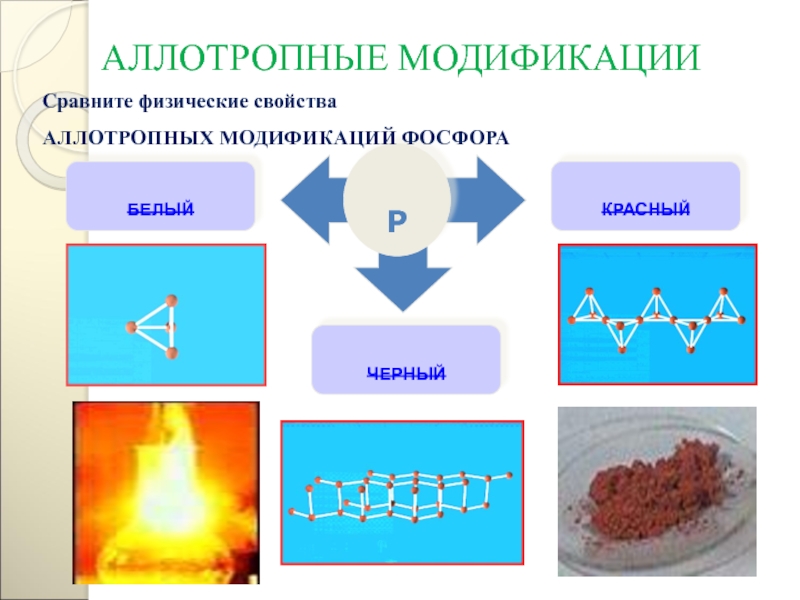
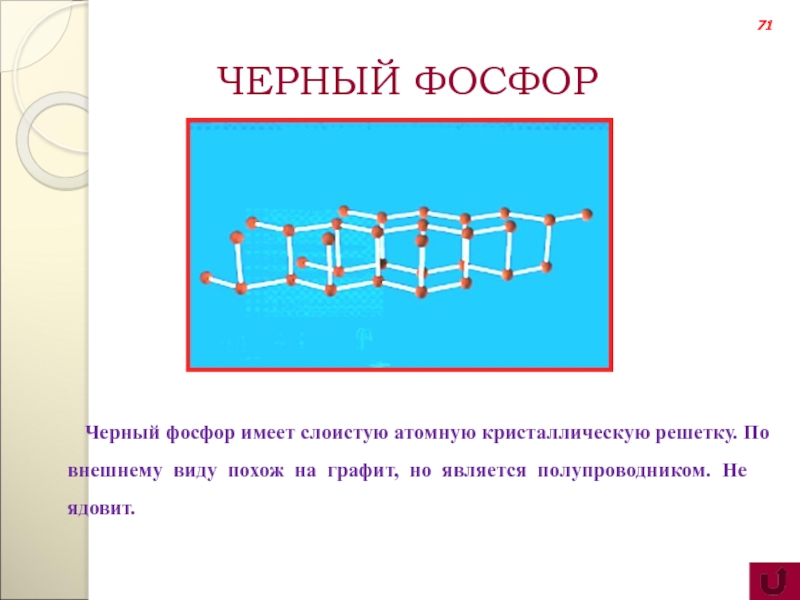




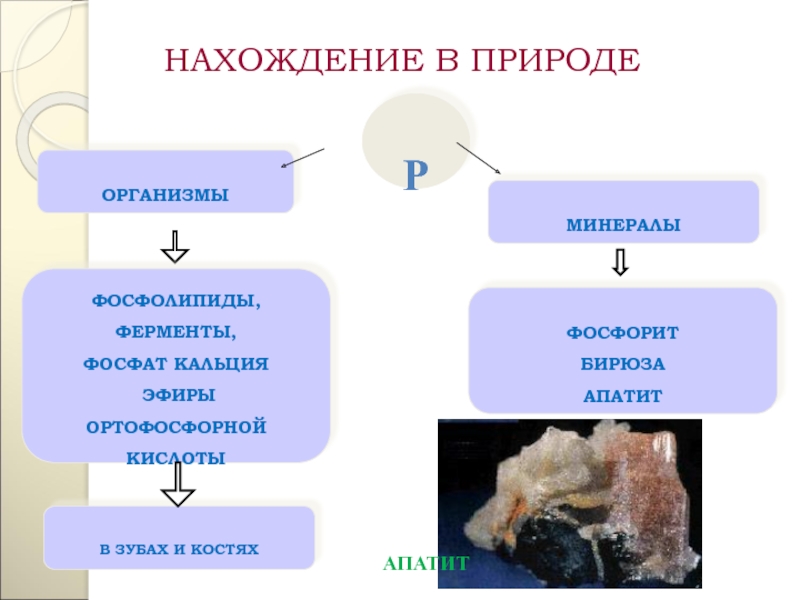
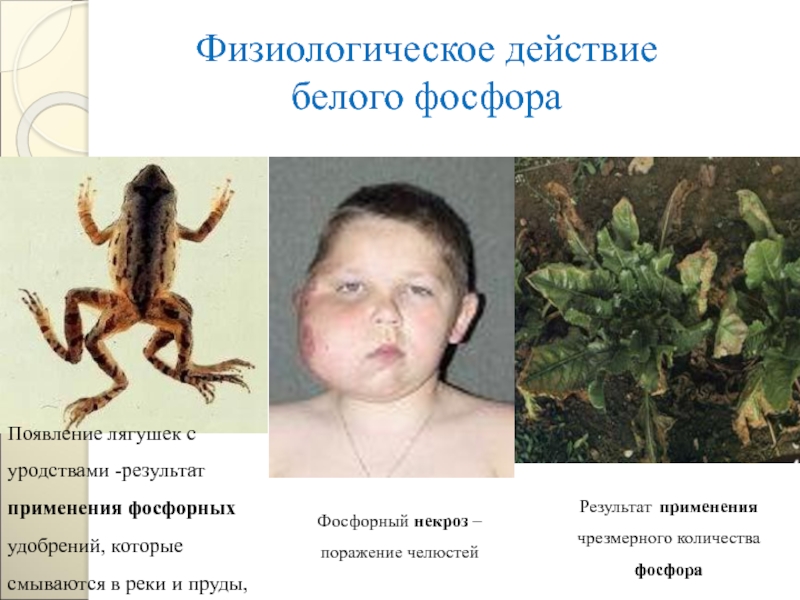

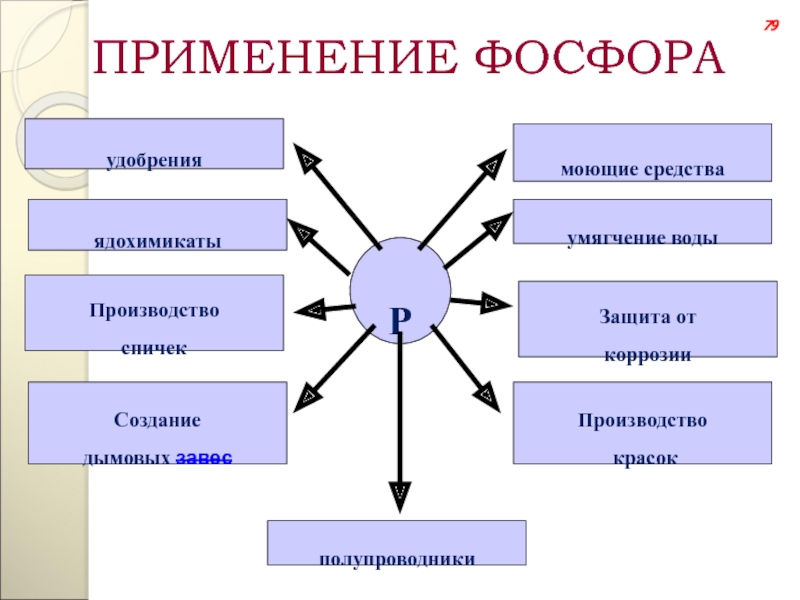
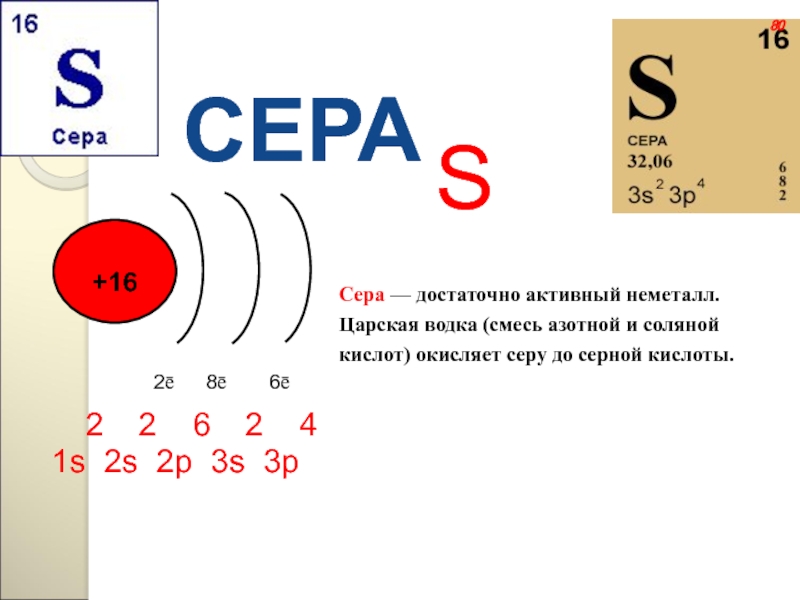


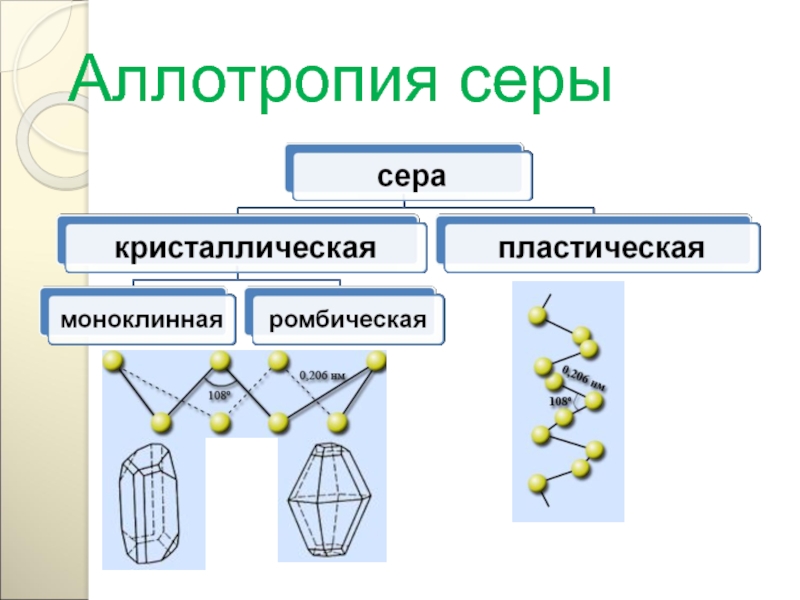
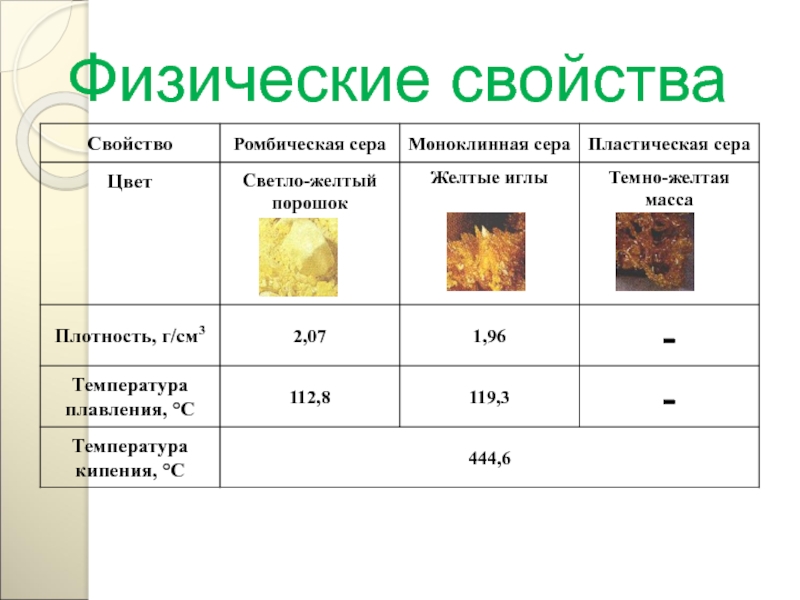



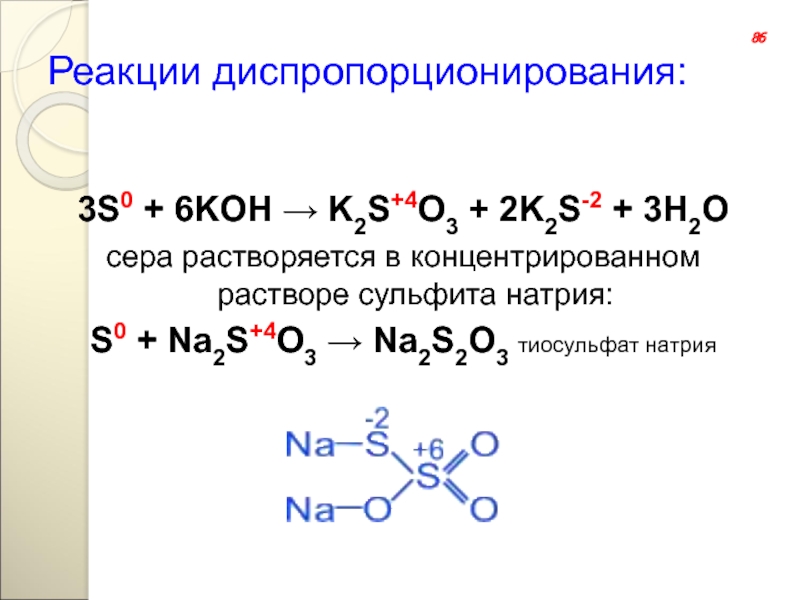





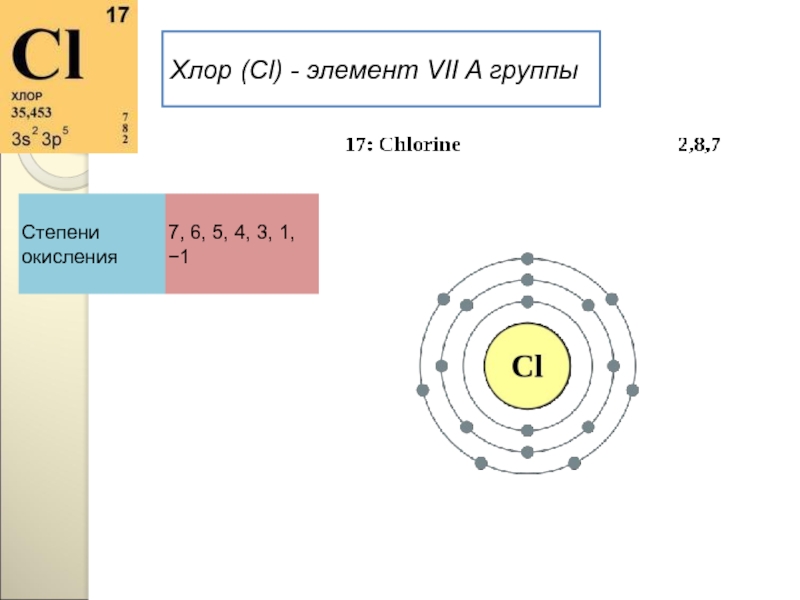



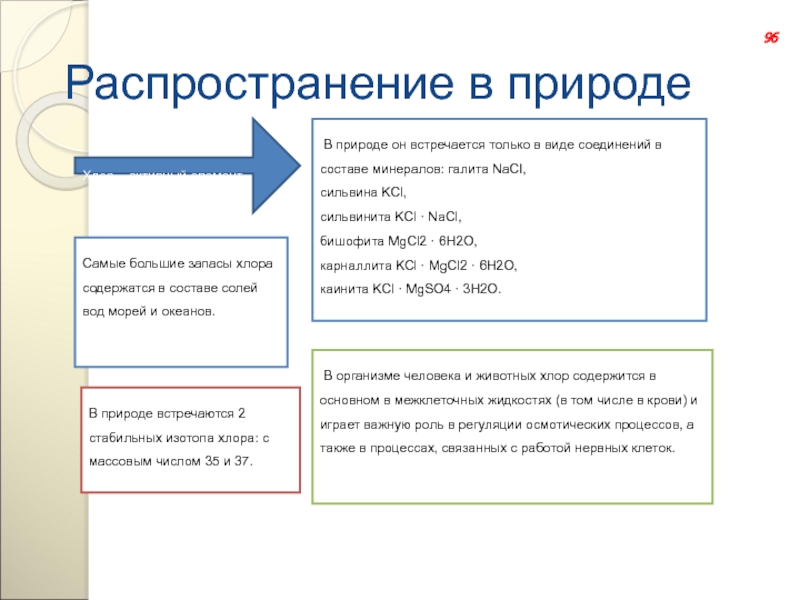
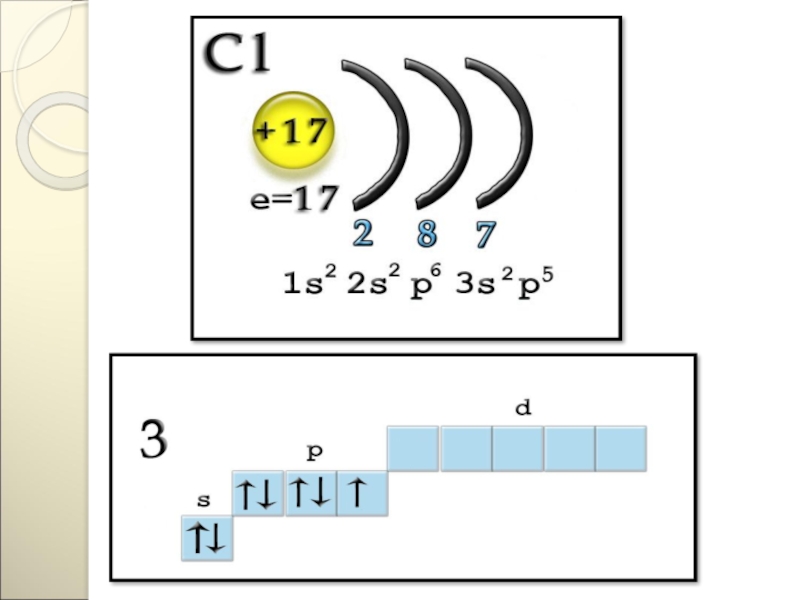
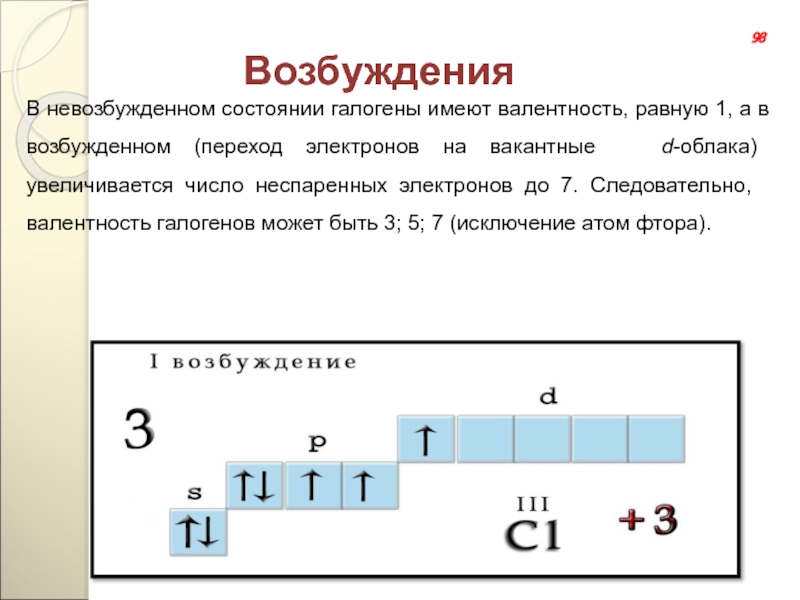
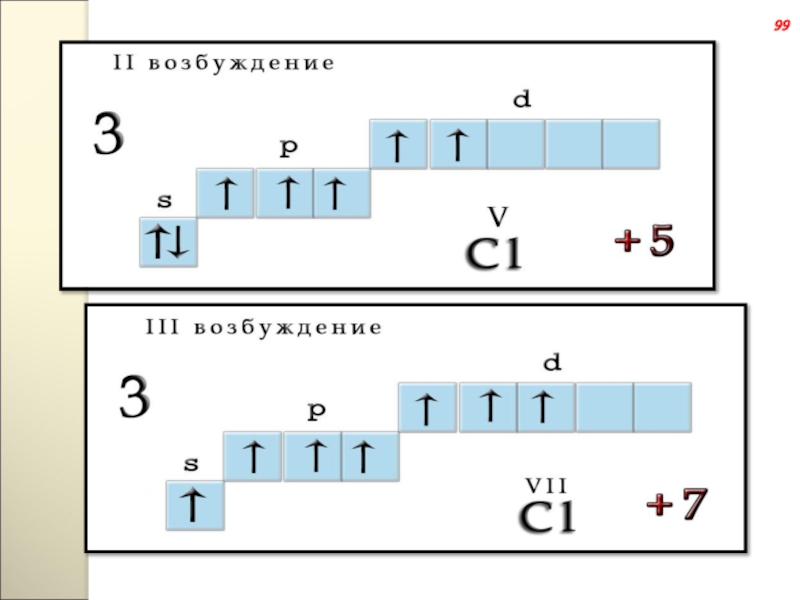
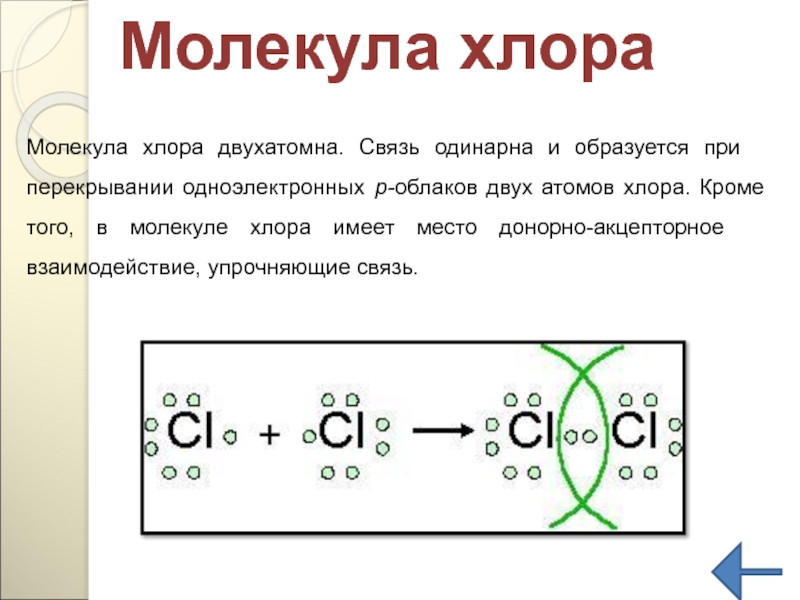






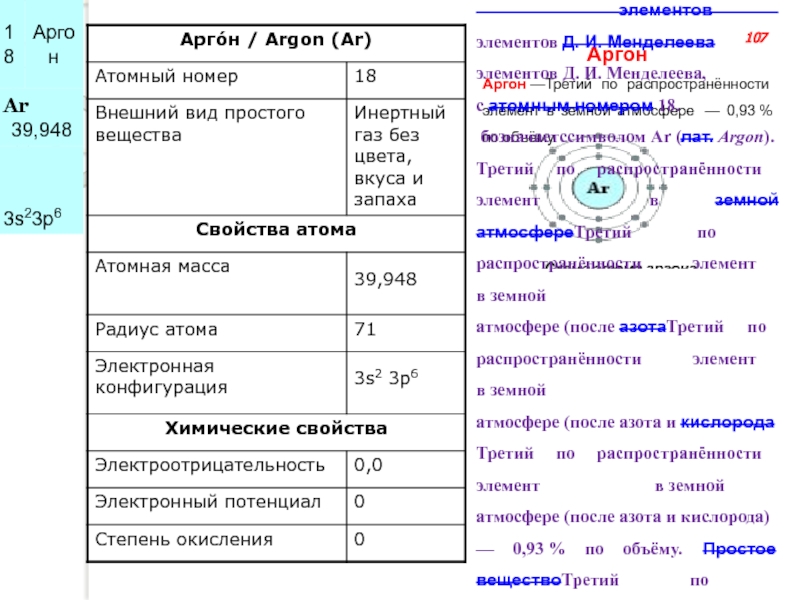
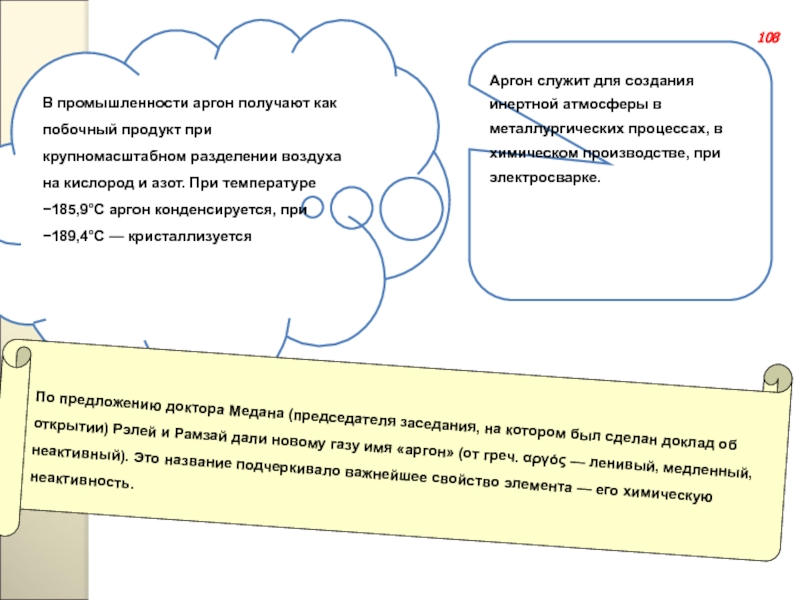

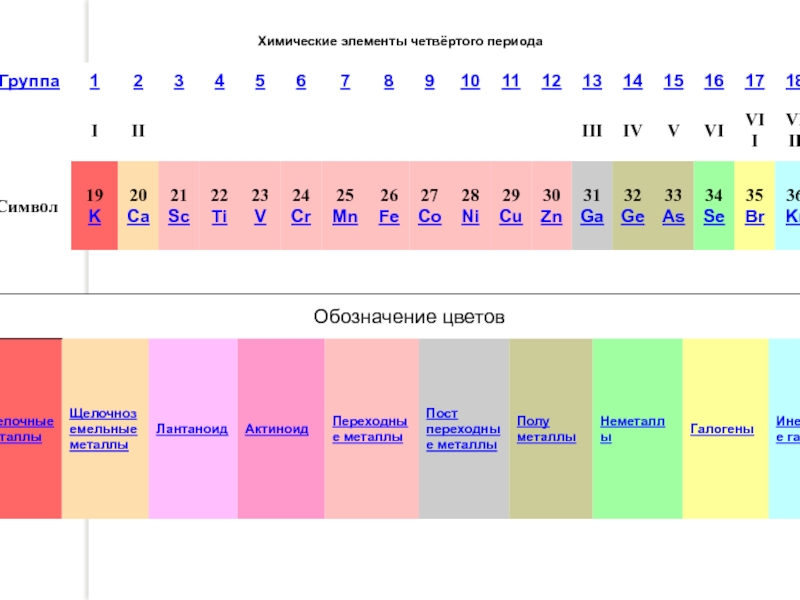

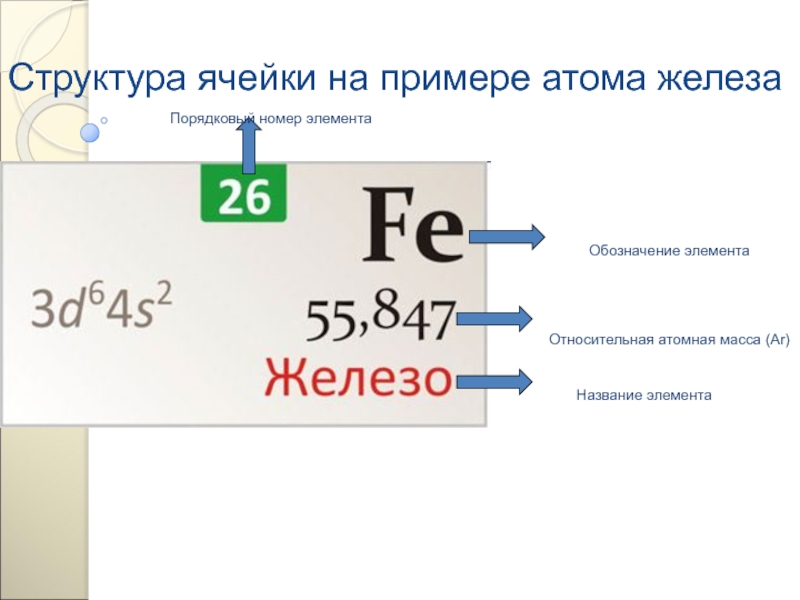







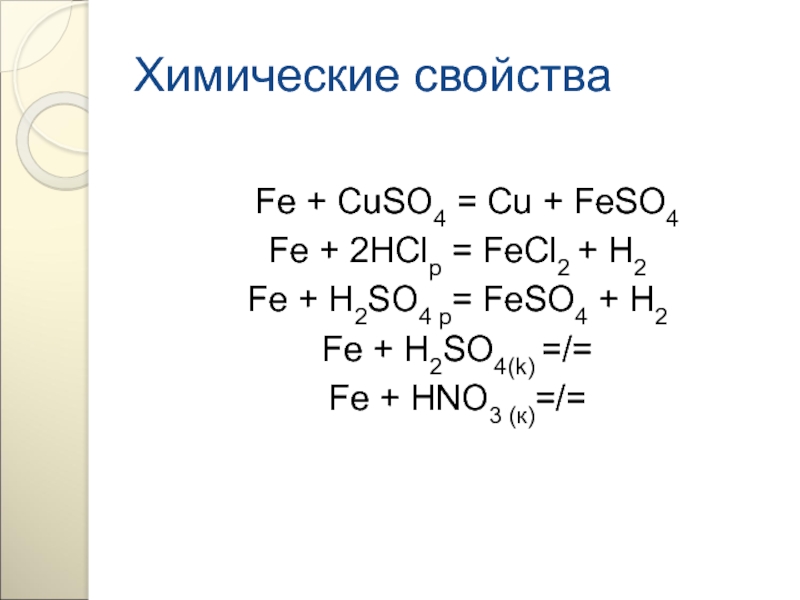
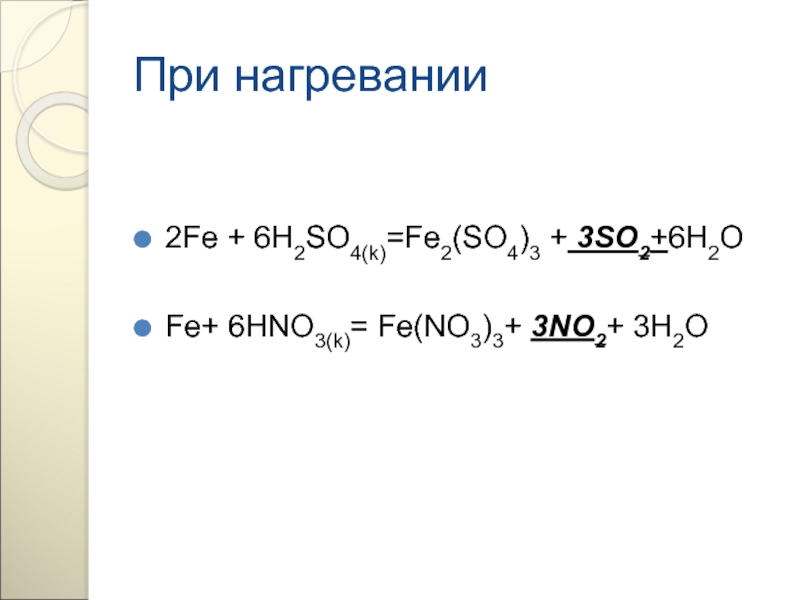
![Презентация музыкально-литературного мероприятия Парад химических элементов Качественные реакции на ионы Fe2+ и Fe3+. FeSO4 + K3 [Fe(CN)6 Качественные реакции на ионы Fe2+ и Fe3+. FeSO4 + K3 [Fe(CN)6 ] =](/img/thumbs/453523a3eec24cd4b58af38185658adb-800x.jpg)



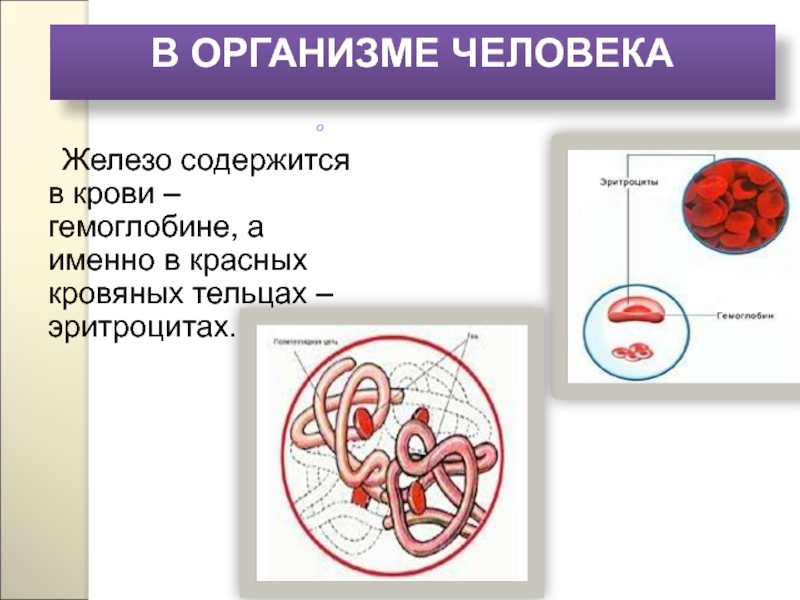



















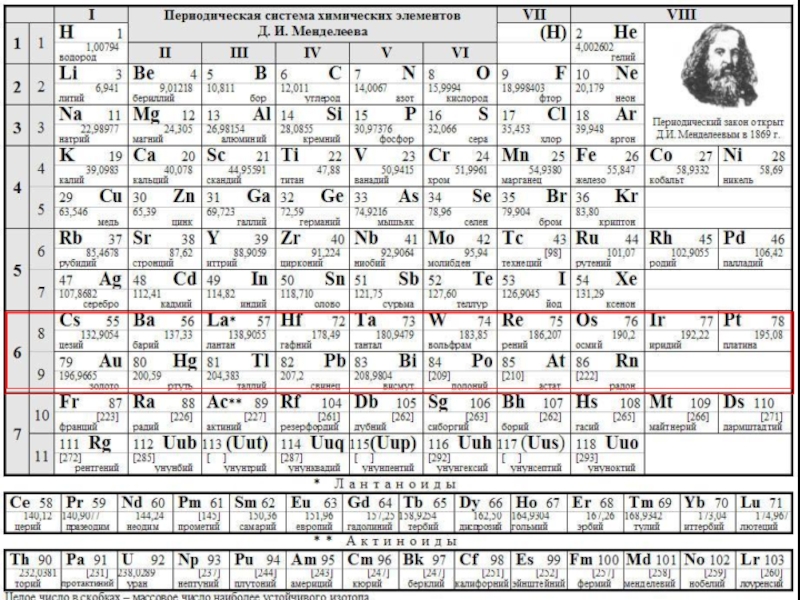


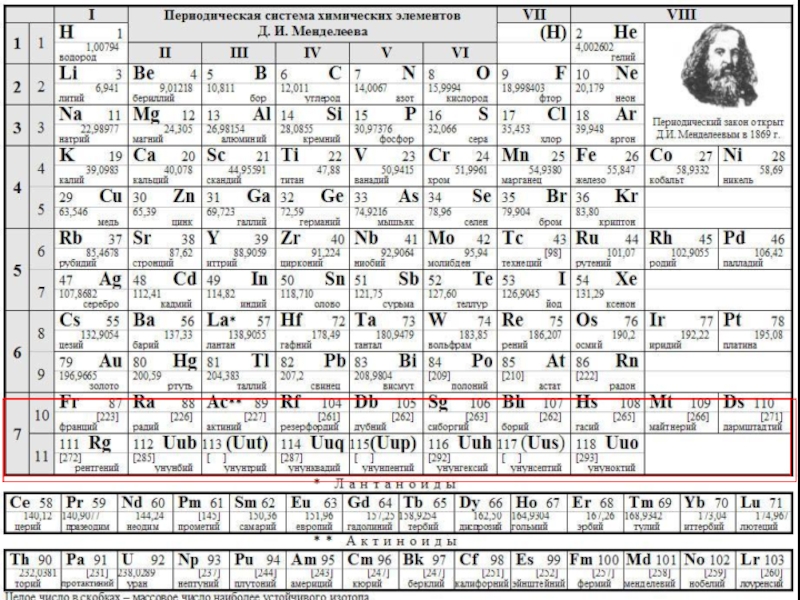








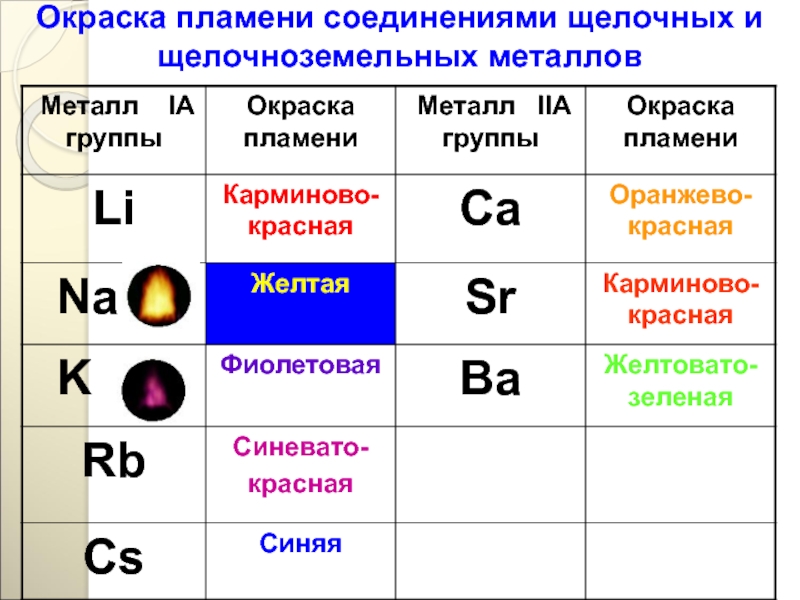












![Презентация музыкально-литературного мероприятия Парад химических элементов АЛЮМИНИЙ13Al [Ne] 3s23p1 Алюминий находится в главной п/группе III группы периодической АЛЮМИНИЙ13Al [Ne] 3s23p1 Алюминий находится в главной п/группе III группы периодической системы. На внешнем энергетическом уровне](/img/thumbs/fc4a15f9d898ace6393d50d04f9b4bd8-800x.jpg)