- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад лекции по химии на тему Металлы и их свойства
Содержание
- 1. Презентация лекции по химии на тему Металлы и их свойства
- 2. Формирование представлений о металлахЦельЗадачи: Выяснить расположение
- 3. ПЛАН Положение металлов в периодической системе Д.И.
- 4. ИСТОРИЯ ИЗУЧЕНИЯ МЕТАЛЛОВВ древности и в средние
- 5. Периодическая система Д. И. Менделеева
- 6. Если в периодической системе элементов Д. И.
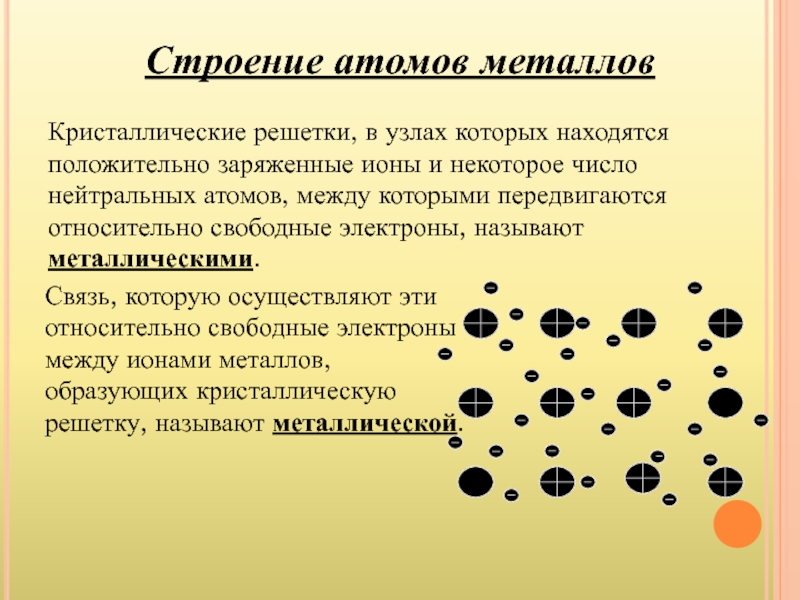
- 7. Кристаллические решетки, в узлах которых находятся положительно
- 8. У атомов металлов на наружном энергетическом уровне
- 9. Металлы главных подгрупп на внешнем уровне
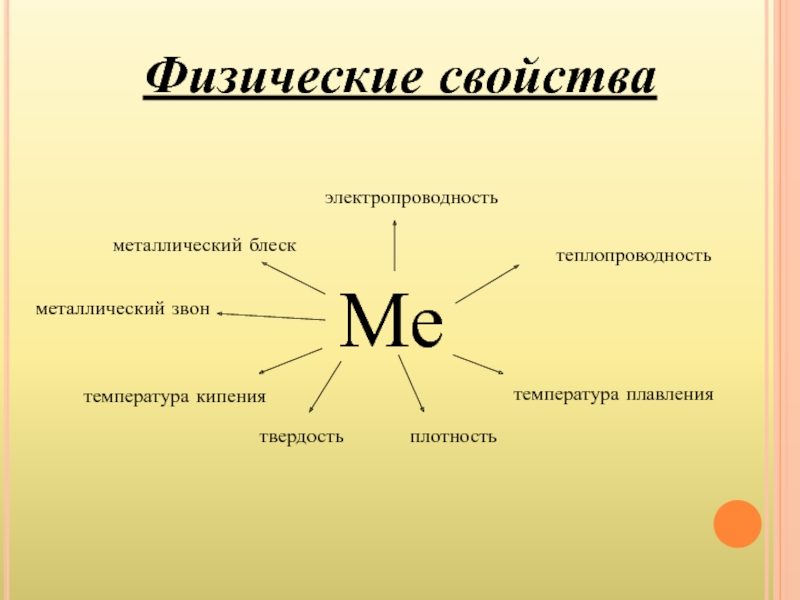
- 10. Физические свойства
- 11. 1) Для всех металлов характерен металлический блеск,
- 12. 3) В большинстве случаев при обычных условиях
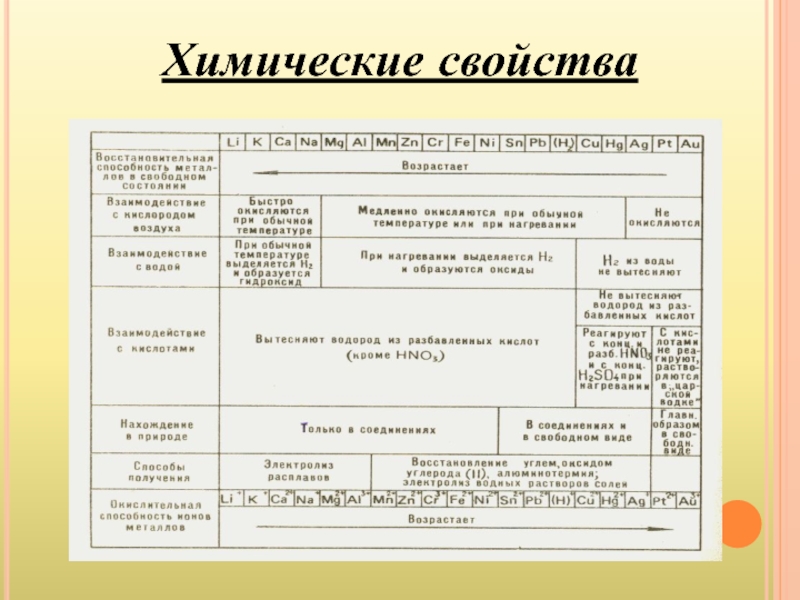
- 13. Химические свойства
- 14. Наиболее энергично металлы реагируют с простыми веществами
- 15. Металлы в природеСамым распространенным Металлом в земной
- 16. Наиболее активные Металлы получают электролизом. Менее активные
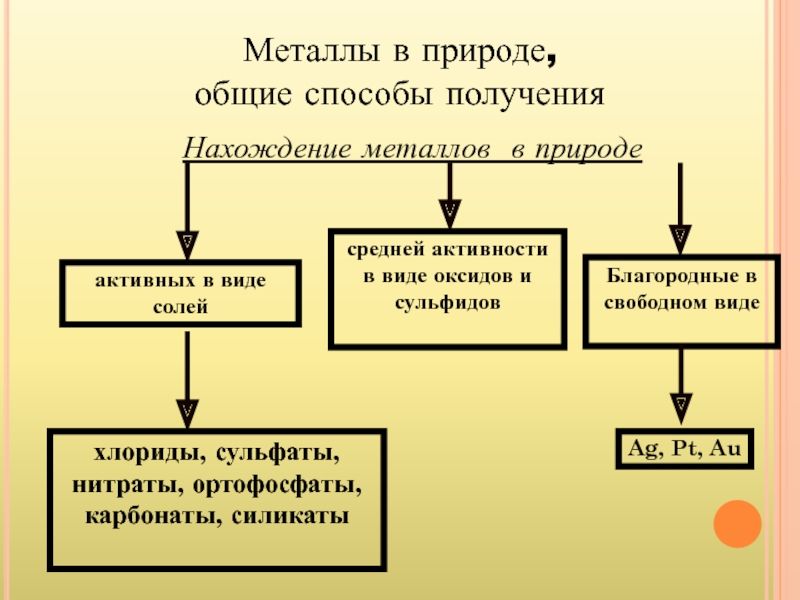
- 17. Металлы в природе, общие способы получения
- 18. Информационные ресурсы: http://www.proshkolu.ru Учебник химия О. С. Габриелян ; Г. Г. Лысова.
Слайд 1МБОУ «Первомайская средняя общеобразовательная школа»
Лекция «Металлы и их свойства»
Автор:
Дегтярёва М. В.,
Слайд 2 Формирование представлений о металлах
Цель
Задачи:
Выяснить расположение металлов в периодической системе
Показать физические и химические свойства
Показать роль металлов в природе и жизни человека
Слайд 3ПЛАН
Положение металлов в периодической системе
Д.И. Менделеева.
Строение атомов металлов,
Физические свойства металлов.
Общие химические свойства.
Электрохимический ряд напряжений
Металлы в природе, общие способы их получения.
Слайд 4ИСТОРИЯ ИЗУЧЕНИЯ МЕТАЛЛОВ
В древности и в средние века были известны только
Солнце (золото)
Юпитер (олово)
Луна (серебро)
Марс (железо)
Меркурий (ртуть)
Сатурн (свинец)
Венера (медь)
Алхимики считали, что под влиянием лучей планет в недрах Земли рождаются эти металлы.
Слайд 6Если в периодической системе элементов Д. И. Менделеева провести диагональ от
Положение металлов в периодической
системе Д. И. Менделеева
Слайд 7Кристаллические решетки, в узлах которых находятся положительно заряженные ионы и некоторое
Связь, которую осуществляют эти относительно свободные электроны между ионами металлов, образующих кристаллическую решетку, называют металлической.
Строение атомов металлов
Слайд 8У атомов металлов на наружном энергетическом уровне обычно находится от одного
Слайд 9 Металлы главных подгрупп на внешнем уровне имеют 1-3 электрона (4
Металлы главных подгрупп завершают внешний уровень, отдавая электроны.
Металлы побочных подгрупп. Предвнешний уровень незавершенный, внешний уровень имеет 1-2 электрона; завершают внешний уровень, отдавая электроны, степень окисления: +1; +2; +3; (+4).
Все металлы - восстановители
Слайд 111) Для всех металлов характерен металлический блеск, обычно серый цвет и
2) Тот факт, что металлы обладают хорошей электрической проводимостью, объясняется присутствием в них свободных электронов, которые под влиянием даже небольшой разности потенциалов приобретают направленное движение от отрицательного полюса к положительному.
С повышением температуры увеличивается колебания атомов (ионов), что затрудняет направленное движение электронов и тем самым приводит к уменьшению электрической проводимости. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость резко возрастает. Наибольшей электрической проводимостью обладает серебро и медь. За ними следуют золото, алюминий, железо. Наряду с медными изготавливаются и алюминиевые провода.
Электрический ток – это упорядоченное (направленное) движение заряженных частиц.
Слайд 123) В большинстве случаев при обычных условиях теплопроводность металлов изменяется в
4) Механическое воздействие на кристалл с ковалентной связью вызывает смещение отдельных слоев атомов, в результате чего связи разрываются
и кристалл разрушается. Такое же воздействие на кристалл с металлической связью вызывает смещение слоев атомов, однако, благодаря перемещению электронов по всему кристаллу, разрыв связей не происходит. Для металлов характерна высокая пластичность. Она уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe. Золото, например, можно прокатывать в листы толщиной не более 0,003 мм, которые используются для позолоты различных предметов.
5) Различна плотность металлов. Она тем меньше, чем меньше атомная масса элемента-металла и чем больше радиус его атома. Самый легкий из металлов – литий (плотность = 0,53 г/см³ ), самый тяжелый – осмий (плотность = 22,6 г/см³). Металлы с плотностью меньше 5 г/см³ – легкие, остальные – тяжелые.
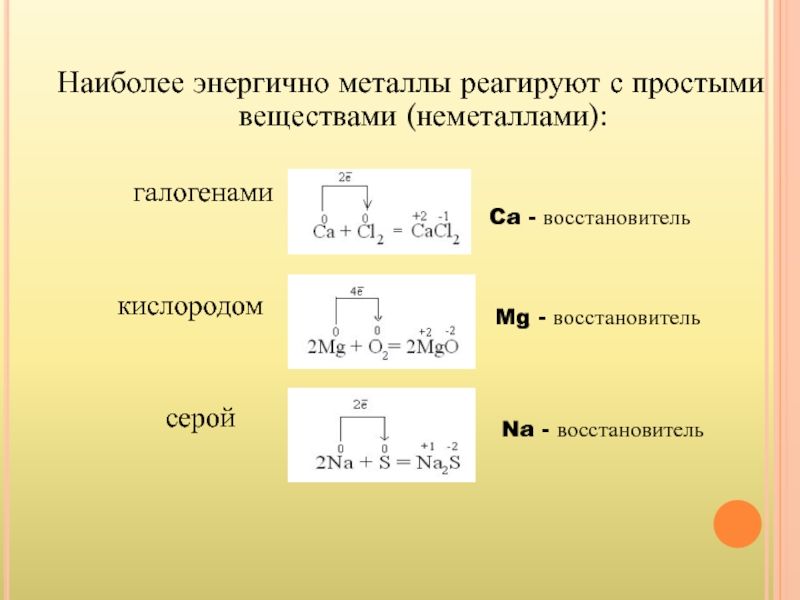
Слайд 14Наиболее энергично металлы реагируют с простыми веществами (неметаллами):
кислородом
серой
Ca - восстановитель
Mg - восстановитель
Na - восстановитель
Слайд 15Металлы в природе
Самым распространенным Металлом в земной коре является алюминий. За
Самородок платины
Самородок серебра
Нефелин
Слайд 16Наиболее активные Металлы получают электролизом. Менее активные Металлы восстанавливают из их
1. Восстановление металлов из их оксидов углем или оксидом углерода:
2. Обжиг сульфидов металлов с последующим восстановлением образовавшихся оксидов:
3. Восстановление металлов из их оксидов более активными металлами: