- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Кремний и его соединения
Содержание
- 1. Презентация Кремний и его соединения
- 2. Проверка Д.З. 1. Какие аллотропные видоизменения углерода вам
- 3. Задания ГИАЗадание № 1. Число электронов во
- 4. 3 этап – ЭкспериментальныйКакой-то проказник проник в школьную
- 5. 4 этап Практический 1 кадетCaO + CO2
- 6. Представьте себе - встает человек утром с
- 7. Представь, сидят в пещере два первобытных
- 8. Кремний и его соединенияЭпиграф«Кремний в мироздании вырисовывается
- 9. А что еще нам необходимо будет узнать??Почему
- 10. Фронтальная работа в рабочих тетрадях1. Вспомним характеристику
- 11. 3. Физические свойства кремния (работа с учебником)
- 12. Кристаллический кремнийАллотропные модификацииАморфный кремний- бурый порошок, диэлектриктёмно-серого
- 13. 4. Химические свойства кремния:
- 14. Название этого элемента произошло от латинского “ляпис
- 15. 5. Способы получения Лабораторный способ:
- 16. аметистГорный хрусталькременьониксхалцедонSiO2SiO2SiO2SiO2
- 17. Кварц SiO2
- 18. «Глазастые» кварцы Тигровый
- 19. Природные силикаты
- 20. Химические свойства SiO2Кислотный оксидА) со щелочами: SiO2
- 21. Кремниевая кислота H2SiO3Способ получения:Na2SiO3 + HCl SiO32- + 2H+ H2SiO3H2SiO3
- 22. Применение
- 23. Каковы компоненты, используемые для изготовления обычного стекла?
- 24. Из расплавленной стеклянной массы можно изготовить изделие
- 25. Витражи- заранее нарезанные и хорошо подогнанные друг
- 26. Стекло пока незаменимо для изготовления большого количества
- 27. Использование стекла в оптических приборах
- 28. Асбест- изготовление огнеупорной ткани
- 29. Бронебойное стекло
- 30. СИТАЛЛ – материал современнойлазерной оптики.СИТАЛЛ применяется в
- 31. SiO2 + Na2CO3 = Na2SiO3 + CO2SiO2 + CaCO3 = CaSiO3 + CO2Na2SiO3 + CaSiO3 + 4SiO2 = Na2O*CaO*6SiO2Химизм процесса производства стекла
- 32. Слайд 32
- 33. керамическиеизделия
- 34. Применение цемента
- 35. Фаянс
- 36. Слайд 36
- 37. Смогли бы мы сейчас без этого обойтись?
- 38. Если исчезнет кремний
- 39. Рефлексия– Что нового узнали на уроке? – Решили ли мы проблемную задачу? – Что вызвало затруднения?
- 40. п 34Решите цепочку превращения задание 4 стр. 258Спасибо за урок!
Проверка Д.З. 1. Какие аллотропные видоизменения углерода вам известны?2. Как объяснить свойства аллотропных видоизменений?3. Где находят применение алмаз, графит, уголь?4. Какие оксиды углерода вам известны?5. Где используют угарный газ и углекислый газ?6. Как по свойствам отличаются СО
Слайд 2Проверка Д.З.
1. Какие аллотропные видоизменения углерода вам известны?
2. Как объяснить свойства
аллотропных видоизменений?
3. Где находят применение алмаз, графит, уголь?
4. Какие оксиды углерода вам известны?
5. Где используют угарный газ и углекислый газ?
6. Как по свойствам отличаются СО и СО2?
7. Какие вещества обуславливают жесткость воды?
3. Где находят применение алмаз, графит, уголь?
4. Какие оксиды углерода вам известны?
5. Где используют угарный газ и углекислый газ?
6. Как по свойствам отличаются СО и СО2?
7. Какие вещества обуславливают жесткость воды?
Слайд 3Задания ГИА
Задание № 1.
Число электронов во внешнем электронном слое атома
с зарядом ядра +6 равно:
1) 6 2) 3 3) 4 4) 2
Задание № 2
Кислотным оксидом является:
1) CO2 2)Al2 O3 3) Na 2O 4) NO
Задание № 3
Оксид углерода (IV) взаимодействует с
1) NaCl 2) P2 O5 3) Ca(OH)2 4) HNO3
Задание № 4
В ряду химических элементов Ge – Si – C
увеличиваются радиусы атомов
увеличивается электроотрицательность
усиливаются кислотные свойства их высших оксидов
возрастает значение высшей степени окисления
увеличивается число электронов во внешнем электронном слое атомов
1) 6 2) 3 3) 4 4) 2
Задание № 2
Кислотным оксидом является:
1) CO2 2)Al2 O3 3) Na 2O 4) NO
Задание № 3
Оксид углерода (IV) взаимодействует с
1) NaCl 2) P2 O5 3) Ca(OH)2 4) HNO3
Задание № 4
В ряду химических элементов Ge – Si – C
увеличиваются радиусы атомов
увеличивается электроотрицательность
усиливаются кислотные свойства их высших оксидов
возрастает значение высшей степени окисления
увеличивается число электронов во внешнем электронном слое атомов
Слайд 43 этап – Экспериментальный
Какой-то проказник проник в школьную лабораторию и
оторвал все
этикетки с колб, а вам срочно понадобился раствор
карбоната натрия? Какую реакцию необходимо провести,
чтобы его распознать? Запишите уравнения реакций.
карбоната натрия? Какую реакцию необходимо провести,
чтобы его распознать? Запишите уравнения реакций.
Н2SO4
NaCl
Na2CO3
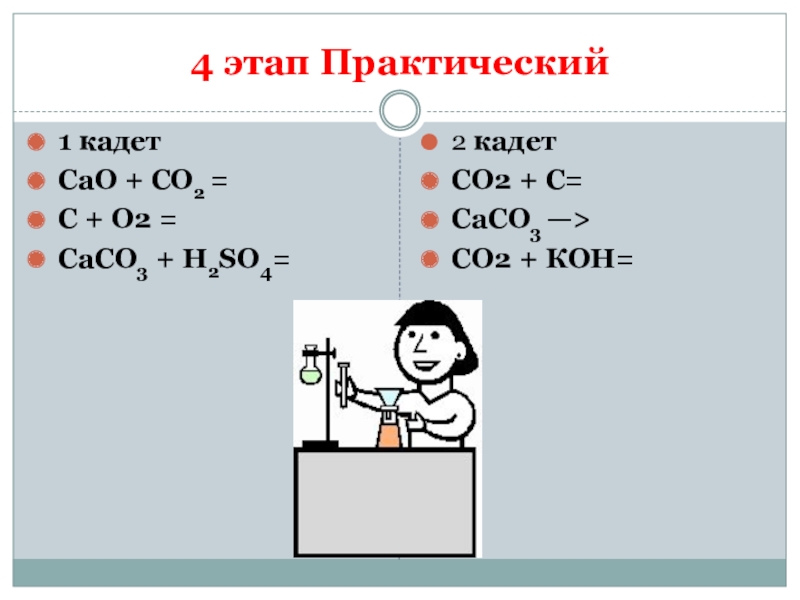
Слайд 54 этап Практический
1 кадет
CaO + CO2 =
С + О2 =
CaCO3 +
H2SO4=
2 кадет
СО2 + С=
CaCO3 —>
СО2 + КОН=
Слайд 6Представьте себе - встает человек утром с постели, подходит к зеркалу,
а вместо него - пустая рамка, ищет очки, а от них лишь одна оправа; вдруг он ощущает порывы ветра, так как в доме нет ни одного окна; от ужаса человек хочет выпить глоток воды, но не может найти ни одной чашки, стакана - вообще нет никакой в доме посуды - все бесследно исчезло! И это только начало ужаса:
Далее треск, грохот - рушатся потолок, стены, они летят и рассыпаются, превращаясь в пыль и песок: Параллельно с этим выделяется огромное количество кислорода, который меняет состав воздуха, то есть земной атмосферы!
А самое страшное, что в последствии почти целиком исчезает земная кора, испаряются океаны и не существует больше жизнь на Земле:
Что это за элемент и почему его исчезновение могло вызвать такие катастрофические изменения?
Далее треск, грохот - рушатся потолок, стены, они летят и рассыпаются, превращаясь в пыль и песок: Параллельно с этим выделяется огромное количество кислорода, который меняет состав воздуха, то есть земной атмосферы!
А самое страшное, что в последствии почти целиком исчезает земная кора, испаряются океаны и не существует больше жизнь на Земле:
Что это за элемент и почему его исчезновение могло вызвать такие катастрофические изменения?
???
Слайд 7 Представь, сидят в пещере два первобытных человека, им холодно, они
не смогли сохранить огонь после удара молнии… Как быть? Один из них берет два камня и бьет ими друг о друга, сыплются искры, начинает тлеть сухой мох, вспыхивает спасительный огонь! Другой соплеменник привязывает к палке камень и идет на охоту, а затем на костре они приготовят себе пищу…
Проблема
Si- действительно
ли так
необходим
для
нашей жизни?
Слайд 8Кремний и его соединения
Эпиграф
«Кремний в мироздании вырисовывается как элемент, обладающий исключительным
значением»
В.И. Вернадский.
Корзина идей:
Что вам уже известно про кремний?
В.И. Вернадский.
Корзина идей:
Что вам уже известно про кремний?
Слайд 9А что еще нам необходимо будет узнать?
?
Почему кремний называют основным элементом
неживой природы?
Почему физические свойства оксидов кремния и углерода резко отличаются друг друга?
Почему нельзя хранить плавиковую кислоту в стеклянной посуде?
Каковы физические свойства кристаллического и аморфного кремния?
Как получают кремний, кремниевую кислоту?
Как получают стекло
Почему физические свойства оксидов кремния и углерода резко отличаются друг друга?
Почему нельзя хранить плавиковую кислоту в стеклянной посуде?
Каковы физические свойства кристаллического и аморфного кремния?
Как получают кремний, кремниевую кислоту?
Как получают стекло
Слайд 10Фронтальная работа в рабочих тетрадях
1. Вспомним характеристику элемента по плану:
а)
Название химического элемента, его символ.
б) Относительная атомная масса.
в) Порядковый номер.
г) Заряд ядра атома.
д) Число протонов и нейтронов.
е) Общее число электронов.
ж) Номер периода.
з) Номер группы и подгруппа (главная или побочная)
и) Схема строения атома.
к) Электронная формула.
л) Металл или неметалл.
м) Возможные степени окисления.
б) Относительная атомная масса.
в) Порядковый номер.
г) Заряд ядра атома.
д) Число протонов и нейтронов.
е) Общее число электронов.
ж) Номер периода.
з) Номер группы и подгруппа (главная или побочная)
и) Схема строения атома.
к) Электронная формула.
л) Металл или неметалл.
м) Возможные степени окисления.
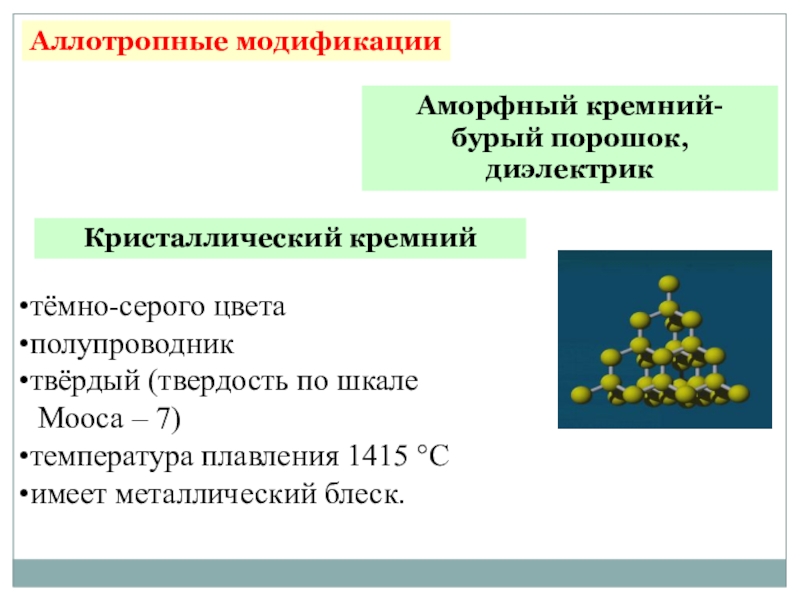
Слайд 12Кристаллический кремний
Аллотропные модификации
Аморфный кремний- бурый порошок, диэлектрик
тёмно-серого цвета
полупроводник
твёрдый (твердость по шкале
Мооса – 7)
температура плавления 1415 °С
имеет металлический блеск.
температура плавления 1415 °С
имеет металлический блеск.
Слайд 14Название этого элемента произошло от латинского “ляпис креманс”,что значит – камень,
дающий огонь. Так назывался твердый камень, дававший при ударе искру и долгое время служивший человеку вместо спичек для получения огня.
В 1825 году шведский химик Йёнс Якоб Берцелиус получил чистый элементарный кремний. Новому элементу было дано название “силиций” ( от лат. silex – кремень ). Русское название “кремний” введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе с греческого kremnos – “утес, гора ”.
В 1825 году шведский химик Йёнс Якоб Берцелиус получил чистый элементарный кремний. Новому элементу было дано название “силиций” ( от лат. silex – кремень ). Русское название “кремний” введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе с греческого kremnos – “утес, гора ”.
Si- кремний
Слайд 155. Способы получения
Лабораторный способ:
SiO2 + Mg =
Промышленный способ:
1900oC
SiO2 + C =
SiCl4 + Zn =
Слайд 20Химические свойства SiO2
Кислотный оксид
А) со щелочами: SiO2 + NaOH
Б) с
основными оксидами: SiO2 + CaO
2) с солями: SiO2 + CaCO3
Слайд 23Каковы компоненты, используемые для изготовления обычного стекла?
Они спекаются при высокой
температуре и получается однородная масса.
Это: кварцевый песок, известняк, сода.
Слайд 24Из расплавленной стеклянной массы можно изготовить изделие любой причудливой формы! Это
потом радует глаз и создает атмосферу красоты!
Слайд 25Витражи- заранее нарезанные и хорошо подогнанные друг к другу куски цветного
стекла обертываются по краям полосками свинца, раскладываются и плотно подгоняются один к другому, а затем свинцовые перемычки спаиваются из сплава олова и свинца с обеих сторон.
Слайд 26Стекло пока незаменимо для изготовления большого количества химической посуды, которая должна
выдерживать колебания высоких температур. Поэтому ее изготавливают из кварцевого стекла, полученного из чистого кварцевого песка или горного хрусталя.
Слайд 30СИТАЛЛ – материал
современной
лазерной оптики.
СИТАЛЛ применяется
в стоматологии.
Сейчас очень используются в
мире ситаллы – стеклокристаллические материалы, обладающие высокой твердостью, прочностью, износостойкостью, химической и термической стойкостью.
Поэтому они применяются при фрезеровке, сверлении, нанесении резьбы и т.д
Слайд 31SiO2 + Na2CO3 = Na2SiO3 + CO2
SiO2 + CaCO3 = CaSiO3 + CO2
Na2SiO3 + CaSiO3 + 4SiO2 = Na2O*CaO*6SiO2
Химизм процесса
производства стекла
Слайд 39Рефлексия
– Что нового узнали на уроке?
– Решили ли мы проблемную задачу?
–
Что вызвало затруднения?