- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Кислоты в свете ТЭД,классификация кислот (8 класс)
Содержание
- 1. Презентация: Кислоты в свете ТЭД,классификация кислот (8 класс)
- 2. Какие ощущения у Вас вызывает вид дольки лимона. Почему? А зелёного яблока?
- 3. Как Вы считаете с каким классом соединений
- 4. Составьте формулы кислот
- 5. По какому признаку кислоты разделены на группы?HF
- 6. А по каким признакам мы ещё можем разделить кислоты?Стр. 233 в учебнике, таблица 10
- 7. Заполним листок учёта знаний и выясним что
- 8. Слайд 8
- 9. ПРАВИЛА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С КИСЛОТАМИ Едкое
- 10. Химические свойства кислотКислота + металл = соль
- 11. Слайд 11
- 12. Слайд 12
- 13. Химические свойства кислот Кислота + оксид металла
- 14. Слайд 14
- 15. Кислота + основание = соль +
- 16. Химические свойства кислот Кислота 1 + соль
- 17. Химические свойства кислот КИСЛОТА +СОЛЬМеталл (до H, искл. конц Н2SO4, HNO3)Оксид металлаОснованиеСоль+Н2Н2ОН2Окислота=
- 18. Задание на дом: П. Кислоты и их классификация.Упражнение 4,5. Подготовить презентацию «Кислотные дожди.»
- 19. Информационные источники: Учебник «Химия 8» ФГОС М.
- 20. Спасибо за внимание и работу на уроке!
Слайд 1Ответим на вопрос:
КАК ОБЪЯСНИТЬ ЧТО ПРОИЗОШЛО?
В трёх пробирках находятся бесцветные
Слайд 3Как Вы считаете с каким классом соединений мы сегодня с Вами
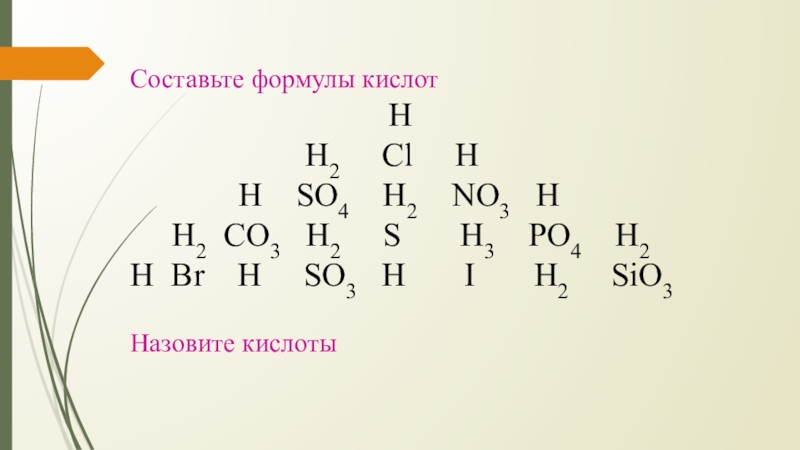
Слайд 4Составьте формулы кислот
Н2 Cl H
H SO4 H2 NO3 H
H2 CO3 H2 S H3 PO4 H2
H Br H SO3 H I H2 SiO3
Назовите кислоты
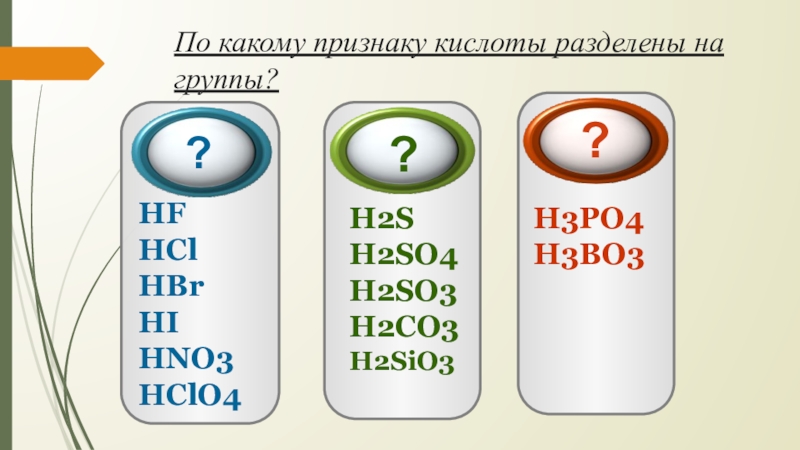
Слайд 5По какому признаку кислоты разделены на группы?
HF
HCl
HBr
HI
HNO3
HClO4
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
H3BO3
?
?
?
Слайд 7Заполним листок учёта знаний и выясним что нам предстоит изучить на
научиться разделять кислоты по признакам классификации;
установить причинно-следственную связь между строением и свойствами кислот в свете ионных представлений;
изучить общие химические свойства растворов кислот, научиться пользоваться рядом напряжений металлов и таблицей растворимости для прогнозирования возможных химических реакций кислот.
Слайд 9ПРАВИЛА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С КИСЛОТАМИ
Едкое вещество – кислота! Разрушает и
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Слайд 10Химические свойства кислот
Кислота + металл = соль + водород
Ряд активности металлов:
Li
Опыт 1. Взаимодействие цинка с соляной кислотой
Опыт 2. Взаимодействие металлов с кислотами
Слайд 13Химические свойства кислот
Кислота + оксид металла = соль + вода
Опыт.
СuO + H2SO4 =
CuSO4 + H2O
Слайд 15 Кислота + основание = соль + вода
Химические свойства кислот
HCl +
H2SO4 + Cu(OH)2 =
NaCl + H2O
CuSO4 + 2H2O
Опыт.
Слайд 16Химические свойства кислот
Кислота 1 + соль 1 = соль 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 =
BaSO4↓ + 2HCl
2. Если выделяется газ:
HNO3 + CaCO3 =
Ca(NO3)2 + H2O + CO2
2
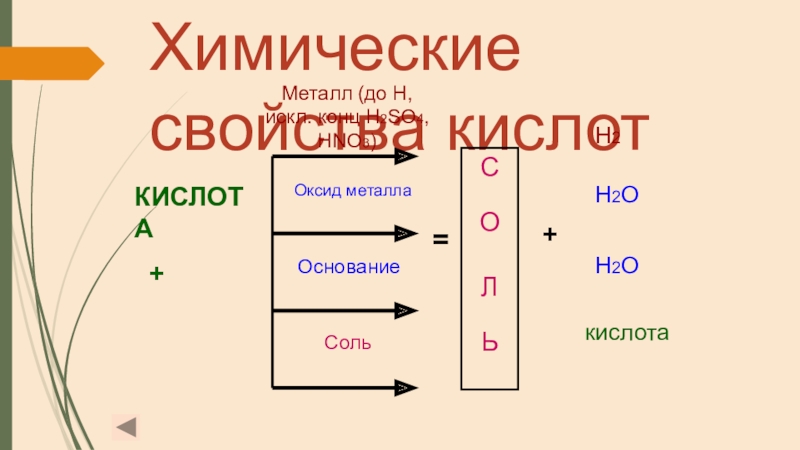
Слайд 17Химические свойства кислот
КИСЛОТА
+
С
О
Л
Ь
Металл (до H, искл. конц
Оксид металла
Основание
Соль
+
Н2
Н2О
Н2О
кислота
=
Слайд 18Задание на дом: П. Кислоты и их
классификация.
Упражнение 4,5. Подготовить
презентацию
Слайд 19Информационные источники:
Учебник «Химия 8» ФГОС М. Дрофа,2014
Габриелян О.С. Настольная
Маркина И.В. Современный урок химии. Ярославль. Академия развития. 2008
Правила техники безопасности при работе с кислотами. Анимация. http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swf
http://www.logosib.ru/him/HCl.jpg
http://forexaw.com/TERMs/Metal121313/img73211_4-1_Himicheskie_svoystva_zolota-rastvoryi.jpg