- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Кислоты и их свойства
Содержание
- 1. Презентация Кислоты и их свойства
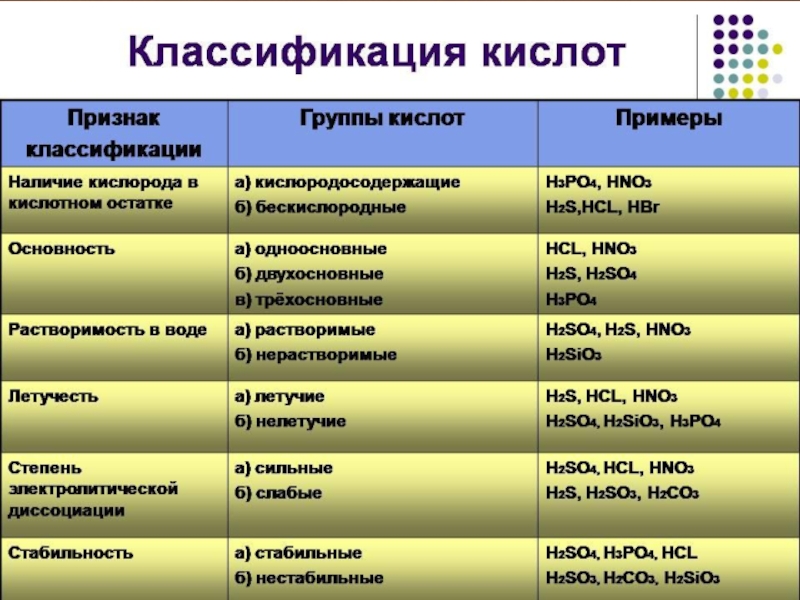
- 2. Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка
- 3. По основности:а)Одноосновные:HClO4, HCl б)Двухосновные:H2S,H2SO4в)Трехосновные:H3PO4Классификация кислот
- 4. По содержанию кислородаКислородсодержащие:HClO4,H2SO4Бескислородные:HCl,H2S
- 5. Сила кислот уменьшаетсяHClO4, H2SO4, HCl , H2SO3,
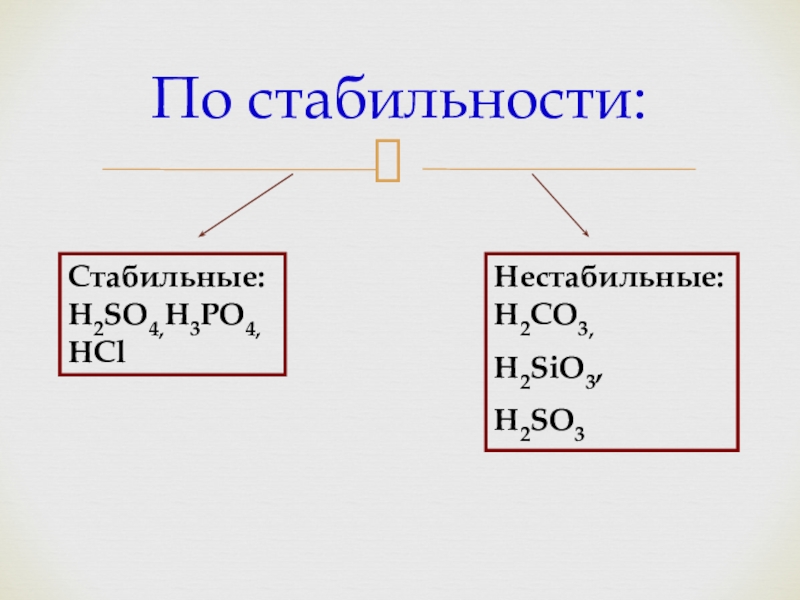
- 6. По стабильности:Стабильные:H2SO4,H3PO4,HClНестабильные:H2CO3,H2SiO3,H2SO3
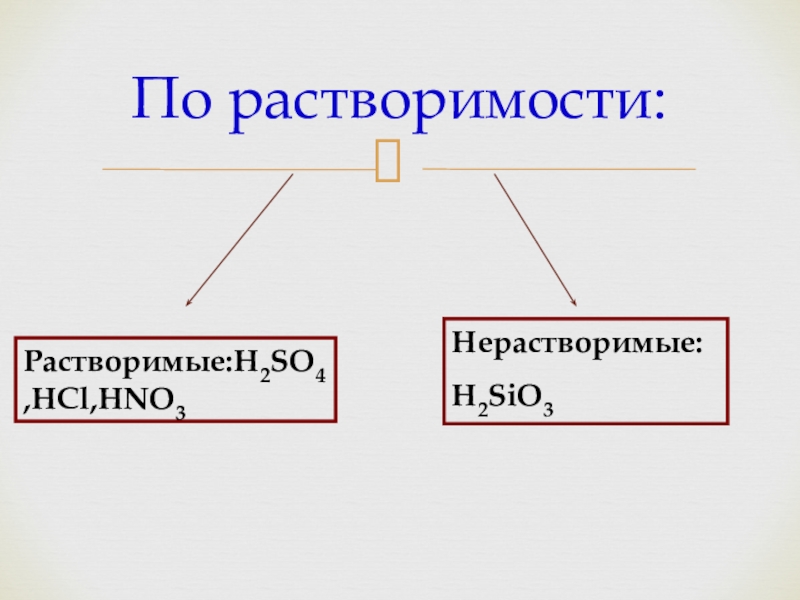
- 7. По растворимости:Растворимые:H2SO4,HCl,HNO3Нерастворимые:H2SiO3
- 8. Слайд 8
- 9. 1.Изменяют цвет индикатораХимические свойства кислот:
- 10. Три условия: кислота растворимая (кроме HNO3)Ме стоит
- 11. Условия: Все кислоты кроме нестабильных (H2CO3, H2SiO3)Образуется
- 12. Условия: Все кислоты кроме нестабильных (H2CO3, H2SiO3)Образуется
- 13. 1) H2SO4 + 2 KOH —> K2SO4
- 14. Должно выполняться одно из двух условий: Один
- 15. Слайд 15
- 16. 1. Кислотный оксид + Н2О → кислота
Слайд 1Классификация кислот и их свойства
Выполнила Федосова Светлана Васильевна, учитель химии МБОУ
Вязьма
2013
Слайд 2Кислоты – это сложные неорганические соединения, состоящие из протона водорода и
Слайд 3 По основности:
а)Одноосновные:HClO4, HCl
б)Двухосновные:H2S,H2SO4
в)Трехосновные:H3PO4
Классификация кислот
Слайд 10Три условия:
кислота растворимая (кроме HNO3)
Ме стоит в ряду активности до
Получается растворимая соль
1) Cu + НСl —> не идет
2) Zn + 2 HCl —> ZnCI2 + H2 ↑
2. Кислота + Металл→ соль + Н2
Слайд 11Условия:
Все кислоты кроме нестабильных (H2CO3, H2SiO3)
Образуется растворимая соль
1) 2 HCl
2) HNO3 + K2O —>
t
3) HCl + CuO —>
3. Кислота + основной оксид → соль + Н2О
Слайд 12Условия:
Все кислоты кроме нестабильных (H2CO3, H2SiO3)
Образуется растворимая соль
1) 6 HCl
2) HNO3 + ZnO —>
3) HCl + BeO —>
4. Кислота + амфотерный оксид → соль + Н2О
Слайд 131) H2SO4 + 2 KOH —> K2SO4 + 2 H2O
2) HCl
3) HNO3 + Zn(OH)2 —>
5. Кислота + основание → соль + Н2О (реакция нейтрализации)
Слайд 14Должно выполняться одно из двух условий:
Один из продуктов реакции –
Один из продуктов реакции выпадает в осадок
1) 2 HCl + CaCO3 —> CaCl2 + H2O + CO2↑
2) H2SO4 + BaCl2 —> BaSO4↓ + 2 HCl
3) HCl + AgNO3 —>
6. Кислота + соль → соль* + кислота*
Слайд 15
1) H2SiO3 —> H2O + SiO2
T, свет
2) 4 HNO3 —> 2 H2O + 4 NO2↑ + O2 ↑
7. При нагревании некоторые кислоты разлагаются. Как правило, образуются кислотный оксид и вода.
Слайд 161. Кислотный оксид + Н2О → кислота
2. Водород + НеМе → кислота
Н2 + Cl2 → 2 HCl
3. Кислота + соль → соль* + кислота*
t
2 NaCl + H2SO4 → Na2SO4 + 2 HCl↑
Способы получения кислот