Владимировна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к занятию по химии для студентов 1 курса колледжа по теме Виды химической связи. Ионная и ковалентная химическая связь
Содержание
- 1. Презентация к занятию по химии для студентов 1 курса колледжа по теме Виды химической связи. Ионная и ковалентная химическая связь
- 2. План Катионы, их образование из атомов в
- 3. Химическая связь - это взаимодействие двух атомов, осуществляемое
- 4. Виды химической связи:
- 5. Ионная связьКатионы образуются из атомов в результате
- 6. Ионная связьАнионы, их образование из атомов в
- 7. Ионная связь+11 Na⁰ 2,8,1 – е
- 8. Схема образования ионной связи
- 9. Выполните задания:В-11. В каком ряду находятся вещества
- 10. Классификация ионовПо составу:Простые - Na⁺, Са²⁺,
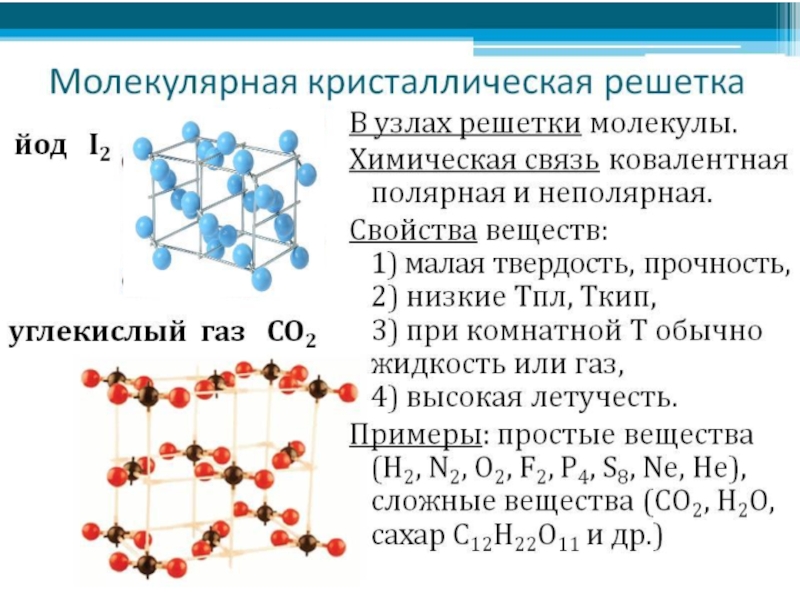
- 11. Типы кристаллических решетокЛюбое химическое вещество образованно большим
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Ковалентная химическая связь (неметалл + неметалл)
- 18. Ковалентная химическая связь (неметалл + неметалл)А)
- 19. Ковалентная химическая связь (неметалл + неметалл)Ковалентная
- 20. Выполните задания:В-11. В каком ряду находятся вещества
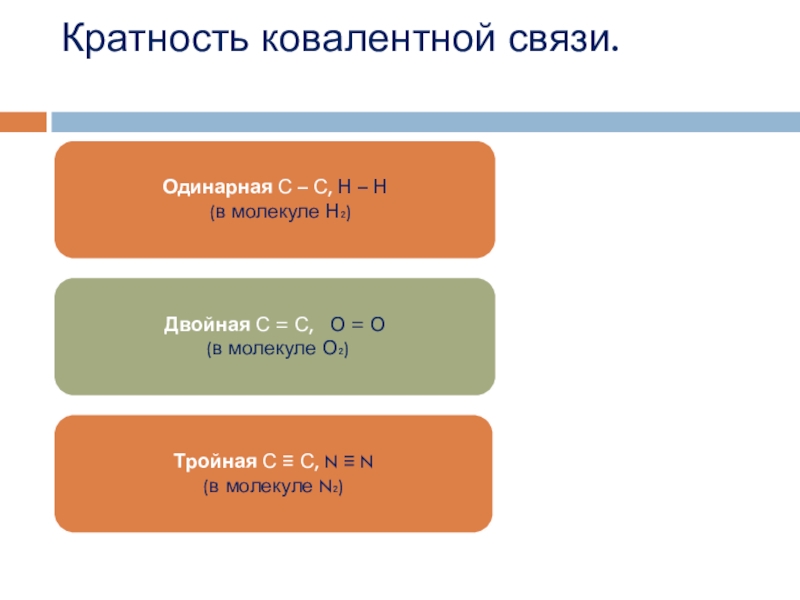
- 21. Кратность ковалентной связи.
- 22. Слайд 22
- 23. Кристаллические решетки.Атомные кристаллические решетки.
- 24. Свойства веществ с молекулярными и атомными кристаллическими решетками. Молекулярные кристаллические решеткиАтомные кристаллические решетки
- 25. Выполните задания Какой тип кристаллической решётки у следующих
План Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения. Классификация ионов: по составу, знаку
Слайд 1Виды химической связи. Ионная и ковалентная химическая связь.
Занятие 7
Преподаватель: Пимкова Эльза
Слайд 2План
Катионы, их образование из атомов в результате процесса окисления.
Анионы,
их образование из атомов в результате процесса восстановления.
Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
Классификация ионов: по составу, знаку заряда.
Ионные кристаллические решетки.
Свойства веществ с ионным типом кристаллической решетки.
Механизм образования ковалентной связи. Электроотрицательность.
Ковалентные полярная и неполярная связи.
Кратность ковалентной связи.
Молекулярные и атомные кристаллические решетки.
Свойства веществ с молекулярными и атомными кристаллическими решетками.
Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
Классификация ионов: по составу, знаку заряда.
Ионные кристаллические решетки.
Свойства веществ с ионным типом кристаллической решетки.
Механизм образования ковалентной связи. Электроотрицательность.
Ковалентные полярная и неполярная связи.
Кратность ковалентной связи.
Молекулярные и атомные кристаллические решетки.
Свойства веществ с молекулярными и атомными кристаллическими решетками.
Слайд 3Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами.
При образовании
химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную - Не) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.
Слайд 5Ионная связь
Катионы образуются из атомов в результате процесса окисления (отдачи электронов).
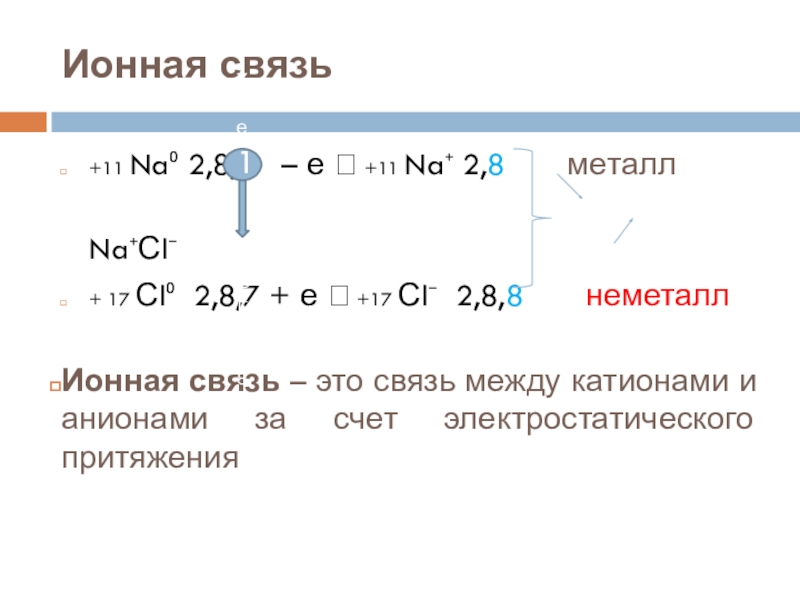
+11 Na⁰ 2,8,1 – е +11 Na⁺ 2,8 – процесс окисления
атом ион
(+) ион - катион
Слайд 6Ионная связь
Анионы, их образование из атомов в результате процесса восстановления (взятия
электронов).
+17 Сl⁰ 2,8,7 + е +17 Сl⁻ 2,8,8 – процесс окисления
атом ион
(-) ион - анион
+17 Сl⁰ 2,8,7 + е +17 Сl⁻ 2,8,8 – процесс окисления
атом ион
(-) ион - анион
Слайд 7Ионная связь
+11 Na⁰ 2,8,1 – е +11 Na⁺ 2,8
металл
Na⁺Сl⁻
+ 17 Сl⁰ 2,8,7 + е +17 Сl⁻ 2,8,8 неметалл
Ионная связь – это связь между катионами и анионами за счет электростатического притяжения
Na⁺Сl⁻
+ 17 Сl⁰ 2,8,7 + е +17 Сl⁻ 2,8,8 неметалл
Ионная связь – это связь между катионами и анионами за счет электростатического притяжения
17 Сl⁰ 2,8,7 + е 1 +17 Сl⁻ 2,8,8
Слайд 9Выполните задания:
В-1
1. В каком ряду находятся вещества только с ионной связью
– назвать выбранные вещества, указать заряды ионов:
А) K2O, Na2S, LiCl
Б) MgO, H2O, H2S
В) H2SO4, CO2, Cl2
2. Напишите схему образования химической связи в молекуле Al2S3
В-2
1. В каком ряду находятся вещества только с ионной связью – назвать выбранные вещества, указать заряды ионов:
А) F2, Fe, HCl
Б) N2, HCl, P2O5
В) NaCl, CaO, K3PO4
2. Напишите схему образования химической связи в молекуле Ca3N2
А) K2O, Na2S, LiCl
Б) MgO, H2O, H2S
В) H2SO4, CO2, Cl2
2. Напишите схему образования химической связи в молекуле Al2S3
В-2
1. В каком ряду находятся вещества только с ионной связью – назвать выбранные вещества, указать заряды ионов:
А) F2, Fe, HCl
Б) N2, HCl, P2O5
В) NaCl, CaO, K3PO4
2. Напишите схему образования химической связи в молекуле Ca3N2
Слайд 10Классификация ионов
По составу:
Простые - Na⁺, Са²⁺, Fe³⁺, Cl⁻, S²⁻
Сложные –
SO₄²⁻, NO₃⁻, PO₄³⁻
2. По знаку заряда:
Катионы - Na⁺, Са²⁺, Fe³⁺
Анионы - Cl⁻, S²⁻, SO₄²⁻, NO₃⁻
2. По знаку заряда:
Катионы - Na⁺, Са²⁺, Fe³⁺
Анионы - Cl⁻, S²⁻, SO₄²⁻, NO₃⁻
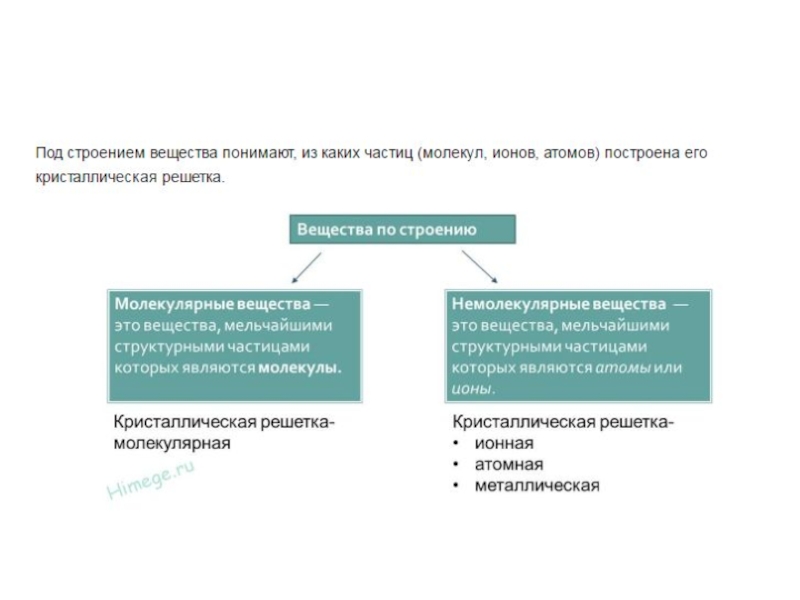
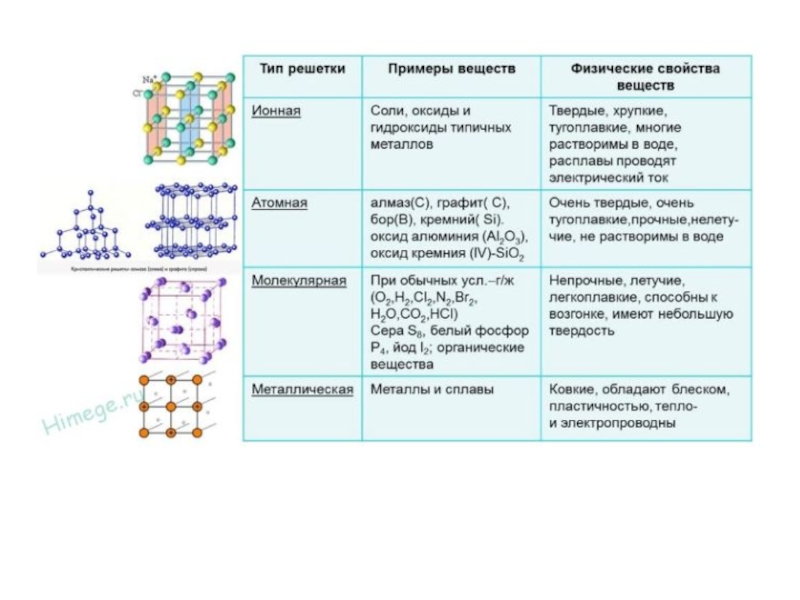
Слайд 11Типы кристаллических решеток
Любое химическое вещество образованно большим числом одинаковых частиц, которые
связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
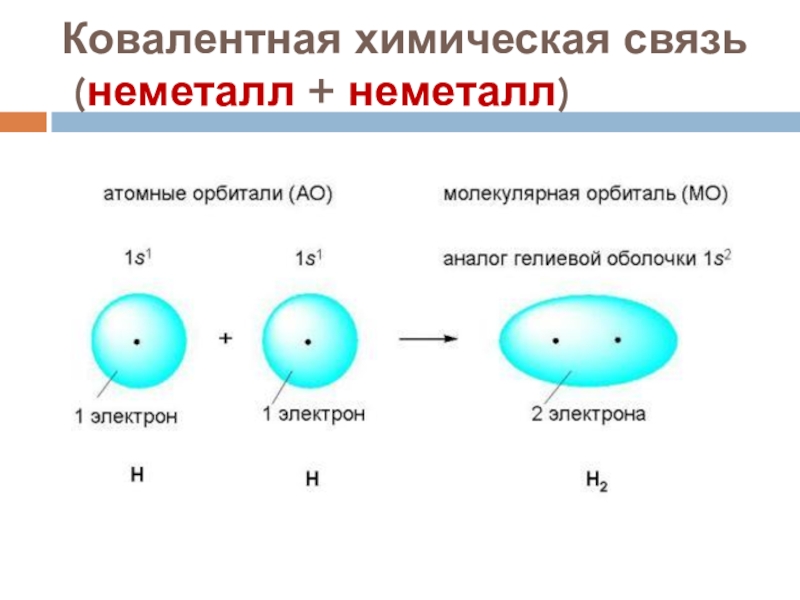
Слайд 18Ковалентная химическая связь
(неметалл + неметалл)
А) ковалентная неполярная связь.
Н● +
●Н → Н(●●)Н ,
эо = эо общая электронная пара
Н - Н (структурная формула)
эо - электроотрицательность.
Электроотрицательность – способность атомов удерживать свои электроны и притягивать электроны от других атомов.
эо = эо общая электронная пара
Н - Н (структурная формула)
эо - электроотрицательность.
Электроотрицательность – способность атомов удерживать свои электроны и притягивать электроны от других атомов.
Слайд 19Ковалентная химическая связь
(неметалл + неметалл)
Ковалентная химическая связь – это связь
с образованием общих электронных пар
Б) ковалентная полярная связь:
•• ••
Н● + ●Cl•• → Н(●●)Cl••
•• ••
Н - Cl (структурная формула)
Б) ковалентная полярная связь:
•• ••
Н● + ●Cl•• → Н(●●)Cl••
•• ••
Н - Cl (структурная формула)
Слайд 20Выполните задания:
В-1
1. В каком ряду находятся вещества только с ковалентной, указать
полярная или неполярная связь:
А) K2O Na2S LiCl
Б) MgO H2O H2S
В) H2SO4 CO2 Cl2
2. Напишите схему образования химической связи в молекуле РН3
А) K2O Na2S LiCl
Б) MgO H2O H2S
В) H2SO4 CO2 Cl2
2. Напишите схему образования химической связи в молекуле РН3
В-2
1. В каком ряду находятся вещества только с ковалентной связью, указать полярная или неполярная связь:
А) F2 Fe HCl
Б) N2 HCl P2O5
В) NaCl CaO K3PO 4
2. Напишите схему образования химической связи в молекуле H2O
Слайд 24
Свойства веществ с молекулярными и атомными кристаллическими решетками.
Молекулярные кристаллические решетки
Атомные кристаллические
решетки
Слайд 25Выполните задания
Какой тип кристаллической решётки у следующих широко используемых в быту
веществ:
вода,
уксусная кислота (CH3COOH),
сахар (C12H22O11),
калийное удобрение (KCl),
речной песок (SiO2) – температура плавления 1710 0C,
аммиак (NH3),
поваренная соль?
вода,
уксусная кислота (CH3COOH),
сахар (C12H22O11),
калийное удобрение (KCl),
речной песок (SiO2) – температура плавления 1710 0C,
аммиак (NH3),
поваренная соль?